帕瑞昔布钠对宫颈癌细胞COX-2/PGE2通路及细胞学行为的影响①
2022-02-21容凤娇杜佳楠蒋良富徐夏
容凤娇 杜佳楠 蒋良 富徐夏
(三亚中心医院麻醉科,三亚 572000)
宫颈癌是世界范围内女性最常见的癌症之一,且有80%都是在发展中国家,对女性健康造成了严重威胁[1]。病毒感染和环境因素是引起宫颈癌发生的主要因素,手术切除和放化疗是治疗宫颈癌的常用手段[2]。虽然对于宫颈癌的治疗策略不断发展和进步,但是仍然没有显著提高患者的生存率[3]。帕瑞昔布钠是一种环氧化合酶-2(COX-2)特异性抑制剂,属于镇痛药物,临床上常用于中度或重度术后急性疼痛的治疗,疗效高且不良反应低,能够减轻宫颈癌患者腹腔镜手术后的术后疼痛,提高治愈率[4]。COX-2在不同类型的肿瘤细胞中常发生过表达,其下游因子前列腺素E2(PGE2)可促进癌细胞迁移和侵袭,抑制COX-2/PGE2/转录激活子3(STAT3)信号通路可抑制前列腺癌细胞上皮间质转化(EMT)及相关基因的表达[5-6]。而帕瑞昔布钠可以浓度依赖性的方式降低癌细胞存活率,在MG-63人骨肉瘤细胞系中可通过抑制细胞增殖,促进细胞坏死以达到抗肿瘤效果[7]。但是,帕瑞昔布钠对宫颈癌细胞EMT及迁移侵袭能力的影响,目前尚未有报道。本研究以宫颈癌HeLa细胞为研究对象,通过检测帕瑞昔布钠在不同浓度和不同时间点对HeLa细胞存活率的影响,筛选出合适的浓度和时间点进行细胞行为学指标的检测,旨在揭示帕瑞昔布钠对宫颈癌HeLa细胞COX-2/PGE2通路及其EMT和迁移、侵袭能力的影响,为帕瑞昔布钠用于宫颈癌患者的治疗提供理论依据。
1 材料与方法
1.1 材料
1.1.1 细胞株及药品人宫颈癌细胞株HeLa(批号:TCHu187)购自中国科学院典型培养物保存委员会细胞库;帕瑞昔布钠(规格:40 mg,批号:20200219)购自瑞典法玛西亚公司。
1.1.2 主要试剂及仪器胎牛血清(FBS)和胰蛋白酶(批号:25300-057、25300-081)购自美国Gibco公司;DMEM/F12培养基(批号:SH30023K)购自美国Hyclone公司;Matrigel基质胶(批号:354471)和8 µm 24孔Transwell小室(批号:350619)购自美国Corning公司;碘化丙啶(PI)、磺酰罗丹明B(SRB)、GAPDH单克隆抗体和聚偏氟乙烯(PVDF)膜(批号:CD-100603G、CD-1007G、CD-1006L、CD-08193)购自美国Sigma公司;BCA蛋白定量试剂盒(批号:39224)和ECL显色试剂盒(批号:31007)购自北京中山金桥生物科技有限公司;96孔培养板(批号:B615006)购自上海生工生物工程有限公司;COX-2、PGE2、STAT3、蛋白激酶B(AKT)、磷酸化STAT3(p-STAT3)、磷酸化AKT(p-AKT)、E-钙黏蛋白(E-cad‑herin)、波形蛋白(vimentin)、基质金属蛋白酶2(MMP2)、基质金属蛋白酶组织抑制剂2(TIMP2)单克隆抗体和辣根过氧化物酶标记鼠抗人IgG二抗(批号:ab10940、ab14307、ab10225、ab26357、ab24771、ab50119、ab51276、ab60135、ab43107、ab57112、ab00317)购自美国Abcam公司。酶标仪(型号:Fax-20100)购自美国INStat公司;光学显微镜(型号:尼康SMZ745)购自上海普赫生物科技有限公司;全能型凝胶成像分析系统(型号:ChemiDoc-MP)购自山东三瑞科技有限公司;转膜仪和电泳仪(型号:170-3940、Mini Protean 3)购自美国Bio-Rad公司。
1.2 方法
1.2.1 细胞培养HeLa细胞用含10%胎牛血清的DMEM/F12培养基,置于含5%CO2的恒温培养箱中传代培养。取对数生长期的HeLa细胞进行实验。
1.2.2 SRB法检测不同浓度帕瑞昔布钠在不同时间上对细胞存活率的影响将对数生长期的HeLa细胞消化,制成细胞悬液,调整浓度为3×107~5×107个/ml,接种于96孔板中,每孔100 µl。培养24 h后,分别加入0、50、100、150、200、250、300µmol/L浓度的帕瑞昔布钠,继续培养24 h、48 h、72 h后,取出细胞,加入预冷后的50%三氯乙酸,至终浓度为10%,4℃条件下固定1 h,然后用去离子水冲洗5次,晾干,加入0.4%SRB染料染色10 min,0.1%醋酸洗5次,过夜晾干,最后加入150µl 1%Tris碱溶解,用酶标仪在570 nm波长下检测吸光值(OD值),计算细胞存活率。每组各设6个平行实验孔。细胞存活率(%)=(实验组OD570nm-空白组OD570nm)/(对照组OD570nm-空白组OD570nm)×100%。空白组只加培养液,对照组药物浓度为零。
1.2.3 Transwell小室法检测细胞迁移能力取HeLa细胞,用不含FBS的DMEM/F12培养基,制成细胞悬液,调整细胞浓度为1×109个/ml,取100µl细胞悬液接种到Transwell小室上室,同时加入不同浓度帕瑞昔布钠,下室加入600 µl含20%FBS的DMEM/F12培养基,37℃培养24 h后用棉签头擦掉小室内未迁移的细胞,下室膜上迁移过去的细胞用4%多聚甲醛室温固定20 min,PBS洗3次,甲醇再固定15 min,0.1%结晶紫室温染色40 min。用水冲洗多余的染液,晾干后,光学显微镜下,每组随机选取9个视野拍照,用Image J软件计数穿过微孔膜的细胞。实验重复6次。
1.2.4 Transwell小室法检测细胞侵袭能力取Matrigel基质胶,用预冷的DMEM/F12培养基按Matrigel基质胶∶培养基=1∶8的比例稀释成工作液,然后取50 µl铺于Transwell小室的上室,铺胶后置于37℃恒温培养箱过夜,待Matrigel基质胶凝固。取HeLa细胞,用不含FBS的DMEM/F12培养基,制成细胞悬液,调整细胞浓度为1.5×109个/ml,其余操作与1.2.3细胞迁移能力检测实验相同。实验重复6次。
1.2.5 Western blot检测细胞COX-2、PGE2、STAT3、AKT、p-STAT3、p-AKT、E-cadherin、vimentin、MMP2和TIMP2蛋白表达水平取即将长满单层的HeLa细胞,加入不同浓度帕瑞昔布钠,37℃培养24 h后,1 200 r/min离心5 min,收集细胞,PBS洗涤3次,加入RIPA裂解液,于冰上裂解30 min,4℃、12 000 r/min离心10 min后取上清,使用BCA蛋白定量试剂盒对蛋白进行定量,然后进行聚丙烯酰胺凝胶电泳,湿式转移法转至PVDF膜,5%脱脂奶粉封闭1 h,之后将PVDF膜置于1∶2 000浓度稀释后的COX-2、PGE2、STAT3、AKT、p-STAT3、p-AKT、E-cadherin、vimentin、MMP2和TIMP2一抗中4℃过夜孵育,缓冲液冲洗后,加入含辣根过氧化物酶缀合的二抗(1∶5 000稀释)室温孵育2 h,用ECL显色试剂盒显色,凝胶成像仪拍照,以GAPDH为内参,使用Image J软件分析蛋白条带灰度值。实验重复6次。
1.3 统计学分析本研究所得数据采用SPSS22.0软件进行统计分析,计量资料以±s表示,多组间比较采用单因素方差分析,进一步两两比较采用SNK-q检验,P<0.05为差异具有统计学意义。
2 结果
2.1 不用浓度帕瑞昔布钠在不同时间点对HeLa细胞存活率的影响如表1所示,与0 µmol/L帕瑞昔布钠处理相比,除50 µmol/L帕瑞昔布钠处理和100 µmol/L处理24 h外,其余各时间点不同浓度的帕瑞昔布钠对HeLa细胞存活均有显著抑制作用(P<0.05),且呈浓度和时间依赖性。由于100µmol/L帕瑞昔布钠处理24 h对HeLa细胞存活率的抑制与0 µmol/L帕瑞昔布钠处理24 h差异无统计学意义(P>0.05),因此选择最大浓度100µmol/L处理24 h进行后续实验遂将后续实验分别采用0 µmol/L、25µmol/L、50 µmol/L、100 µmol/L帕瑞昔布钠处理HeLa细胞,24 h后检测其细胞学行为。
表1 不同浓度帕瑞昔布钠在不同时间点对HeLa细胞存活率的影响(±s,n=6,%)Tab.1 Effects of different concentrations of parecoxib sodium on survival rate of HeLa cells at different time points(±s,n=6,%)
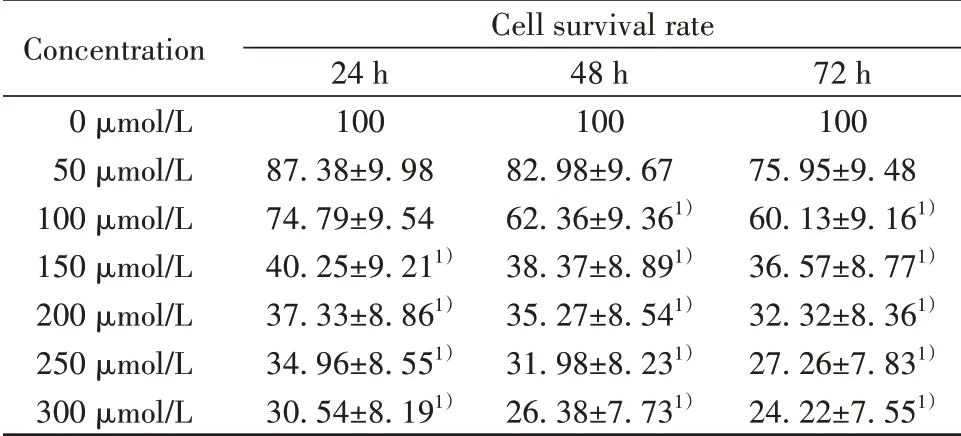
表1 不同浓度帕瑞昔布钠在不同时间点对HeLa细胞存活率的影响(±s,n=6,%)Tab.1 Effects of different concentrations of parecoxib sodium on survival rate of HeLa cells at different time points(±s,n=6,%)
Note:1)P<0.05 vs 0µmol/L.
Concentration 0µmol/L 50µmol/L 100µmol/L 150µmol/L 200µmol/L 250µmol/L 300µmol/L Cell survival rate 24 h 100 87.38±9.98 74.79±9.54 40.25±9.211)37.33±8.861)34.96±8.551)30.54±8.191)48 h 100 82.98±9.67 62.36±9.361)38.37±8.891)35.27±8.541)31.98±8.231)26.38±7.731)72 h 100 75.95±9.48 60.13±9.161)36.57±8.771)32.32±8.361)27.26±7.831)24.22±7.551)
2.2 帕瑞昔布钠对HeLa细胞迁移和侵袭能力的影响与帕瑞昔布钠0 µmol/L组相比,帕瑞昔布钠25µmol/L、50µmol/L、100µmol/L组HeLa细胞迁移和侵袭实验穿膜细胞数依次减少(均P<0.05),呈剂量依赖性,即表示细胞迁移和侵袭能力依次降低。见表2和图1。

图1 各组HeLa细胞迁移和侵袭(结晶紫染色,×200)Fig.1 Migration and invasion of HeLa cells in each group(crystal violet staining,×200)
表2 帕瑞昔布钠对HeLa细胞迁移和侵袭能力的影响(±s,n=6)Tab.2 Effect of parecoxib sodium on migration and inva⁃sion of HeLa cells(±s,n=6)

表2 帕瑞昔布钠对HeLa细胞迁移和侵袭能力的影响(±s,n=6)Tab.2 Effect of parecoxib sodium on migration and inva⁃sion of HeLa cells(±s,n=6)
Note:1)P<0.05 vs parecoxib sodium 0 µmol/L group;2)P<0.05 vs parecoxib sodium 25µmol/L group;3)P<0.05 vs parecoxib sodium 50µmol/L group.
Groups Parecoxib sodium 0µmol/L Parecoxib sodium 25µmol/L Parecoxib sodium 50µmol/L Parecoxib sodium 100µmol/L Number of penetrating cells in migration test 264.83±27.52 207.91±21.391)166.73±17.851)2)71.29±10.351)2)3)Number of penetrating cells in invasion test 147.58±15.32 109.25±12.141)78.29±9.431)2)33.45±4.281)2)3)
2.3 帕瑞昔布钠对HeLa细胞MMP2/TIMP2蛋白比值及E-cadherin、vimentin蛋白表达的影响与帕瑞昔布钠0 µmol/L组相比,帕瑞昔布钠25 µmol/L、50µmol/L、100µmol/L组HeLa细胞vimentin蛋白表达水平和MMP2/TIMP2蛋白比值依次降低,E-cad‑herin蛋白表达水平依次升高(均P<0.05),呈剂量依赖性。见图2、3。

图2 各 组HeLa细 胞E-cadherin、vimentin、MMP2和TIMP2蛋白表达条带图Fig.2 Protein expression bands of E-cadherin,vimentin,MMP2 and TIMP2 in HeLa cells of each group
2.4 帕瑞昔布钠对HeLa细胞COX-2、PGE2、p-STAT3、STAT3、p-AKT和AKT蛋白表达水平的影响与帕瑞昔布钠0 µmol/L组相比,帕瑞昔布钠25 µmol/L、50 µmol/L、100 µmol/L组HeLa细 胞COX-2、PGE2蛋白表达水平和STAT3、AKT磷酸化水平依次降低(均P<0.05),呈剂量依赖性。见图4、5。

图4 各 组HeLa细 胞COX-2、PGE2、p-STAT3、STAT3、p-AKT和AKT蛋白表达条带图Fig.4 Expression bands of COX-2,PGE2,p-STAT3,STAT3,p-AKT and AKT in HeLa cells of each group

图3 帕瑞昔布钠对HeLa细胞E-cadherin、vimentin、MMP2/TIMP2蛋白表达水平的影响Fig.3 Effect of parecoxib sodium on expression of E-cad⁃herin,vimentin and MMP2/TIMP2 in HeLa cells

图5 帕瑞昔布钠对HeLa细胞COX-2、PGE2、p-STAT3、STAT3、p-AKT和AKT蛋白表达水平的影响Fig.5 Effect of parecoxib sodium on expression of COX-2,PGE2,p-STAT3,STAT3,p-AKT and AKT in HeLa cells
3 讨论
宫颈癌是女性生殖系统中较为常见的肿瘤,恶性程度极高,癌细胞的迁移和侵袭是导致患者病情恶化,甚至死亡的原因[8]。宫颈癌复发率高,总体预后不理想[9],寻找新的治疗药物和策略是研究热点。
帕瑞昔布钠是缬昔布的前药,应用于创伤性和术后患者,避免阿片类药物引起的副作用,在术后的多模式镇痛和增强康复中发挥重要作用[10]。帕瑞昔布钠可抑制乳腺癌患者的炎症反应,改善患者的免疫功能,能有效增强胶质母细胞瘤的免疫治疗效果,抑制其增殖、迁移和侵袭[11-12]。诱导HeLa细胞EMT,可促进细胞侵袭和迁移,细胞发生EMT后,上皮组织不再具有保护作用,上皮标记因子E-cad‑herin表达量减少,同时间质标记因子vimentin表达量升高[13-14]。MMP2和TIMP2为迁移侵袭相关蛋白,MMP2蛋白表达水平的降低可抑制HeLa细胞的侵袭和迁移,TIMP2为MMP2抑制物,调控MMP2/TIMP2的平衡可起到抗肺癌细胞转移的作用[15-16]。本研究采用宫颈癌HeLa细胞为研究对象,使用帕瑞昔布钠处理HeLa细胞,发现帕瑞昔布钠作用24、48、72 h后均可降低HeLa细胞存活率,25 µmol/L、50µmol/L、100µmol/L帕瑞昔布钠作用24 h,可显著降低其迁移侵袭能力、vimentin蛋白表达水平及MMP2/TIMP2蛋白比值,提高E-cadherin蛋白表达水平,提示帕瑞昔布钠可降低HeLa细胞的EMT和迁移侵袭能力,但是否影响COX-2/PGE2通路,尚需进一步研究。
COX-2通路参与结肠癌细胞EMT发生,COX-2的上调可导致PGE2过度合成,而PEG2可通过显著提高MMP2活性,增加癌细胞的侵袭和迁移,因此,降低COX-2表达,可通过减少PGE2的合成降低MMP-2活性,进而减弱癌细胞增殖、侵袭和迁移能力,促进癌细胞凋亡[17-19]。COX-2/PGE2/STAT3/AKT参与癌症干细胞EMT,抑制STAT3和AKT磷酸化,可使细胞迁移能力受阻[20-21]。本研究发现,帕瑞昔布钠能剂量依赖性地降低COX-2和PGE2蛋白表达水平及其下游因子STAT3和AKT磷酸化水平。另外,COX-2/PGE2通路参与妇科肿瘤发生及炎症反应[22]。ZHANG等[23]研究发现青蒿琥酯能够通过抑制COX-2的表达,降低宫颈癌细胞迁移和侵袭能力,从而达到抗宫颈癌细胞转移的效果。结合本研究提示帕瑞昔布钠亦可能通过抑制COX-2/PGE2通路,进而抑制HeLa细胞EMT及迁移侵袭能力。
综上所述,帕瑞昔布钠可剂量依赖性抑制宫颈癌HeLa细胞EMT和迁移侵袭能力,可能与抑制COX-2/PGE2通路有关,为临床上使用帕瑞昔布钠治疗宫颈癌提供了理论依据,但是帕瑞昔布钠对宫颈癌细胞行为学的作用机制十分复杂,尚需深入研究。
