三七注射液对慢性肾衰竭大鼠肠道菌群多样性结构的影响研究
2022-02-21麦文顶黄志敏江旖旎邱少彬陆良喜吴金玉
麦文顶,黄志敏,唐 宇,江旖旎,邱少彬,邱 菲,陆良喜,吴金玉
(1.广西中医药大学,广西 南宁 530000;2. 广西中医药大学第一附属医院,广西 南宁 530023;3. 广西中医药大学第一附属医院仁爱分院,广西 南宁 530023)
慢性肾衰竭(chronic renal falure,CRF)是一种常见的肾脏疾病,其特征是肾功能逐渐下降。CRF是各种慢性肾脏病持续发展的结局,患者的肾脏功能受到不可逆性的损伤,并引起多系统受累,严重威胁患者生命。胃肠道症状是慢性肾脏病患者常见临床表现,在病程的初期即可发生[1],且众多实验验证了CRF会造成肠道菌群紊乱这一观点[2-4]。Meijers等[5]在2011年首次提出肠肾轴理论,指明了肠道功能在肾脏疾病的发展中起到重要作用,为肾脏疾病的治疗提供了新思路。现代研究表明,肠道可分泌尿毒素,并影响其代谢[6]。在肾脏疾病发展过程中,肾脏功能减弱,代谢毒素功能障碍,毒素在肠道蓄积,肠道原有的菌群结构被打破,有害微生物大量繁殖而有益菌群被抑制,各类毒素大量产生,甚至通过肠道屏障进入血液,流向全身各系统,增加CRF患者死亡的风险。中医学认为“脾肾亏虚、浊毒瘀阻”为CRF基本病机,“瘀”贯穿于CRF始终[7],CRF引起的肾“瘀”是引起脾胃、肠道功能失调的根本,肠肾轴理论与其不谋而合。前期研究发现,三七注射液有减轻微炎症状态、改善肾功能、延缓肾纤维化进程的作用[8-10],但其基于肠肾轴理论的作用机制和靶点尚未明确。本研究主要探讨三七注射液对CRF大鼠肠道菌群多样性结构的影响,进一步明确三七注射液基于肠肾轴理论在治疗CRF过程中的作用靶点和机制,为三七治疗CRF提供依据。
1 实验材料与方法
1.1实验动物 SD(Sprasue-Dawley)雄性大鼠120只,购自长沙天勤公司,鼠龄10~12周,体重(200±36)g,实验动物批号:00098611。大鼠在广西中医药大学第一附属医院医学分子生物学实验室饲养,饲养室内温度为18~25 ℃、湿度为50%~60%,分笼饲养,常规大鼠维持型颗粒饲料喂养,正常饮水、摄食,灯光按自然日常照明、12 h明暗交替,定时清洗笼舍,打扫动物房。
1.2药物 三七注射液,广西中医药大学第一附属医院,100 mL/瓶,含生药20 g,桂卫药制号(1998)005121;盐酸贝那普利片,北京诺华制药有限公司,国药准字H20000292。
1.3实验方法 将大鼠随机分为正常组、模型组、三七低剂量组、三七中剂量组、三七高剂量组、贝那普利组,每组20只。正常组无处理,其余5组大鼠均采用国际通用的5/6肾脏切除法建立CRF模型[11]。 造模成功后,正常组与模型组大鼠给予生理盐水10 mL/(kg·d)腹腔注射,三七低、中、高剂量组大鼠分别给予三七注射液1 g生药/(kg·d)、2 g生药/(kg·d)、3 g生药/(kg·d)腹腔注射,贝那普利组给予盐酸贝那普利5 mg/(kg·d)灌胃,均1次/d,共8周。
1.4检测指标及方法
1.4.1肾功能指标 干预8周实验结束24 h后,对各组大鼠腹主动脉采血约4 mL,采用生化法检测尿素氮(BUN)、血肌酐(SCr)水平。
1.4.2粪便生物多样性分析 干预8周实验结束24 h后,在灭菌超净台上操作,收集大鼠粪便:预先使用紫外线对操作所需材料和操作室进行灭菌,随后将滤纸放入笼具,每笼放入大鼠1只。在大鼠肛门和下腹部,用镊子进行轻度刺激,促进大鼠排便,排便后立刻收集粪便,放入冻存管中并做好标记放入液氮中,0.5 h后移入-80 ℃冰箱保存。共收集到33个粪便标本,其中正常组、模型组、贝那普利组各5个,三七低、中、高剂量组各6个。将粪便标本提取样品总DNA后,基于Illumina HiSeq测序平台,采用双末端测序(Paired-End)法获得测序序列,进行拼接质控、优化数据,OTU聚类分析,在门、属水平上统计各样品群落组成;使用α多样性分析、β多样性分析等分析方法,在多层面上对肠道菌群进行分析,挖掘样品之间的差异(委托北京百迈客生物科技有限公司完成)。
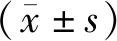
2 结 果
2.1各组大鼠血清BUN、SCr水平比较 正常组与各药物干预组BUN、SCr水平均明显低于模型组(P均<0.05),且三七高剂量组均明显低于三七低剂量组、三七中剂量组和贝那普利组(P均<0.05),三七中剂量组和贝那普利组均明显低于三七低剂量组(P均<0.05),贝那普利组均明显低于三七中剂量组(P均<0.05)。见表1。

表1 正常组及慢性肾衰竭各组大鼠血清BUN、SCr水平比较
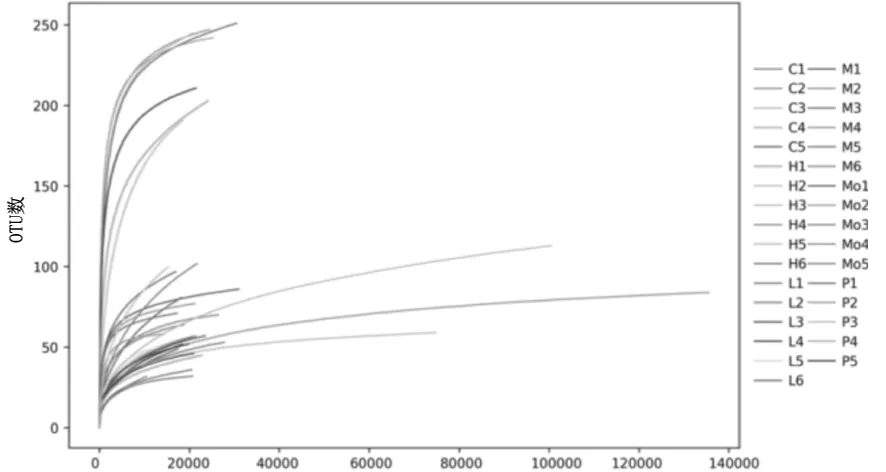
2.2各组大鼠肠道菌群多样性分析 α多样性分析显示,模型组Shannon、ACE、Chao指数均明显低于正常组(P均<0.05);三七低、中剂量组ACE、Chao指数均明显高于模型组(P均<0.05),且三七中剂量组ACE、Chao指数均明显高于三七低剂量组(P均<0.05);三七高剂量组与贝那普利组Shannon、ACE、Chao指数均明显高于模型组、三七低剂量组、三七中剂量组(P均<0.05),但三七高剂量组Shannon、ACE、Chao指数均明显低于贝那普利组(P均<0.05)。见表2。根据样本在不同测序深度时的OTU数和Shannon指数,分别绘制稀释性曲线和香农曲线(见图1及图2),可见样本在15000 Reads左右时曲线逐渐进入平台期,代表测序数据量足够。

表2 正常组及慢性肾衰竭各组大鼠肠道菌群Shannon指数、ACE指数、Chao指数比较
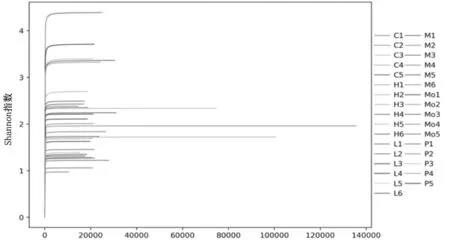
2.3各组大鼠肠道菌群相似度比较分析 使用QIIME软件进行β多样性分析,通过主坐标分析法(PCoA)来评估菌群的β多样性,并据此绘制PCoA分析图,显示正常组与三七低剂量组、三七中剂量组、贝那普利组样本间距离较为接近(相似性高),三七高剂量组与其余各组样本间距离差距较大。见图3。
2.4各组大鼠肠道菌群物种组成分析 将OTU的代表序列与微生物参考数据库进行比对得到每个OTU对应的物种分类信息,进而在门、属水平统计各样品群落组成。
测序序列数C代表正常组;L代表三七低剂量组;M代表三七中剂量组;H代表三七高剂量组;Mo代表模型组;P代表贝那普利组;数字为组内样本编号
测序序列数C代表正常组;L代表三七低剂量组;M代表三七中剂量组;H代表三七高剂量组;Mo代表模型组;P代表贝那普利组;数字为组内样本编号
横、纵坐标分别为两个特征值,百分数代表其对样品间差异的影响程度
2.4.1门水平组成分析 样本细菌在门水平的分布以及各组样本平均丰度组成中,厚壁菌门(Firmicutes)相对丰度百分比最高,平均超过75%,见图4。贝那普利组拟杆菌门(Bacteroidetes)相对丰度百分比次之,其余各组样本中变形菌门(Proteobacteria)相对丰度百分比次之,其他菌门相对丰度百分比均不到1%,见图5。
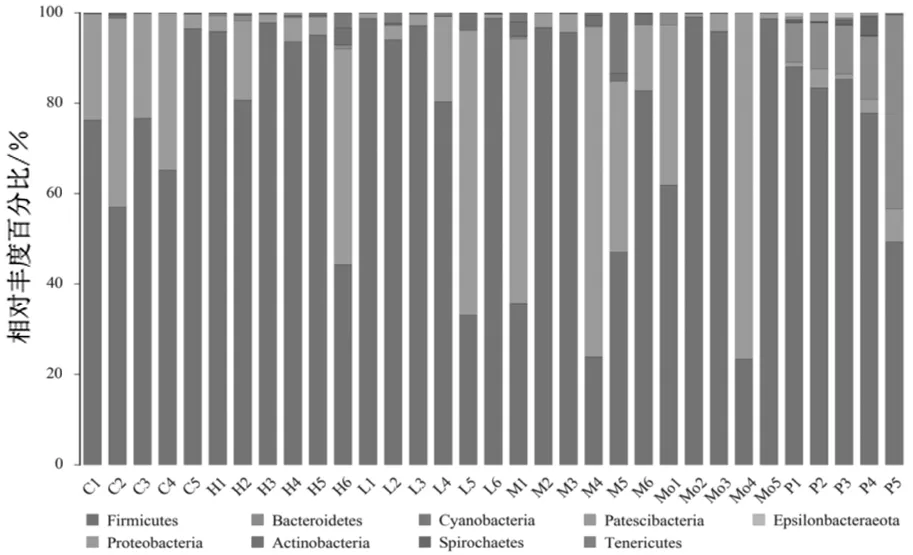
C代表正常组;L代表三七低剂量组;M代表三七中剂量组;H代表三七高剂量组;Mo代表模型组;P代表贝那普利组;数字为组内样本编号
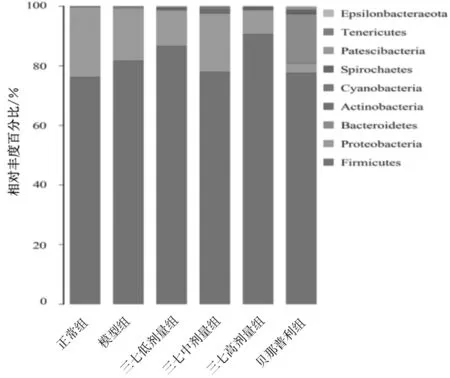
图5 正常组及慢性肾衰竭各组大鼠粪便样本菌群门水平组成情况
2.4.2属水平组成分析 各样本在属水平上共检测到51种丰度大于0.1%的细菌,细菌组成和丰度之间的差异随着细菌分类的细化而越发明显,见图6。相对于模型组和三七低剂量组,贝那普利组、三七高剂量组和三七中剂量组中大肠杆菌-志贺菌属(Escherichia-Shigella)丰度下降显著,乳杆菌属(Lactobacillus)、毛螺菌属(Lachnospiraceae_NK4A136_group)、未培养的细菌(uncultured_bacterium_f_ Muribaculaceae)、瘤胃菌属(Ruminococcaceae_UCG-014)、瘤胃球菌属(Ruminococcus_1)等丰度显著上升,且以三七高剂量组最为显著,见图7。
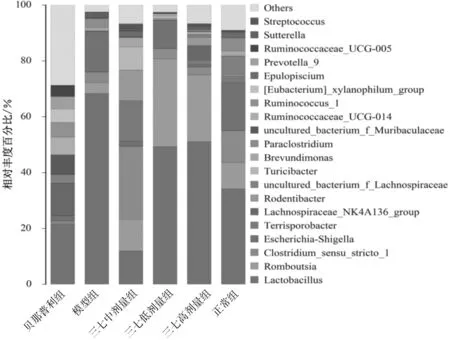
图7 正常组及慢性肾衰竭各组大鼠粪便样本菌群属水平组成情况
3 讨 论
CRF的进展伴随各种并发症,其中厌食、恶心、呕吐、腹泻、便秘等胃肠道症状最常见,主要是由肾脏疾病恶性发展使毒素堆积及排泄障碍所致[12]。肠肾轴理论提出后,越来越多的研究发现CRF与肠道之间存在明显关系,并且这种影响是双向的、多方面的[13-15]:①CRF患者肾脏排泄功能减弱,大量毒素堆积造成肠道微生态系统紊乱,首先是益生菌减少,其次腐生菌过度生长,肠道菌群结构的改变使体内生态系统的稳态平衡被打破;②体内炎症反应增强,破坏黏膜屏障,增加肠道黏膜屏障的通透性,进而损害肠道屏障功能;③肠道内有害代谢产物生成增多,毒素排泄障碍而不断蓄积,肠源性毒素、条件致病菌及致病菌移位进入血液循环,又加剧了组织损害,同时也加快了CRF的发展。
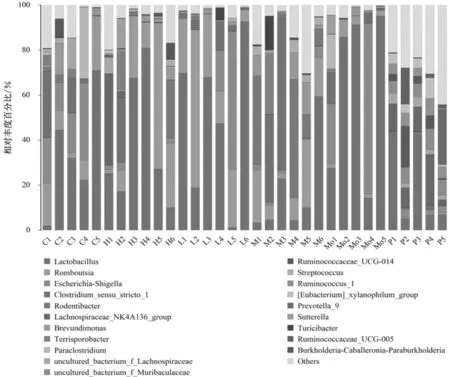
C代表正常组;L代表三七低剂量组;M代表三七中剂量组;H代表三七高剂量组;Mo代表模型组;P代表贝那普利组;数字为组内样本编号
肠道具有消化、排泄等功能,寄生有大约1 100种微生物,其总数约为1 014个,在其组成结构中细菌占主要部分,因其相互间会产生各种反应,如免疫应答等,因此肠道被认为是人体最大的免疫器官[16]。根据肠道菌群与宿主的关系,可将其大致分为3种:①有益菌群,如双歧杆菌等具有营养和免疫调节作用;②条件致病菌群,如肠球菌等,在健康机体的肠道中无害,特定条件下具备侵袭性,危害宿主身体健康;③寄生的病原菌群,如致病性大肠杆菌、弯曲杆菌及部分真菌等,在健康机体肠道生态平衡时数量较少,其数量增加会消耗能量产生对宿主有害的代谢产物[13]。谢珊[2]报道,人体肠道菌群主要由7门组成,其中拟杆菌门与厚壁菌门在肠道菌群中约占90%,而CRF患者普遍具有肠道菌群结构失调的现象,并提出这种失调的特征是低丰度类群最先受到影响,并且对肠道健康有益的菌群数量显著减少。本研究显示,CRF大鼠血清BUN和SCr水平明显升高,三七注射液干预各组血清BUN和SCr水平且呈剂量依赖性降低。提示三七注射液具有改善肾功能作用,以中、高剂量作用显著。
本实验对6组33个粪便样本进行了测序分析,根据稀释性曲线和香农曲线分析证明测序数量及样本数足够满足实验要求。33个粪便样本共获得有效序列1 111 126条,序列有效长度350~500 bp,双端序列拼接、过滤后共产生1 017 408条Clean tags,每个样品至少产生11 164条Clean tags,平均产生30 831条Clean tags。将优化序列进行聚类,划分OTU,在97%的相似水平下获得2 477类OTU,基于OTU分析结果,通过α多样性分析研究样品内部的物种多样性,通过统计学分析计算各样品在97%相似度水平下的Shannon、ACE及Chao共3个指数。Shannon指数的大小取决于样品群落中的物种丰度和物种均匀度,是衡量物种多样性的指标。当样品的物种丰度相同,群落中各物种均匀度越大,则群落多样性越大。Shannon指数的大小反映了样品物种多样性的高低;ACE和Chao指数则主要受菌落丰度水平影响,用于衡量物种丰度即物种数量的多少。肠道菌群相似度是反映肠道功能和生理状态的典型表现之一,证候、环境以及体型的不同都会导致肠道菌群相似性出现差异[17-19]。本实验结果显示,模型组大鼠Shannon、ACE、Chao指数明显低于正常组,各药物干预组均明显高于模型组,提示三七注射液和贝那普利均可改善CRF大鼠肠道菌群多样性。近年来研究显示,CRF患者存在致病菌增多、益生菌减少的情况[20]。温珍亮[21]研究报道,大肠杆菌-志贺菌属仅在肠道损伤时出现并大量增加,在稳态及肠道损伤好转时不能被检出。本实验结果显示,三七注射液干预后在属水平上CRF大鼠的肠道细菌分布比例有较大改变,中、高剂量组中乳杆菌属、毛螺菌属、瘤胃菌属、瘤胃球菌属丰度显著上升,大肠杆菌-志贺菌属丰度明显下降,提示中、高剂量的三七注射液更有助于改善菌群结构。
综上所述,CRF大鼠体内肠道菌群多样性减少,菌群结构被破坏,代谢毒素增多,符合肠肾轴理论内涵;三七注射液干预可改善肠道菌群多样性和菌群结构,保护肾脏功能,减少代谢毒素产生,以中、高剂量作用明显。提示三七注射液延缓CRF大鼠病程进展的机制可能与其调节肠道菌群多样性和菌群结构有关。
利益冲突:所有作者均声明不存在利益冲突。
