双歧杆菌三联活菌辅助非布司他治疗痛风发作间歇期患者的疗效研究Δ
2022-02-21王萍,许俊
王 萍,许 俊
(上海交通大学医学院附属新华医院崇明分院消化内科,上海 202150)
痛风是代谢性疾病,其病理基础为血尿酸(UA)水平升高。嘌呤代谢紊乱、单钠尿酸盐沉积不仅造成关节疼痛活动障碍,累及肾脏受损,而且与冠心病、高血压等多种心脑血管疾病密切相关[1]。流行病学调查结果显示,我国人群中,高尿酸血症患病率已高达13%[2];随着饮食结构改变、高蛋白食物增加,我国高尿酸血症和痛风的患病率也在升高[3]。在痛风急性发作期,应尽早开始抗炎镇痛治疗,对于痛风发作间歇期、慢性期患者,治疗方案以降低UA和碱化尿液为主,一线用药包括非布司他、别嘌醇和苯溴马隆等[4]。近年来,国内外研究结果发现,肠道菌群与嘌呤代谢密切相关[5-6]。动物实验方面,邓英[7]认为乳酸杆菌可通过提高黄嘌呤氧化酶(XOD)的浓度与活性,改善高果糖饮食诱导的小鼠高尿酸血症。本研究探讨了双歧杆菌三联活菌辅助非布司他治疗痛风发作间歇期患者的效果及其对患者肠道菌群的影响,现报告如下。
1 资料与方法
1.1 资料来源
研究方案经我院伦理委员会批准,选取2019年3月至2021年3月我院收治的痛风间歇期患者110例。纳入标准:(1)符合《中国高尿酸血症与痛风诊疗指南》中痛风的诊断标准;(2)处于痛风间歇期,血UA>420 μmol/L;(3)年龄>18岁,对本研究知情,签署知情同意书。排除标准:(1)合并消化系统疾病,入组前1个月内曾使用促胃肠动力药者;(2)入组前1个月内曾使用抗菌药物、糖皮质激素和微生态制剂等影响UA、肠道菌群的药物者;(3)合并严重心血管疾病、严重肝肾功能异常者;(4)合并恶性肿瘤者;(5)合并免疫系统疾病者;(6)妊娠期及哺乳期妇女。采用区组随机化分组法(区组长度5),将患者分为非布司他组55例和活菌辅助组55组。非布司他组患者中,男性39例,女性16例;平均年龄(52.41±4.67)岁;平均病程(3.42±1.03)年。活菌辅助组患者中,男性41例,女性14例;平均年龄(54.08±3.99)岁;平均病程(4.15±1.66)年。两组患者的一般资料相似,具有可比性。
1.2 方法
所有患者均控制饮食,禁烟禁酒,限制高嘌呤食物摄入,不食用含有益生菌的酸奶制品等食物。两组患者均口服非布司他片(规格:40 mg),起始剂量1次40 mg,1日1次,缓慢加量至80 mg/d,1日1次。在此基础上,活菌辅助组患者口服双歧杆菌三联活菌胶囊(规格:0.21 g),1次420 mg,1日3次。两组患者均连续治疗8周。
1.3 观察指标
(1)于患者入组时、治疗结束后检测血清白细胞介素1β(IL-1β)、白细胞介素6(IL-6)和XOD水平;检测尿素氮(BUN)、肌酐(Cr)、UA和红细胞沉降率(ESR)等指标水平。(2)采用实时逆转录聚合酶链反应(RT-PCR)测定肠道菌群。收集新鲜粪便标本于无菌培养皿内,置于-80 ℃冰箱冻存,称取中段粪便0.2 g置于冰盒运送至委托进行肠道菌群检测公司实验室,由委托公司提取DNA,使用RT-PCR检测两组患者治疗前后肠道菌群变化。(3)记录治疗期间两组患者的痛风发作情况。
1.4 统计学方法
2 结果
非布司他组1例患者因交通意外中断治疗,其余患者均完成治疗。
2.1 两组患者治疗前后炎症因子和XOD水平比较
治疗前,两组患者IL-1β、IL-6和XOD水平比较,差异无统计学意义(P>0.05)。治疗后,两组患者上述指标均较治疗前降低,活菌辅助组患者的IL-1β(P<0.05)、IL-6(P<0.05)和XOD(P<0.01)水平低于非布司他组,差异均有统计学意义,见表1。
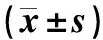
表1 两组患者治疗前后血清炎症因子和XOD水平比较
2.2 两组患者治疗前后肾功能和ESR水平比较
治疗前后,两组患者组内和组间BUN、Cr水平的差异均无统计学意义(P>0.05);治疗前,两组患者UA、ESR水平的差异无统计学意义(P>0.05);治疗后,两组患者UA、ESR水平较治疗前降低,且活菌辅助组患者低于非布司他组,组间比较的差异有统计学意义(P<0.05),见表2。
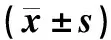
表2 两组患者治疗前后肾功能、ESR水平比较
2.3 两组患者治疗前后肠道菌群数量比较
治疗前,两组患者双歧杆菌、乳酸杆菌、粪肠球菌、拟杆菌和肠杆菌数量比较,差异无统计学意义(P>0.05)。非布司他组患者治疗前后上述各菌数量的差异无统计学意义(P>0.05)。治疗后,活菌辅助组患者双歧杆菌、乳酸杆菌、粪肠球菌和拟杆菌数量增加,肠杆菌数量减少,与治疗前和非布司他组同期比较,差异均有统计学意义(P<0.05),见表3。

表3 两组患者治疗前后肠道菌群数量比较
2.4 痛风急性发作情况
治疗期间,活菌辅助组患者的痛风急性发作率为3.64%(2/55),低于非布司他组的12.96%(7/54),但两组间差异无统计学意义(χ2=3.128,P=0.076)。
3 讨论
人体内的UA中,少量随汗液排出体外,大部分随尿液排出体外,约1/3通过肠道随粪便排出。定植于肠道的菌群,可参与消化、代谢、营养吸收、微量元素合成和免疫功能调节等多种重要生理功能[8]。肠道菌群稳态的变化,与多种疾病的发生密切相关。Jackson等[9]采用宏基因组关联技术进行相关性队列分析发现,2型糖尿病、复发性尿路感染、胆石症、骨关节炎、炎症性肠病、便秘和痤疮等17种疾病与至少1种肠道菌群存在相关性。痛风也与肠道菌群变化存在相关性,Shao等[10]采用微生物组学和代谢谱分析法分析了痛风患者与健康对照组的粪便标本,发现痛风患者类杆菌、赤藓菌科、卟啉单胞菌科和厌氧菌科等机会性致病菌表达增加。
肠道菌群影响人体UA水平的主要途径是参与嘌呤代谢、分解UA和影响UA排出[11-12]。乳酸菌和假单胞菌参与了UA降解代谢酶的合成。UA在肠道中的排泄主要依靠肠上皮细胞中的尿酸转运子,尿酸转运子包括上皮三磷酸腺苷结合盒转运蛋白G2(ABCG2)、尿酸盐转运子可溶性载体蛋白2家族成员9(SLC2A9)等,动物实验结果已证实,敲除大鼠特定基因后其肠道菌群可以通过调控肠道上皮尿酸转运子ABCG2和SLC2A9,从而调节UA的排泄[13-14]。这些研究为调节肠道菌群治疗痛风提供了理论基础。
日本的一项随机双盲对照试验结果显示,降尿酸药物洗脱4周后的患者持续8周饮用包含索氏乳酸杆菌PA-3的酸奶来治疗高尿酸血症或痛风,可以显著降低患者的血UA水平,降低程度明显高于对照组[15]。本研究结果也显示,活菌辅助组患者的UA、ESR水平降低更为明显,UA、ESR水平低于非布司他组,组间差异有统计学意义(P<0.05)。活菌辅助组患者的IL-1β、IL-6和XOD水平低于非布司他组,差异有统计学意义(P<0.05)。抑制XOD,减少黄嘌呤和次黄嘌呤生成UA,是痛风治疗的重要靶点[16]。痛风性关节炎是通过激活NALP3途径分泌IL-1β等促炎因子,导致非感染性炎症反应的发生[17]。益生菌治疗可降低IL-1β、IL-6等炎症因子水平,从而减少痛风性关节炎的发作。
进一步分析患者治疗前后菌群变化,结果显示,活菌辅助组患者双歧杆菌、乳酸杆菌、粪肠球菌和拟杆菌数量较治疗前明显增多,肠杆菌数量较治疗前降低。乳酸菌属和假单胞菌属可通过产生丁酸促进肠道UA分解,增加UA的排泄[18-19]。乳酸杆菌的增加有助于UA的排泄。Guo等[20]的研究结果发现,痛风患者粪便富集caccae和xylanisolvens这2种类杆菌,而prausnitzii粪杆菌和链状双歧杆菌缺乏。本研究中活菌辅助组患者治疗后双歧杆菌数量增加、肠杆菌数量降低,说明通过改善患者的肠道菌群结构降低了UA水平,减轻了炎症反应。
综上所述,痛风间歇期患者采用双歧杆菌三联活菌进行辅助治疗,可以降低UA水平和炎症反应,减少痛风急性发作,其机制可能与参与嘌呤氧化代谢,促进UA分解、排泄有关。
