血浆外泌体circRNA诊断HCC联合检测模型的建立与验证
2022-02-21王俊青费晓春顾志冬
孟 俊,王俊青,费晓春,顾志冬
(1.上海交通大学医学院附属瑞金医院检验科,上海 200025;2.上海交通大学医学院附属瑞金医院普外科,上海 200025;3.上海交通大学医学院附属瑞金医院病理科,上海 200025)
肝细胞肝癌(hepatocellular carcinoma,HCC)是临床常见的恶性肿瘤之一。由于HCC临床症状出现较晚,缺乏敏感的生物标志物用于早期诊断[1],因此大多数患者在确诊时已处于疾病晚期。目前,临床上亟需可用于早期筛查和诊断HCC的新型标志物。外泌体是一种极具应用前景的新型液体活检靶标,其作为一种细胞间信号传递的关键“中介”,在包括肝癌在内的多种恶性肿瘤进展过程中发挥重要作用[2]。目前,关于外泌体在HCC早期诊断中的研究仍较少。环状RNA(circular RNA,circRNA)是一种单链共价闭合的RNA。外泌体中含量较为丰富的非编码RNA是微小RNA(microRNA,miRNA)和长链非编码RNA(long non-coding RNA,LncRNA),近年来发现circRNA也广泛存在于外泌体中,这为进一步挖掘外泌体功能及作用机制提供了新的研究方向。由于circRNA具有强大的抗降解能力,因此具有巨大的临床应用潜力[3]。GE等[2]的研究结果显示,circRNA与肝癌的发生和发展密切相关,且可稳定地从患者外周血外泌体中富集。这表明检测外泌体circRNA或可作为一种全新的肝癌早期诊断策略。本研究拟通过寻找HCC患者差异表达的circRNA,建立全新的、可用于HCC诊断的外泌体circRNA模型,并探讨该模型在HCC诊断中的价值。
1 材料和方法
1.1 研究对象
选取2017年1月—2019年6月上海交通大学附属瑞金医院接受根治性切除术的HCC患者256例(HCC组),根据入组时间,将HCC患者分为发现集(25例)、训练集(126例)和验证集(105例)。选取同期上海交通大学附属瑞金医院确诊为乙型肝炎相关肝硬化患者100例(肝硬化组),其中训练集50例、验证集50例。另选取同期上海交通大学附属瑞金医院健康体检者125名作为正常对照组,其中发现集25名、训练集50名、验证集50名。除性别外,训练集和验证集HCC患者临床病理参数差异均无统计学意义(P<0.05)。见表1。

表1 训练集与验证集HCC患者临床病理参数比较 例
1.2 入选和排除标准
1.2.1 入选标准 (1)HCC组:符合HCC病理学诊断标准,年龄≥18周岁,既往无其他恶性肿瘤病史,接受根治性切除术且临床各项实验室指标和病理检查资料完整。(2)肝硬化组:既往有慢性乙型肝炎病史,影像学诊断明确具有肝硬化改变但无肝占位性病变。(3)正常对照组:体格检查均正常,无乙型肝炎病史,无恶性肿瘤病史,实验室检查无异常。
1.2.2 排除标准 (1)HCC组:既往有恶性肿瘤病史,同时合并其他恶性肿瘤,临床资料不完整,术后病理检查证实非HCC,影像学资料缺失,拒绝签署知情同意书。(2)肝硬化组:既往有恶性肿瘤病史,存在肝脏占位性病变,合并其他病毒性肝炎,肝硬化影像学诊断不明确。
1.3 方法
1.3.1 一般资料收集 收集所有HCC患者术前一般资料(年龄、性别、术前诊断、既往病史、腹水情况、肉眼癌栓、术前肝肾功能指标、乙型肝炎病毒感染状态、AFP、癌胚抗原水平等)和术后临床病理资料(肝硬化、肿瘤数、肿瘤大小、镜下癌栓、卫星灶、包膜完整性、病理分级等)。所有术前血浆样本均在患者治疗前采集。
1.3.2 外泌体分离 采集所有对象外周血样本6 mL,乙二胺四乙酸抗凝,2 h内1 200×g离心10 min,分离血浆,保存于-80 ℃,10 d内统一完成外泌体的分离和核酸的抽提、逆转录,并将模板冻存于-80 ℃。采用Invitrogen总外泌体分离试剂盒(美国Invitrogen公司)分离血浆外泌体,严格按试剂盒说明书操作。简要步骤:将冻存的血浆2 000×g离心20 min,以去除细胞碎片,在2 mL血浆样本中加入1 mL磷酸盐缓冲液(phosphate-buffered saline,PBS)和600 μL外泌体分离试剂,混匀,4 ℃静置30 min,然后4 ℃ 15 000×g离心5 min,去除上清液,即获得外泌体沉淀。
1.3.3 circRNA检测 使用Arraystar circRNA芯片(美国ARRASTAR公司)鉴定肝癌细胞系Hep3B和正常肝细胞系L02(购自中科院细胞库)的外泌体来源circRNA表达的差异,用于后续发现集筛选。严格按说明书操作。
1.3.4 实时定量聚合酶链反应(real-time quantitative polymerase chain reaction,RT-qPCR)检测 使用Trizol试剂(美国ThermoFisher Scientific公司)提取外泌体总RNA。使用Prime-Script RT试剂盒(日本TaKaRa公司)对提取的RNA进行逆转录。严格按试剂盒说明书操作。采用ABI 7500 PCR扩增仪(美国ABI公司)及SYBR试剂盒(日本TaKaRa公司)对特定circRNA的表达进行定量检测。在发现集阶段,采用2-ΔCq法对靶circRNA表达进行相对定量,以GAPDH为内参基因[5]。其中ΔCq靶circRNA=Cq靶circRNA-CqGAPDH。在训练集和验证集阶段,根据2-ΔΔCq方法确定特定外泌体circRNA的表达水平,其中ΔΔCq=(ΔCq靶circRNA-正常对照组的平均ΔCq)。引物序列:c i r c_0 0 0 0 6 9 0 正向引物为5'-GAGACCCTCCACAAATTTGCA-3',反向引物为5'-CCTCCCGGAACACCTCTG-3';circ_0001359 正向引物为5'-CCTGGAATCACGAAGCACAG-3';反向引物为5'-GTTGGGTAATACTGCCGCTG-3';circ_0000396 正向引物为5'-CCTGGCAAACACTGGAATCC-3',反向引物为5'-CAGCAAGCAGAGACGATCAC-3';GAPDH 正向引物为5'- AGCCACATCGCTCAGACAC-3',反向引物为5'- GCCCAATACGACCAAATCC-3'。
1.3.5 免疫印迹法检测蛋白表达 采用全蛋白提取试剂盒(江苏凯基公司,目录号KGP2100)提取血浆总蛋白。采用二喹啉甲酸(bicinchoninic acid,BCA)法测定蛋白浓度,试剂盒购自美国ThermoFisher Scientific公司。采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳对样本中的蛋白进行分离,采用湿转法(300 mA、120 min)将蛋白样本转移至聚偏氟乙烯膜,然后在4 ℃下与兔抗人CD9、CD63、CD81、Alix以及Calnexin抗体(美国Abcam公司,1∶500稀释)孵育过夜。使用辣根过氧化物酶标记的山羊抗兔二抗(上海碧云天公司)孵育2 h,最后采用超敏化学发光试剂进行显色,并定量分析。
1.4 统计学方法
采用SPSS 21.0软件和GraphPad Prism 8.0软件进行统计分析。呈正态分布的计量资料以±s表示,组间比较采用非配对Student t检验。计数资料以例或率表示,组间比较采用χ2检验。采用受试者工作特征(receiver operating characteristic,ROC)曲线评价不同circRNA诊断HCC的效能。以P<0.05为差异有统计学意义。
2 结果
2.1 肝癌细胞系Hep3B和正常细胞系L02外泌体circRNA表达的差异
与正常细胞系L02比较,肝癌细胞系Hep3B中有102个exo-circRNA表达升高(P<0.05)。将102个差异表达的外泌体circRNA与exoRBase数据库中的HCC患者外周血外泌体cricRNA数据进行匹配,鉴定出4个在HCC患者血浆外泌体中表达量升高的circRNA,分别为circ_0000690、circ_0001359、circ_0000396和circ_0000722。见图1。
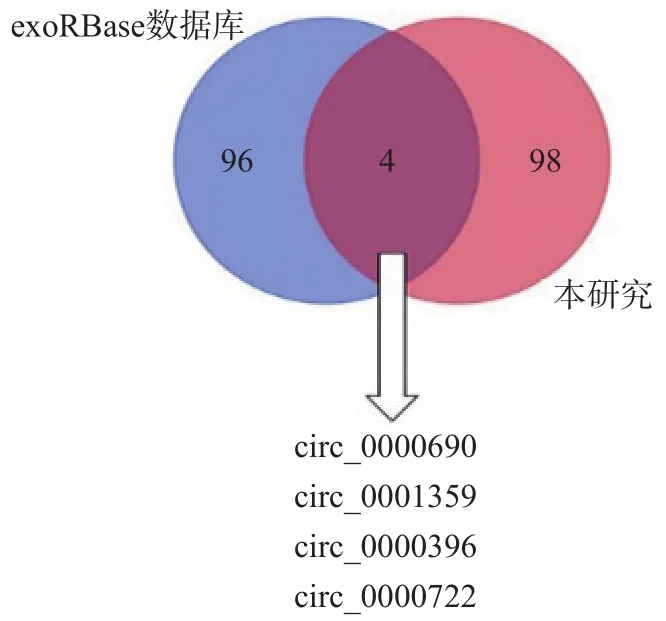
图1 HCC患者外周血高表达外泌体circRNA筛选结果
2.2 HCC组、肝硬化组和正常对照组外泌体分离及circRNA表达的比较
免疫印迹法结果显示,HCC组、肝硬化组和正常对照组血浆样本均高表达CD9、CD63、CD81和Alix 4种外泌体标志物,无外泌体阴性标志物Calnexin表达。提示外泌体分离成功。见图2。

图2 血浆外泌体分离效果的免疫印迹法鉴定结果
采用RT-qPCR检测HCC组和正常对照组发现集血浆外泌体中circ_0000690、circ_0001359、circ_0000396和circ_0000722的表达量。结果显示,HCC组血浆外泌体中circ_0000690、circ_0001359和circ_0000396的相对表达量显著高于正常对照组(P<0.05),circ_0000722相对表达量在2个组之间差异无统计学意义(P>0.05)。见图3。
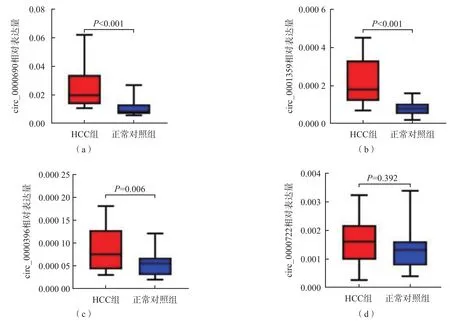
图3 HCC组与正常对照组发现集4种血浆外泌体circRNA相对表达量的比较
2.3 HCC组、肝硬化组、正常对照组训练集和验证集队列中circ_0000690、circ_0001359、circ_0000396的表达情况
无论是训练集还是验证集,H C C组circ_0000690相对表达量均高于肝硬化组和正常对照组(P<0.001);正常对照组、肝硬化组、HCC组circ_0001359相对表达量依次升高(P<0.05);HCC组与肝硬化组之间circ_0000396相对表达量差异无统计学意义(P>0.05),但均高于正常对照组(P<0.05)。见图4。
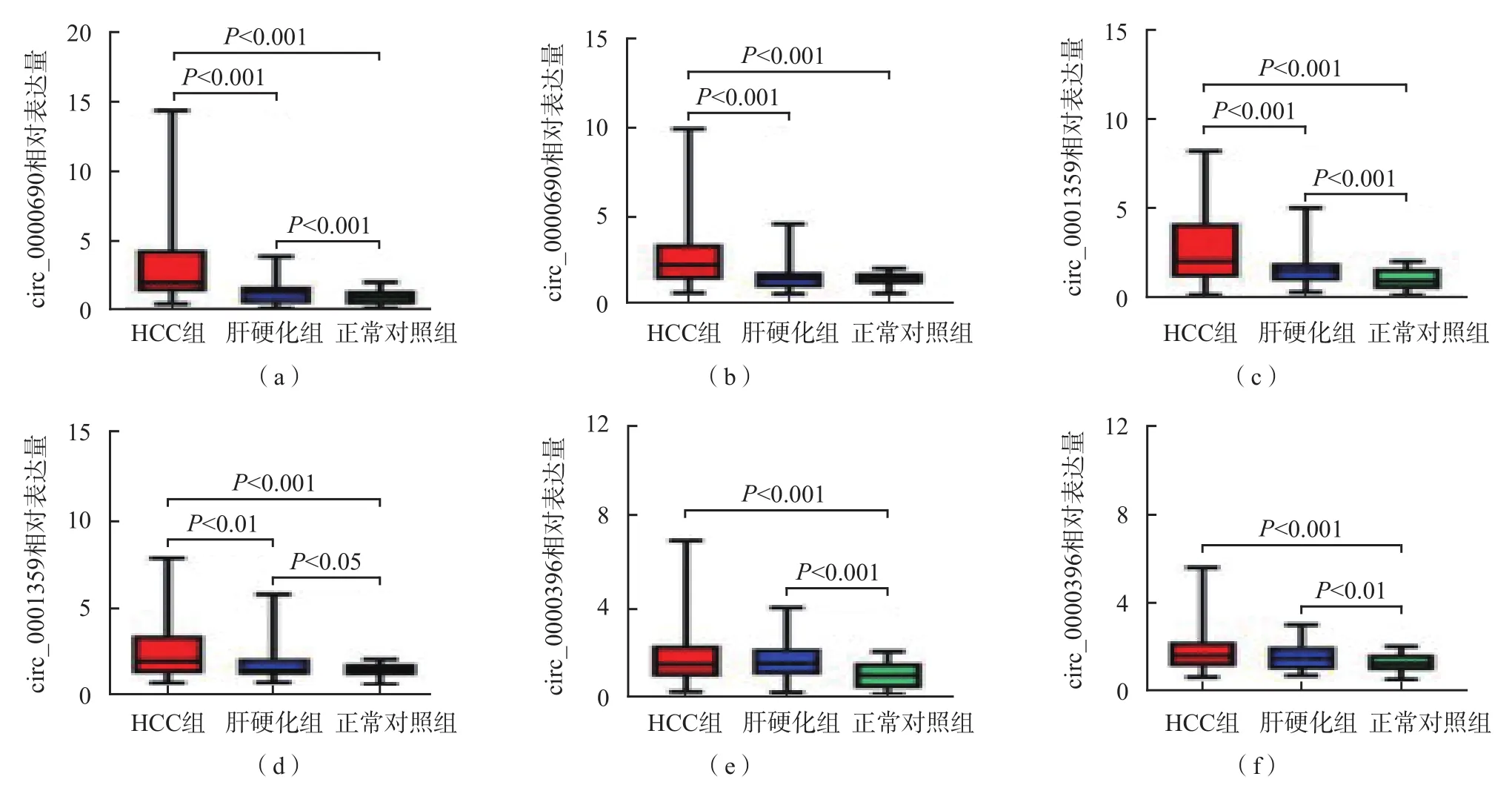
图4 HCC组、肝硬化组、正常对照组训练集和验证集队列中circ_0000690、circ_0001359和circ_0000396的表达情况
2.4 基于 circ_0000690、circ_0001359和circ_0000396的HCC诊断模型的构建
采用Logistic回归分析建立基于circ_0000690、circ_0001359和circ_0000396诊断HCC的联合检测模型为:Logit(P)=1.110×circ_0000690+0.822×circ_0001359+0.622×circ_0000396-4.153。
无论是训练集还是验证集,HCC组联合检测模型的概率值均高于肝硬化组及正常对照组(P<0.05),肝硬化组则高于正常对照组(P<0.05)。早期HCC患者(巴塞罗那分期0+A期)联合检测模型的概率值与HCC患者整体的概率值比较,差异无统计学意义(P>0.05)。见图5。
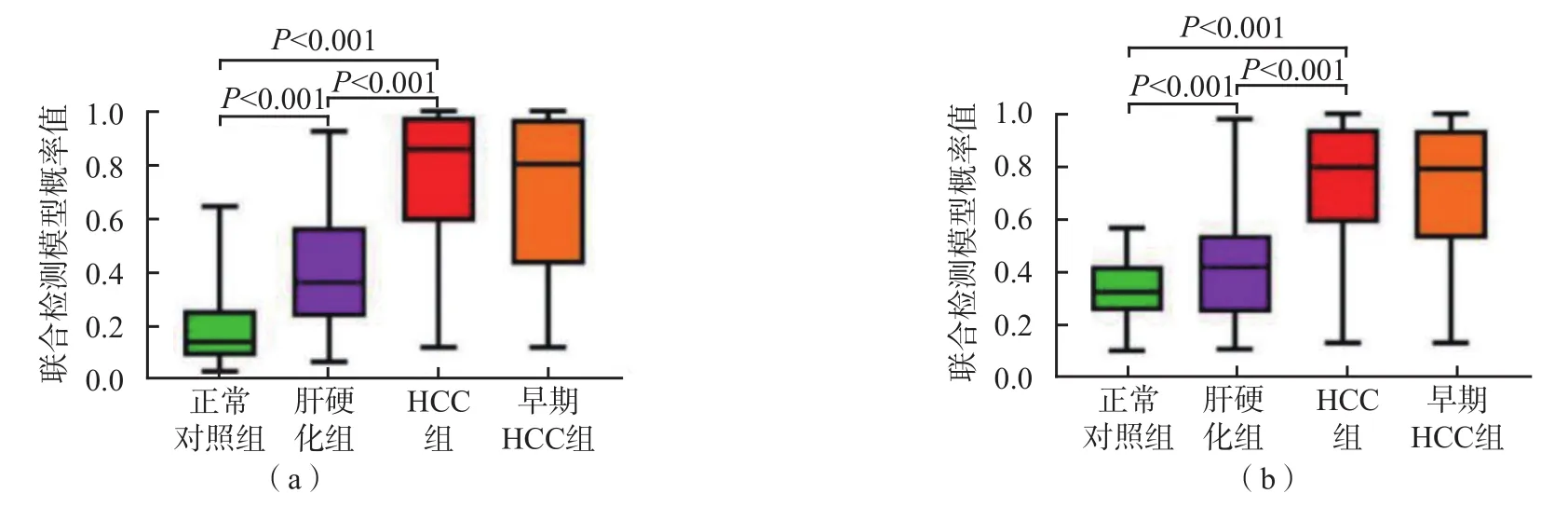
图5 HCC组、肝硬化组、正常对照组联合检测模型概率值的比较
2.5 circ_0000690、circ_0001359、circ_0000396单项检测及联合检测模型诊断HCC的效能
ROC曲线分析结果显示,在训练集中,circ_0000690、circ_0001359、circ_0000396单项检测及联合检测模型诊断H C C的曲线下面积(area under curve,AUC)分别为0.802、0.726、0.621、0.859,诊断早期HCC的AUC分别为0.767、0.698、0.611、0.847。联合检测模型诊断HCC的效能优于AFP(P<0.05)。见表2、表3和图6。

图6 circ_0000690、circ_0001359、circ_0000396单项检测及联合检测模型诊断训练集中HCC的ROC曲线

表2 各项指标诊断训练集HCC的ROC曲线参数
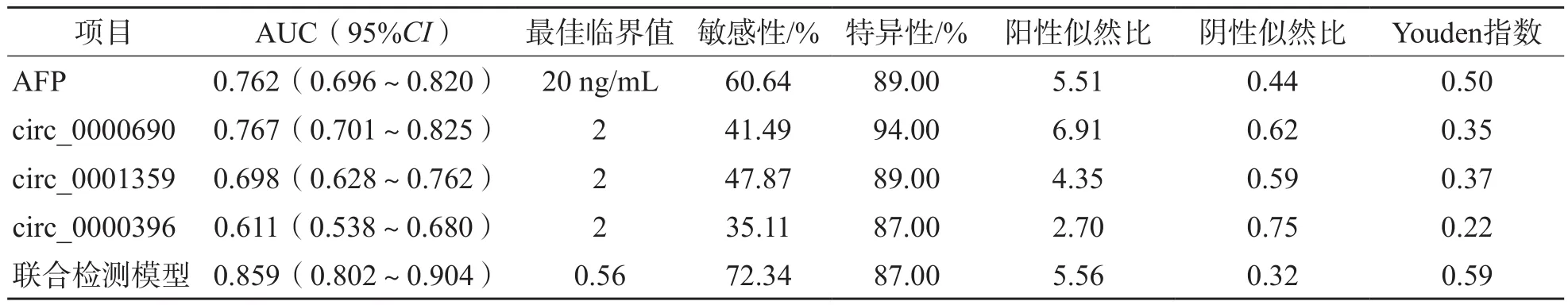
表3 各项指标诊断训练集早期HCC的ROC曲线参数
2.6 circ_0000690、circ_0001359、circ_0000396单项检测及联合检测模型诊断HCC的验证
ROC曲线分析结果显示,在验证集中,circ_0000690、circ_0001359、circ_0000396单项检测及联合检测模型诊断HCC的AUC分别为0.752、0.663、0.615、0.847,诊断早期HCC的AUC分别为0.763、0.673、0.591、0.845。联合检测模型诊断HCC的效能优于AFP(P<0.05)。见表4、表5和图7。

表4 各项指标诊断验证集HCC的ROC曲线参数

表5 各项指标诊断验证集早期HCC的ROC曲线参数

图7 circ_0000690、circ_0001359、circ_0000396单项检测及联合检测模型诊断验证集HCC的ROC曲线
2.7 circ_0000690、circ_0001359、circ_0000396单项检测及联合检测模型诊断AFP阴性HCC的效能
将AFP<20 ng/mL定义为AFP阴性。ROC曲线分析结果显示,在训练集中,circ_0000690、circ_0001359、circ_0000396单项检测及联合检测模型诊断AFP阴性HCC的AUC分别为0.810、0.695、0.588、0.894;诊断AFP阴性早期HCC的AUC分别为0.786、0.672、0.574、0.877。见表6、表7和图8。

图8 circ_0000690、circ_0001359、circ_0000396单项检测及联合检测模型诊断训练集AFP阴性HCC的ROC曲线

表6 各项指标诊断训练集AFP阴性HCC的ROC曲线参数
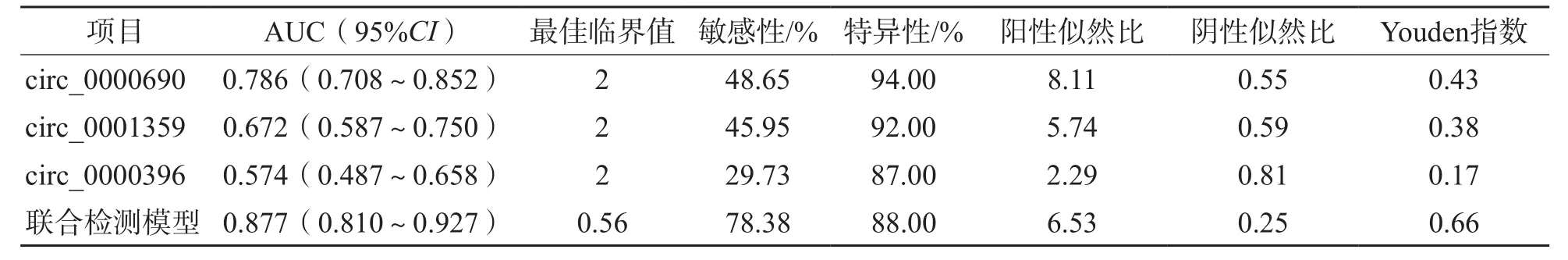
表7 各项指标诊断训练集AFP阴性早期HCC的ROC曲线参数
在验证集中,circ_0000690、circ_0001359、circ_0000396单项检测及联合检测模型诊断AFP阴性HCC的AUC分别为0.702、0.670、0.641、0.840;诊断AFP阴性早期HCC的AUC分别为0.747、0.669、0.587、0.846。见表8、表9和图9。

图9 circ_0000690、circ_0001359、circ_0000396单项检测及联合检测模型诊断验证集AFP阴性HCC的ROC曲线

表8 各项指标诊断验证集AFP阴性HCC的ROC曲线参数

表9 各项指标诊断验证集AFP阴性早期HCC的ROC曲线参数
3 讨论
近年来,越来越多的学者致力于探索外泌体在肿瘤中的诊断潜力,外泌体circRNA在肿瘤诊断和预后评估中的作用引起了学者们的广泛关注[5]。外泌体可有效保护内含的circRNA免受RNA酶降解,维持其稳定性和完整性[6]。因此,外泌体circRNA被认为是多种实体肿瘤早期诊断和预后评估的理想生物标志物。已有多项研究证实血浆外泌体circRNA可用于胃癌、结直肠癌、卵巢癌、前列腺癌等实体肿瘤的诊断[7]。对于肝癌,已有少量研究提示外泌体circRNA可作为潜在的诊断标志物。LYU等[8]的研究结果显示,血浆circ_0070396可用于肝癌的诊断。SUN等[9]报道了1种可用于肝癌诊断的包含3个外泌体circRNA(hsa_circ_0004001、hsa_circ_0004123、hsa_circ_0075792)的分子组合。但这些研究尚存在一定的不足,如单个标志物相对于AFP诊断效能提高不显著、样本量较小(<100例)、缺乏独立验证等。本研究纳入较大样本量,构建了一个含3种circRNA(circ_0000690、circ_0001359、circ_0000396)的HCC诊断联合检测模型。该模型诊断HCC的AUC为0.886,敏感性为76.98%,特异性为87.00%,具有较好的诊断效能;独立验证结果显示,本研究建立的联合检测模型可用于HCC的诊断。但本研究用于建立联合检测模型的3种circRNA在肝癌中的生物学作用及其临床价值目前尚未见报道,其在肝癌发生、发展中的作用尚不明确。
目前,AFP仍是HCC诊断中应用最广泛的生物标志物,但AFP的敏感性较低,特别是在早期肝癌中,特异性也不足,有近20%的肝硬化患者AFP异常升高,且此升高现象与恶性肿瘤的发生无显著相关性[10]。因此,临床亟需一种诊断肝癌较为灵敏的生物标志物。本研究结果显示,基于3种circRNA建立的联合检测模型在AFP阴性HCC患者中的阳性率(敏感性)与肝癌患者整体阳性率(敏感性)基本一致,在训练集中,联合检测模型诊断AFP阴性HCC的AUC为0.894,敏感性为81.25%,特异性为87.00%;在验证集中,联合检测模型诊断AFP阴性HCC的AUC为0.840,敏感性为74.47%,特异性为90.00%。提示联合检测模型对AFP阴性HCC具有良好的诊断效能。
难以早期诊断是目前肝癌预后不良的重要原因[11]。准确的早期诊断可大大提高肝癌患者行根治性切除术的比例,切实提高临床疗效。然而,目前临床仍缺乏有效的肝癌早期诊断策略。本研究ROC曲线分析结果显示,在训练集中,基于 circ_0000690、circ_0001359和circ_0000396建立的联合检测模型诊断早期HCC的AUC为0.859;在验证集中,联合检测模型诊断早期HCC的AUC为0.847。由此可见,联合检测模型对早期HCC有较好的诊断效能。
无论是对早期HCC,还是对APF阴性HCC,本研究建立的联合检测模型均表现出较好的诊断效能。由于本研究入组的肝硬化患者例数较少,后续将纳入更多的肝硬化患者,并开展前瞻性研究,观察联合检测模型在预测肝癌早期发生中的价值。此外,由于本研究纳入的3种外泌体circRNA(circ_0000690、circ_0001359、circ_0000396)的生物学功能尚不明确。因此,阐明这3种circRNA的来源,并研究其生物学功能也将是下一步研究的目标。
本研究尚存在一些局限之处:(1)入组的患者例数虽然较多,但仍显不足,需要纳入更多的HCC患者来进一步验证本研究得出的结果;(2)纳入的HCC患者多为乙型肝炎相关肝癌,因此需要纳入不同疾病背景的肝癌患者,以确认联合检测模型的普适性;(3)考虑到乙型肝炎相关肝硬化是乙型肝炎患者发生肝癌过程中至关重要的一项病理生理性改变,而乙型肝炎相关肝硬化是肝癌发生的重要危险因素,因此在未来的研究中将纳入更多的慢性乙型肝炎(无肝硬化)患者,从而对本研究结果进行更为细致的分层验证。
综上所述,基于3种circRNA(circ_0000690、circ_0001359和circ_0000396)构建的联合检测模型对HCC具有较好的诊断效能,亦适用于早期HCC和AFP阴性HCC的鉴别诊断,有助于提升临床对HCC的诊断和鉴别诊断效率,有利于改善HCC患者的预后。此外,在后续研究中,我们将进一步围绕这3个外泌体circRNA进行分析,旨在明确其生物学功能,从而为肝癌的治疗提供全新靶点。
