MicroRNA-590在急性心肌梗死诊断及预后评估中的价值
2022-02-21储时春
储时春 成 威
心血管疾病(cardiovascular disease, CVD)是全球发病、致残和死亡人数最多的疾病,急性心肌梗死(acute myocardial infarction, AMI)是冠心病中最致命的病症。AMI的特征是动脉粥样硬化斑块破裂、溃疡、裂缝或糜烂,导致一个或多个冠状动脉腔内血栓,引起心肌血流量减少和/或远端栓塞以及随后的心肌坏死[1]。及时、正确的诊断以及早期再灌注是影响AMI预后和临床结局的主要因素[2]。随着经皮冠状动脉介入治疗(percutaneous coronary intervention, PCI)、药物溶栓治疗等治疗手段的广泛应用,AMI患者的生存率明显改善,但仍有一部分患者发生心肌再灌注延迟或失败、心力衰竭、恶性心律失常、心肌再梗死等主要不良心血管事件(major adverse cardiovascular event, MACE)。因此,尽早识别、及时评估预后对降低AMI患者病死率有重要作用。研究[3]发现,循环中miRNAs具有显著的稳定性,可用于心血管疾病的诊断、疗效和预后评估。近年来,细胞和动物研究[4-5]发现,miR-590具有抑制血管内皮细胞凋亡、抑制单核巨噬细胞内脂质沉积及炎性细胞因子分泌,从而延缓动脉粥样硬化斑块进展。本研究拟检测miR-590在AMI患者外周血中的表达,分析其在AMI诊断及预后评估方面的价值。
1 对象与方法
1.1 研究对象 选取2018年5月至2019年10月安徽省第二人民医院心内科收治并行冠状动脉造影(coronary angiography, CAG)的162例患者为研究对象,男性94例,女性68例;年龄40~93岁,平均(63.93±12.07)岁。根据临床诊断及CAG结果,将40例冠脉正常患者作为对照组(HC组),50例稳定型心绞痛患者作为SAP组,72例AMI患者作为AMI组。AMI诊断标准参考2012年欧洲心脏病学会/美国心脏病学会基金会/美国心脏病学会/世界心脏联盟(European Society of Cardiology/American College of Cardiology Foundation/American Heart Association/World Heart Federation, ESC/ACCF/AHA/WHF)第3版《心肌梗死全球统一定义》[6]。稳定型心绞痛诊断标准参照2018年中华医学会心血管病分会制定的《稳定性冠心病诊断与治疗指南》[7]。排除标准:急慢性感染性疾病、急性脑血管意外、严重肝肾功能不全、恶性肿瘤、血液系统疾病、自身免疫性疾病或结缔组织疾病等。本研究所有患者均遵循自愿原则,签署知情同意书,并经医院伦理委员会批准。
1.2 方法
1.2.1 临床资料 所有入选患者完善一般临床资料,包括年龄、性别、血压、吸烟史、慢性病史(高血压病、糖尿病、血脂异常)等。
1.2.2 标本采集 所有患者入院即刻检测肝功能、肾功能、肌酸激酶同工酶(creatine kinase-myocardial band, CK-MB)、心肌肌钙蛋白I(cardiac troponin I, cTnI)水平,次日清晨空腹抽血,检测血脂、血糖等生化指标。同时抽取静脉血5 mL,离心获取血浆置于无RNA酶的EP试管中,-80℃冰箱低温保存待测。
1.2.3 定量逆转录聚合酶链反应(quantitative reverse transcriptase-polymerase chain reaction, qRT-PCR)检测血浆miR-590水平 TRIzol法提取血浆总RNA,并使用核酸蛋白分析仪对获得的RNA纯度进行检测。取纯化的总RNA 2 μg进行逆转录合成cDNA,使用QuantStudio 5实时荧光定量PCR仪进行qRT-PCR,选用U6作为内参。反应引物序列如下:miR-590,上游5’-GGAATTCTTCAGTTGTAACCCAG-3’,下游5’-CGGGATCCTTGAGATGTCA CCAA-3’;U6,上游5’-CTCGCTTCGGCAGCACA-3’,下游5’-AACGCTTCACGA ATTTGCGT-3’。反应条件:95℃预热10 min,95℃变性15 s,60℃退火60 s,循环40次,每个样品均设置3个平行反应复孔。采用2-ΔΔt法计算miR-590相对量。
1.2.4 随访 出院后每月定期随访,以电话随访为主,辅以门诊随访或住院随访,随访时间为1年,记录所有患者出院后1年内MACE发生情况,包括非致命性心肌梗死、心力衰竭、心源性死亡、再次血运重建。

2 结果
2.1 3组对象基线资料比较 3组对象性别、年龄、吸烟史、高血压病史、糖尿病史、总胆固醇(total cholesterol, TC)、三酰甘油(triglyceride, TG)、高密度脂蛋白(high density lipoprotein, HDL)、低密度脂蛋白(low density lipoprotein, LDL)和血肌酐(serum creatinine, SCr)进行比较,差异均无统计学意义(P>0.05)。见表1。

表1 3组对象基线资料比较
2.2 3组对象血浆miR-590、cTnI及CK-MB水平比较 3组对象血浆miR-590、cTnI及CK-MB水平进行比较,差异均有统计学意义(P<0.001)。AMI组患者血浆miR-590、cTnI及CK-MB水平高于SAP组和HC组,差异均有统计学意义(P<0.05);SAP组与HC组血浆miR-590、cTnI及CK-MB水平比较,差异均无统计学意义(P>0.05)。见表2。

表2 3组对象血浆miR-590、cTnI及CK-MB水平比较
2.3 AMI组患者血浆miR-590与cTnI、CK-MB水平相关性分析 AMI组患者血浆miR-590水平与cTnI呈正相关(r=0.751,P<0.001),血浆miR-590水平与CK-MB呈正相关(r=0.692,P<0.001)。见图1、2。

图1 AMI组患者血浆miR-590水平与cTnI相关性散点图
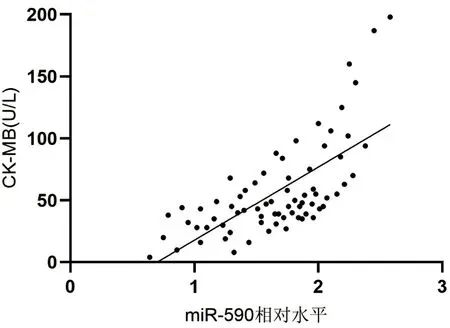
图2 AMI组患者血浆miR-590水平与CK-MB相关性散点图
2.4 低miR-590组与高miR-590组患者MACE发生情况比较 AMI组患者出院后随访1年,随访期间2例对象失访。根据血浆miR-590水平中位数,将AMI组患者分为低miR-590组(miR-59<1.72,n=35)与高miR-590组(miR-590≥1.72,n=35)。与低miR-590组相比,高miR-590组MACE发生率增高(P=0.015);其中两组心力衰竭发生率差异有统计学意义(P=0.040),但非致命性心肌梗死、心源性死亡以及再次血运重建差异均无统计学意义(P>0.05)。见表3。

表3 低miR-590组与高miR-590组对象MACE发生情况比较[例(%)]
3 讨论
AMI是全球范围内的重大卫生问题,其发病率及病死率均较高。快速诊断以及早期再灌注对于降低病死率和改善预后至关重要。尽管cTnI、CK-MB等传统心肌损伤标志物在AMI的诊疗中具有无法替代的作用,但是这些标志物仍然存在敏感性及特异性较低等缺陷[8]。miRNA是一类内源性的非编码单链小RNA,广泛参与生长发育、器官形成、细胞增殖分化与凋亡、肿瘤发生等生物学过程[9]。相关研究[10]表明,miRNA可作为AMI早期诊断的生物标志物。Eulalio等[11]研究发现,miR-590显著刺激小鼠心肌梗死后的心肌再生,几乎完全恢复心脏功能参数。因此,探究新的生物标志物对AMI患者的早期诊断、早期治疗以及预后评估具有重要的意义。
本研究结果显示,AMI患者血浆miR-590表达量高于SAP组和HC组,提示miR-590可以作为AMI的一种重要生物标志物。进一步分析AMI患者血浆miR-590 水平与传统心肌损伤标志物的相关性,结果显示,miR-590与cTnI及CK-MB均呈正相关,提示血浆miR-590 水平可以反映出心肌损伤的程度,且3者联合检测有望提高AMI的检出率,为早诊断早治疗提供可能性。本研究发现,高miR-590组患者心力衰竭及MACE总体发生率更高,预后更差,提示血浆miR-590水平可作为评估AMI患者预后的指标。
AMI的病理基础为冠状动脉粥样硬化,冠状动脉粥样硬化病变的形成是血管壁对血脂异常和内皮损伤做出的慢性炎症反应的结果,包括白细胞的炎性募集和血管壁细胞的活化。既往研究[4-5,12-13]发现,miR-590能够抑制内皮损伤和凋亡,减轻巨噬细胞内脂质积累和炎症细胞因子的分泌,减少主动脉粥样硬化斑块面积及斑块内脂质含量。外源性给予miR-590干预心脏成纤维细胞能够通过抑制TGF-βRII表达,抑制Ang Ⅱ诱导的胶原蛋白分泌以及肌成纤维细胞转化,从而发挥抗纤维化效应[14]。表明miR-590可能通过调控脂质代谢、内皮细胞及巨噬细胞的激活与凋亡、心肌细胞增殖以及炎症基因的表达等过程参与到AMI的病理过程中。
综上所述, AMI患者的血浆miR-590水平明显升高,miR-590的表达水平与AMI患者的预后相关。因此,血浆miR-590水平监测可为临床医师诊断AMI以及评估预后提供参考。然而,本研究具有样本量较小、缺乏多中心随机对照实验的局限性,同时也未对miR-590与 AMI 发生发展关系进行机制探讨。下一步有必要扩大样本量,并联合其他医疗单位开展多中心临床研究,进一步深入探讨 miR-590参与AMI发生发展的分子机制,为临床AMI的诊治提供更为充分的循证医学证据。
