重金属镉、锌、铬对翘嘴鲌幼鱼急性与联合毒性效应试验
2022-02-21母红霞
母红霞,李 蕾
(辽宁工程技术大学环境科学与工程学院,辽宁 阜新123000)
重金属镉(Cd)、锌(Zn)、铬(Cr)是水环境中的广泛污染物。这些重金属的存在对环境和生物均具有巨大的风险和危害[1-4]。生物监测能综合反映环境污染状况,可连续监测、发现早期环境污染且灵敏度高,同时其结果还是检验经去污处理后的水体适宜水生物生存最直接和有效的指标。鱼类是水生态系统中的顶级捕食者,相比于其他低等水生生物,其对污染物毒性的富集更明显。幼鱼属于鱼类个体发育的早期阶段,在这一阶段中其对各种污染物的耐受力相对有限,因此将幼鱼作为急性毒性试验动物具有快速、灵敏、经济有效等特点,而急性毒性试验是生物测试保护天然水体的重要方法[5]。吴建绍等[6]利用高锰酸钾等6种药物对双斑东方鲀(Fugubimaculatus)幼鱼开展急性毒性试验,评价了幼鱼药物耐受能力的强弱,同时得到药物安全使用的控制量值。
翘嘴鲌(CulteralburnusBasilewsky)是我国重要的经济鱼类,地理分布广泛,渔获量大[7]。因此选择翘嘴鲌进行毒性试验,具有广泛代表性,研究结果可以推广至全国多数河流湖泊等水体。近年来,国内外不少学者研究重金属对水生生物的毒性作用,如贾秀英等[8]研究了Cd和铬(Cr,VI)单一及复合污染对鲫(Carassiusauratus)机体组织过氢化物酶同工酶的影响;赵守城[9]研究了镉离子(Cd2+)、铬离子(Cr2+)对大型水蚤(Daphniamagna)毒性的协同作用;Xu X M等[10]研究了铅和百草枯对金鱼(Carassiusauratus)肝脏解毒酶的联合毒性。关于重金属对鱼类的影响大多集中于重金属在鱼体内的富集累积、迁移转运等方面,为更加完善地保护水域环境、治理水体污染、保证水产品质量安全,仍需有针对性的毒性试验来进行效应评估。本文通过研究重金属Cd、Zn、Cr对翘嘴鲌幼鱼的单一及联合毒性效应,运用生物监测手段对水体的健康状况进行评价,以期得到水体广泛污染物对主要经济鱼类的安全浓度,为制定有害化学物质在水中的卫生标准及渔业用水水质标准提供量化依据。
1 材料与方法
1.1 试验用鱼
以翘嘴鲌为受试生物,选取1 200尾幼鱼[平均体长为(3.6±0.5)cm,体重(0.42±0.16)g],在实验室水族箱中以试验条件驯养7 d,适当投饵,并定期换水,保证水质条件良好。驯养期间需保证翘嘴鲌幼鱼活动正常,体表无伤,死亡率低于5%。选用身体健康、反应灵敏、大小基本一致的幼鱼随机分组,进行毒性试验。
1.2 试验条件
试验用水为曝气3 d以上的自来水,溶解氧(DO)大于7 mg/L,pH 6.7~8.5,水体总硬度为2.2度(德国度)。试验期间水温保持(22±1)℃。试验容器为30 cm×25 cm×20 cm的玻璃水缸,试验缸中总水量为10 L,加水高度约为14.3 cm。每1个单一试验小组(最小单元)使用上述试验容器1套。
1.3 试验试剂
氯化镉(CdCl2)、硫酸锌(ZnSO4)、重铬酸钾(K2Cr2O7)均为分析纯,分别为毒性试验提供重金属离子Cd2+、锌离子(Zn2+)和Cr6+。
1.4 单一急性毒性试验
采用静水生物测试法[11]进行单一急性毒性试验。为确定Cd2+、Zn2+和Cr6+对所选取的特定体长、体重的翘嘴鲌幼鱼作用的适当质量浓度,先预试验,确定浓度范围。当观察到鱼体呈仰翻或侧倾姿势漂浮于水面,丧失主动游动能力,且针刺无反应时,即判断为鱼体死亡[12]。
依据预试验的试验结果,单一急性毒性试验按等比级数设置系列质量浓度组。其中,水体中的金属离子浓度Cd2+为0、5.00、6.58、8.65、11.38、15.00 mg/L;Zn2+为0、20.00、25.20、31.70、39.90、50.00 mg/L;Cr6+为0、20.00、24.50、30.00、36.70、45.00 mg/L。浓度为0的组为空白对照组,每个质量浓度组设3个平行[13]。每1个单一试验平行小组(最小单元)投放翘嘴鲌幼鱼10尾,进行毒性试验。在试验开始的0~8 h内连续观察翘嘴鲌幼鱼的呼吸状态、鱼体倾角、游动行为等反应。记录各组翘嘴鲌幼鱼24 h、48 h、72 h和96 h的存活率,计算得到3种金属离子对翘嘴鲌幼鱼的半数致死浓度(LC50)和安全浓度。
1.5 联合毒性作用试验
将3种金属离子两两组合,进行3组联合毒性试验。关于联合毒性药物的配比方法,修瑞琴等[14]提出按单一毒性最终LC50值进行毒性1∶1配比或质量浓度1∶1配比。因此本试验的联合毒性药物采用单一毒性最终时长LC50进行毒性1∶1配比,即每一种重金属96 h LC50的1/16、1/8、1/4、1/2和1。
1.6 数据处理
1.6.1 半数致死浓度(LC50)
在试验毒物各浓度状态下,将不同时长毒物处理后翘嘴鲌幼鱼的剩余数量,转换成存活率:

用24、48、72、96 h的试验鱼存活率对浓度作图,选用存活率50%相邻的两个数据点应用直线内插法[11],求出每种金属离子在不同时间下的半数致死浓度(LC50)。
1.6.2 安全浓度
计算安全浓度(SC)的方法有两种,分别是公式Ⅰ:SCⅠ=48 h LC50×0.3/(24 h LC50×48 h LC50)2和公式Ⅱ:SCⅡ=96 h LC50×0.1。这两种计算安全浓度的方法都具有一定的科学依据,但在数值上,SCⅠ≈3×SCⅡ。相较于SCⅠ,SCⅡ在判定毒物的毒性上更为严格和安全。因此,本试验采取公式Ⅱ计算安全浓度。
1.6.3 联合毒性评价
运用水生毒理联合效应Marking指数相加法[14]评价联合毒性。
S=(AmBm/An)+(AmBm/Bn)
(1)
式(1)中:A、B 为二种不同毒物;An、Bn分别为A、B二种毒物单独作用时的LC50值;AmBm为A、B二种毒物联合作用时的LC50值。
用加和指数AI值判定多种毒物共同发挥作用时所产生的效应。由毒物单独作用、联合作用时的LC50值,依式(1)计算得到S值。当S≤1时,AI=1/S-1;当S>1时,AI=1-S。由S值计算得到AI值,并依据AI值判定联合毒性效应。若AI>0,则表明多种毒物联合的效应为协同作用;AI<0时表明毒物联合效应为拮抗作用;AI=0则表明毒物联合效应为相加作用。
2 结果
2.1 单一急性毒性
2.1.1 幼鱼中毒症状
图1所示为翘嘴鲌幼鱼受重金属离子Cd2+、Zn2+、Cr6+胁迫中毒与自然死亡的症状对比。

如图1所示,死亡鱼体表面均有明显伤口。体表伤口差别显著:自然死亡的鱼体伤口没有颜色;镉中毒死亡鱼体体表伤口为黑色;锌中毒死亡鱼体全身白色且内脏从伤口处可见;铬中毒鱼体伤口为红色,全身部分充血。
1)镉:Cd2+对翘嘴鲌幼鱼的毒性作用较慢。当幼鱼放入试验水体时,其游动速度略有加快;较短时间后浓度低于8.65 mg/L的3个试验组内的幼鱼活动均趋于平静。8 h后11.38 mg/L试验组中的幼鱼开始出现不适症状,游动失去平衡并且开始出现死亡。死亡个体体表出现较大区域破溃伤口,伤口颜色呈黑色,体表腐烂,附有白色沉淀物。
2)锌:翘嘴鲌幼鱼的Zn2+中毒症状,以浓度25.20 mg/L试验组为例:4 h后部分幼鱼体表开始出现破溃星点,但仍可生存、无死亡。随时间推移,幼鱼出现兴奋状态,急躁不安,游动加快,于上下不同水层之间急速窜动,并且伴有撞壁和侧翻表现;24 h后游动十分缓慢,出现个体死亡;48 h后幼鱼基本不游动,80%试验幼鱼体表分泌大量黏液,以鱼鳍和鱼尾最为严重,黏膜遭到破坏,鳃有腐蚀,体表附着棉絮状白色物质;96 h后绝大部分幼鱼体表充血,并且水体表面附着油状薄膜物质,透明度降低,水体发臭。
3)铬:Cr6+对翘嘴鲌幼鱼的毒性作用较快,在浓度36.7 mg/L试验组中,处理20 min后部分幼鱼体表分泌黏性物质;而在最大浓度45.0 mg/L组内的幼鱼,初期即出现狂躁兴奋、加速游动等表现,短时间内开始失去平衡、打转、痉挛;Cr6+处理1 h开始出现死亡现象,死亡个体头部、尾部明显发黑,呈现弯曲体状。
2.1.2 系列浓度下的幼鱼存活率
由系列浓度在不同时间下的存活率结果如图2~4所示。由图2可知,当Cd2+为5.00 mg/L时,各个时间节点幼鱼总体维持较高的存活率,均≥70%;随着试验浓度的逐步提高,浓度自6.58 mg/L 升至11.38 mg/L区间范围,试验幼鱼存活率开始呈现急速下降;当Cd2+达到15.0 mg/L时,24 h和48 h时幼鱼存活率已分别降至20%和10%的极低水平,72 h时全部死亡。

注:0为对照组。下图同此。Notes:0 was control group.The same as below.
从图3可见,当Zn2+为低浓度20.00 mg/L时,各个时间点存活率相对较高,均≥65%;在20.20 mg/L、31.70 mg/L两浓度组区间,24 h和48 h的存活率下降较平缓,而毒物胁迫时长在72 h及以上时出现陡降。在Zn2+为50.00 mg/L时,试验开始短时间内即出现大量死亡;未达72 h已无一存活。

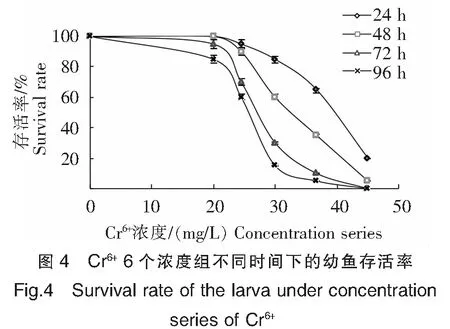
图4所示,当Cr6+为20.00 mg/L时,试验全程至96 h均有绝大多数的幼鱼存活,存活率≥85%;随着试验浓度的逐步提高,在24.50 ~36.70 mg/L浓度范围内试验幼鱼存活率骤降,其中以30.00 mg/L、36.70 mg/L两组表现最为剧烈;当Cr6+达到45.00 mg/L时,24 h和48 h时幼鱼存活率已分别降至20%、5%,未及72 h存活率均为0%。
2.1.3 LC50及安全浓度
使用直线内插法,分别计算单一急性毒性3种金属离子对翘嘴鲌幼鱼的24 h、48 h、72 h和96 h的半数致死浓度(LC50),再用公式Ⅱ:SC=96 h LC50×0.1计算出安全浓度,结果如表1所示。由图2~4及表1可得,Cd2+的24 h、48 h、72 h和96 h的LC50分别为12.29、9.56、7.41、6.05 mg/L;Zn2+的24 h、48 h、72 h和96 h的LC50分别为41.92、34.43、27.37、22.23 mg/L;Cr6+的24 h、48 h、72 h和96 h的LC50分别为39.47、32.68、27.25、25.72 mg/L。3种重金属对翘嘴鲌幼鱼的安全浓度分别为0.605、2.223、2.572 mg/L。
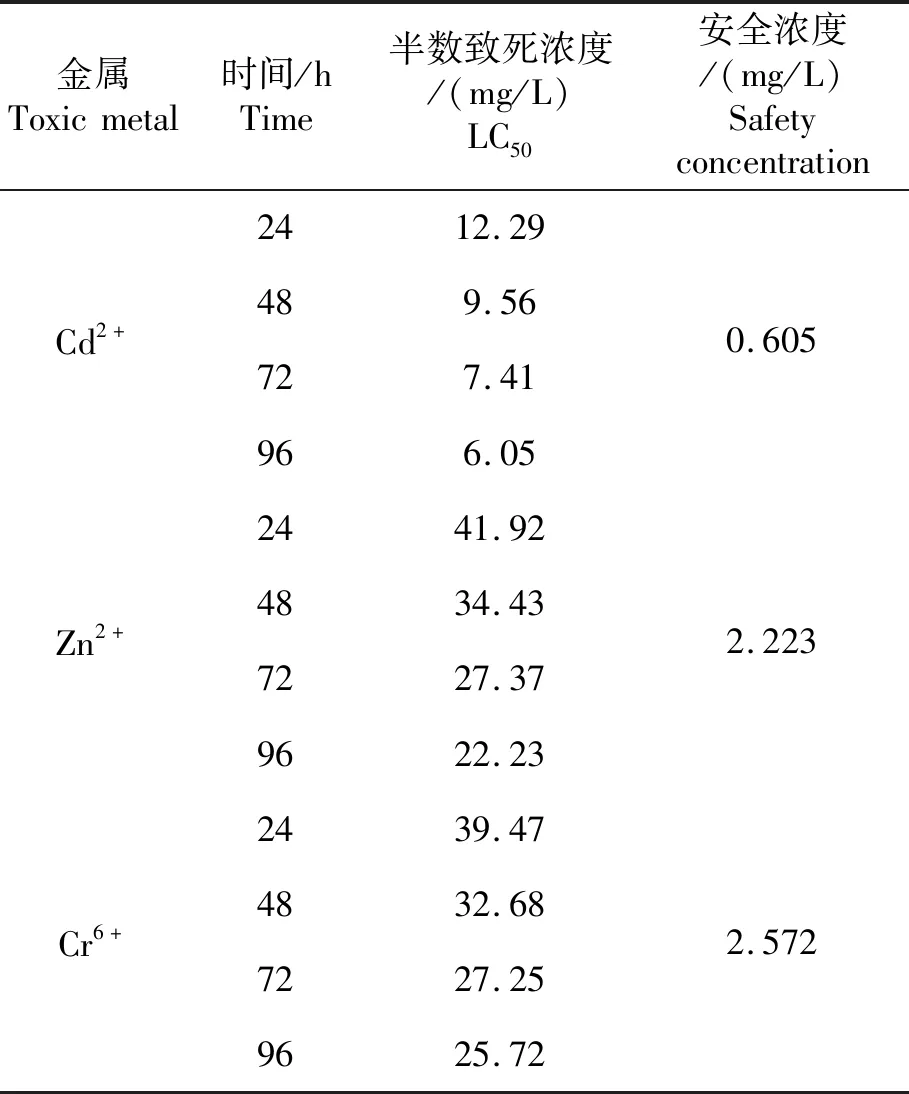
表1 Cd2+,Zn2+和Cr6+对翘嘴鲌单一毒性试验结果Tab.1 Single toxicity experiment results of Cd2+,Zn2+and Cr6+
2.2 联合毒性
2.2.1 过程观察
观察联合毒性试验过程,在Cd2+/Zn2+、Zn2+/Cr6+、Cd2+/Cr6+三种组合的毒物胁迫条件下,毒物处理4 h后,[Cd2+(1.51 mg/L)/Zn2+(5.56 mg/L)]共同作用下的翘嘴鲌幼鱼开始出现死亡;在连续观察8 h后, [Zn2+(2.78 mg/L)/ Cr6+(3.22 mg/L)]、[Cd2+(1.51 mg/L)/ Cr6+(6.43 mg/L)]试验组中的翘嘴鲌幼鱼也开始出现死亡。而胁迫浓度较低的[Cd2+(0.38 mg/L)/Zn2+(1.39 mg/L)]、[Cd2+(0.76 mg/L)/Zn2+(2.78 mg/L)]、[Zn2+(1.39 mg/L)/ Cr6+(1.61 mg/L)]、[Cd2+(0.38 mg/L)/ Cr6+(1.61 mg/L)]、[Cd2+(0.76 mg/L)/ Cr6+(3.22 mg/L)]试验组幼鱼在经20 h以上毒物联合作用后开始表现出身体倾斜、游动失去平衡等中毒现象,但存活率普遍维持在较高水平,均高于60%。
2.2.2 存活率
随着各金属离子浓度的升高和重金属胁迫时间的不断推移,每二者组合对翘嘴鲌幼鱼的联合毒性逐渐增强,尤以Zn2+/Cr6+联合中的两高浓度组[Zn2+(11.12 mg/L)/ Cr6+(12.86 mg/L)]、[Zn2+(22.23 mg/L)/ Cr6+(25.72 mg/L)]和Cd2+/Zn2+联合中的最高浓度组 [Cd2+(6.05 mg/L)/Zn2+(22.23 mg/L)]最为剧烈;这一规律可以从幼鱼存活率显著降低得到直观表现(表2)。
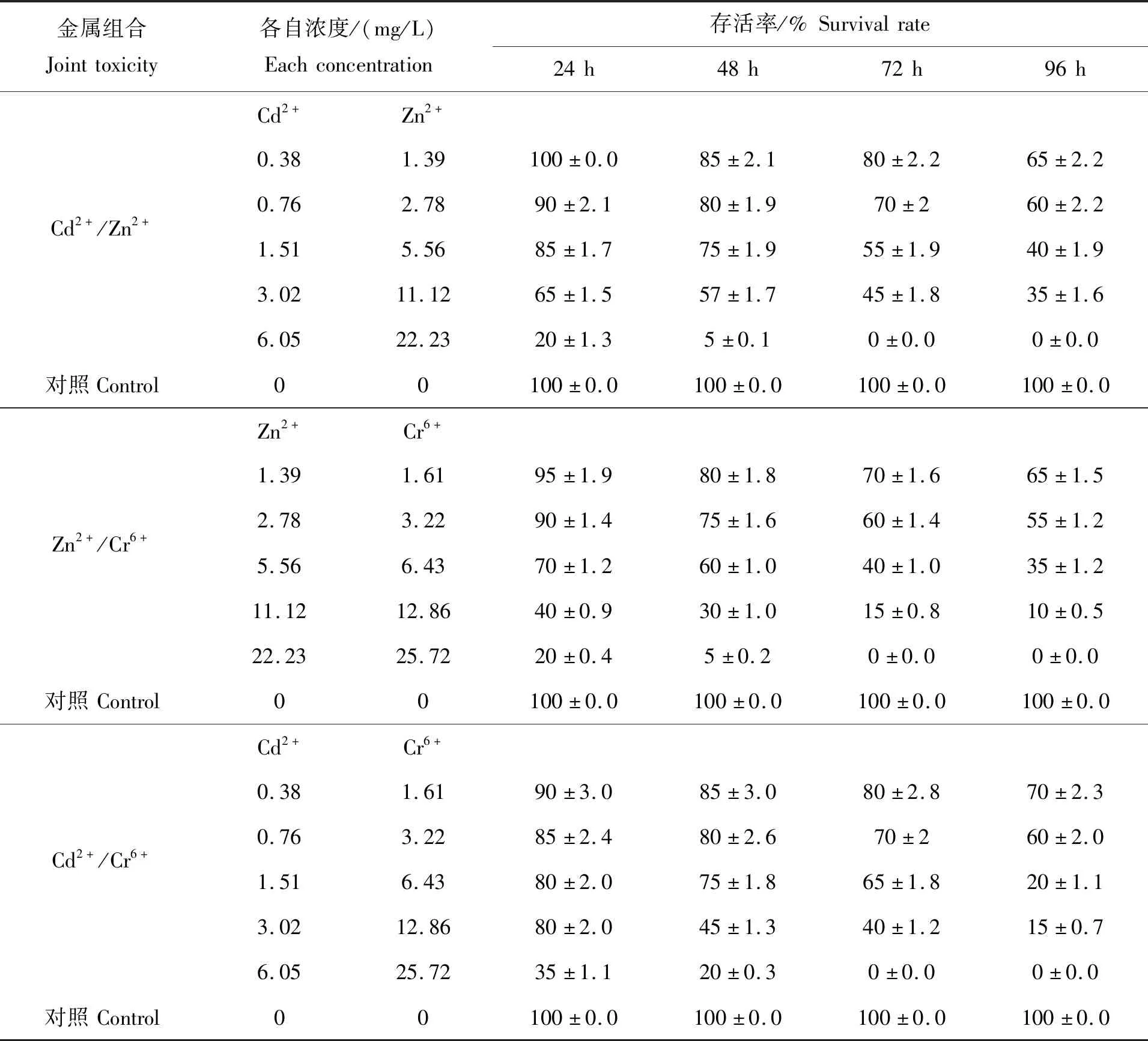
表2 Cd2+,Zn2+和Cr6+对翘嘴鲌联合毒性下的存活率Tab.2 Survival rate of larva under the Cd2+,Zn2+and Cr6+ joint toxicity
2.2.3 半数致死浓度(LC50)
随着联合试验时间的延长,各组合的联合毒性不断增强,LC50下降趋势明显(表3)。 Cd2+/Zn2+联合作用时,自24 h至48 h,LC50微幅下降;48 h至96 h之间,LC50表现出规律性的近半跌幅。Zn2+/Cr6+联合作用时,自24 h至72 h,LC50呈现出随时间推移的均匀降低;72 h至96 h,降幅趋缓,变动不大。Cd2+/Cr6+联合作用下,自24 h至48 h,LC50出现接近减半的陡降;自48 h至72 h,LC50降幅极小;而自72 h至96 h,LC50值再次出现降幅超过一半的大幅降低。
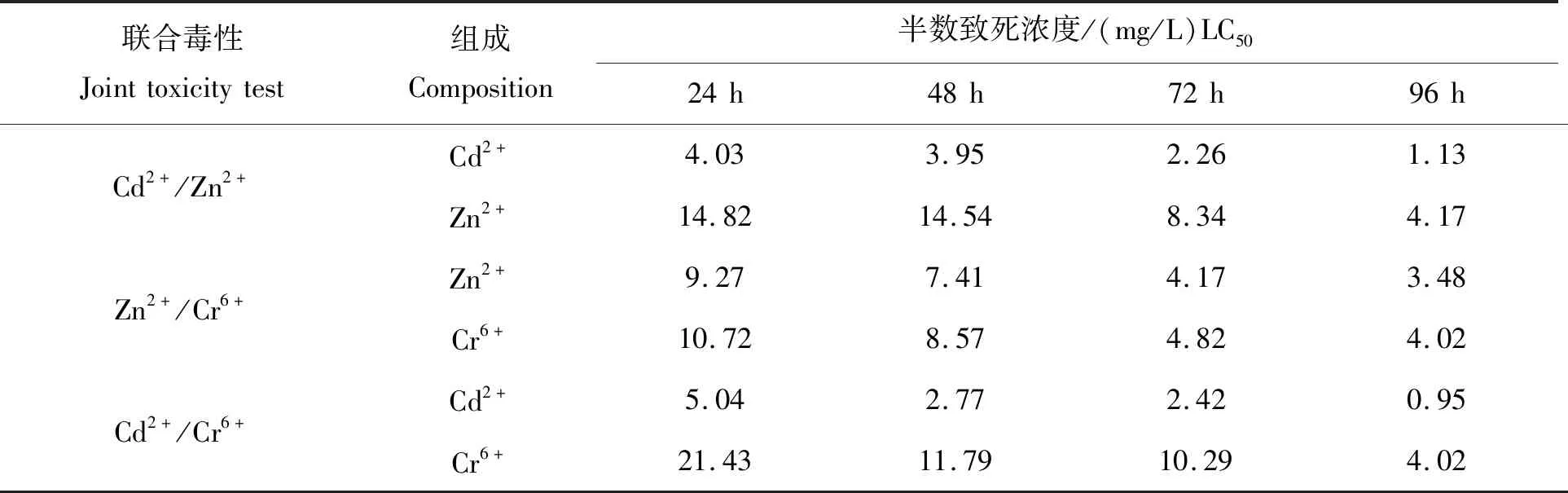
表3 联合毒性半数致死浓度Tab.3 Each LC50 of Cd2+,Zn2+,Cr6+ in joint toxicity test
2.2.4 联合作用
根据表2、表3数据,运用水生毒理联合效应Marking指数相加法[14],进行3种重金属两两组合的联合毒性效应评价(表4)。由表4可知,Cd2+/Zn2+、Zn2+/Cr6+、Cd2+/Cr6+共存24 h、48 h、72 h、96 h的AI值均大于0,指征各组合的联合毒性均表现为协同作用,即2种重金属离子共存时毒性明显加强。该结论不仅从计算出的AI值上得以判断,而且对比表1与表3中的LC50也可知,在联合作用下每种金属离子的LC50相较于单独毒性均出现大幅下降。毒物水平远低于单一胁迫时的 LC50(表1)即导致试验幼鱼半数死亡,表明联合毒性增强。
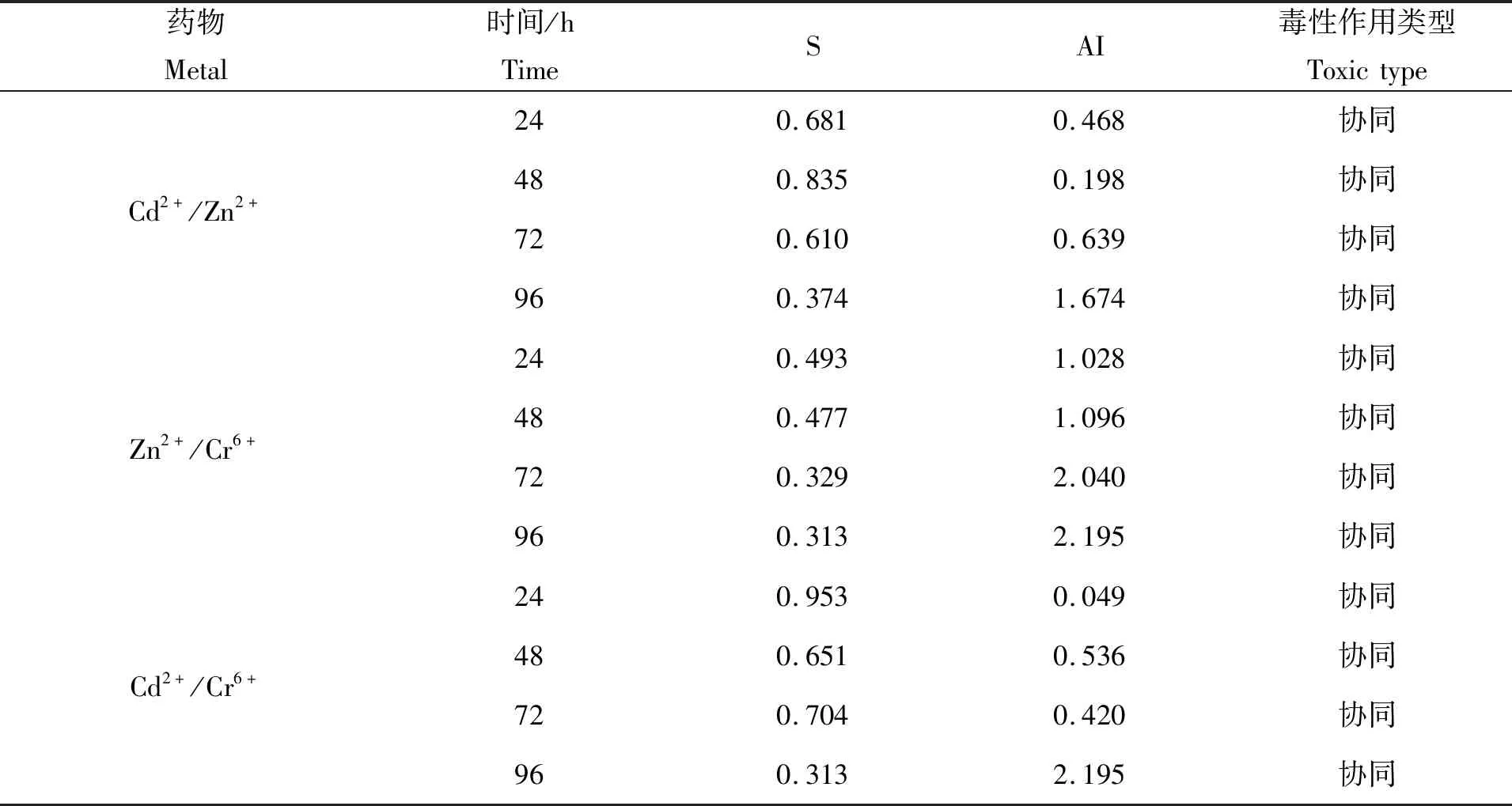
表4 三种重金属两两联合毒性评价Tab.4 Joint toxicity effect of the Cd2+/Zn2+/Cr6+
3 讨论
3.1 单一急性毒性
根据鱼类急性中毒试验的96 h LC50,可以将有毒物质对鱼类的毒性作用分为4级[11],分别为剧毒(有毒物质的质量浓度< 0.1 mg/L)、高毒(0.1~1.0 mg/L)、中毒(1.0~10.0 mg/L)、低毒(>10.0 mg/L)。我国GB 11607—1989《渔业水质标准》对Cd、Zn、Cr的最高容许质量浓度分别为0.005 mg/L、0.1 mg/L、0.1 mg/L。
镉:Cd是一种对动物体毒性较强的重金属。关于其强毒机理,Pragati N K等[15]的最新动物试验表明,膳食镉通过诱导生物体血细胞凋亡,从而降低血细胞水平。本试验测得Cd2+的24 h、48 h、72 h和96 h的LC50分别为12.29、9.56、7.41、6.05 mg/L;安全质量浓度为0.605 mg/L,高于我国渔业水质标准。根据毒性标准,判断Cd2+对于翘嘴鲌幼鱼属中毒物质。根据曾艳艺等[16]开展的Cd2+对珠江水域天然仔鱼及幼鱼的毒性效应及其潜在生态风险评估,Cd2+对赤眼鳟(Squaliobarbuscurriculus)仔鱼(48 h)、鲴(Xenocyprissp.)仔鱼(48 h)、广东鲂(Megalobramaterminalis)幼鱼(96 h)的LC50分别为1.29、0.83、3.20 mg/L,安全浓度分别为0.163、0.077、0.320 mg/L,均显著低于本试验得到的LC50和安全浓度,说明受试对象翘嘴鲌幼鱼相较于广东鲂幼鱼等对Cd2+的耐受能力更强。
锌:Zn是动物体的必需微量元素,但过量的锌则会对机体造成危害。为探究Zn对鱼类的致毒机理,Si L F等[17]研究环境中Zn2+对斑马鱼的非免疫性滞后影响,揭示出Zn2+通过参与酶组成以及改变非酶分子的形态作用于鱼体免疫代谢。本试验得到Zn2+的24 h、48 h、72 h和96 h的LC50分别为41.92、34.43、27.37、22.23 mg/L,判定为低毒物质,翘嘴鲌幼鱼对Zn2+的耐受性较强,安全浓度为2.223 mg/L,高于我国渔业水质标准。王瑞龙等[18]在对唐鱼(Tanichthysalbonubes)的急性毒性及安全浓度评价研究中,得到Zn2+对唐鱼的24、48、72、96 h的LC50分别为35.43、26.53、20.66、16.30 mg/L,低于本试验得到的LC50,可见翘嘴鲌对Zn2+拥有更高的耐受性。
铬:本研究中,Cr6+中毒死亡幼鱼普遍呈现鱼体弯曲、头尾发黑明显。这一突出现象与陈细香等[19]解剖Cr6+中毒死亡的黄鳝(MonopterusalbusZuieuw)所述现象一致,该研究发现遍布鱼体最突出的症状表现为淤血,集中部位包括鳃丝、各鳍、肠壁和内脏。 目前普遍认为Cr6+引起其他生物中毒的机制是导致蛋白变性,使酶失活,从而干扰代谢[20]。Elena V N等[21]通过对废水营养物质回收流入海水养殖设施的试验,证实Cr6+对水生生物的毒性普遍较小。这与本试验所得翘嘴鲌对Cr6+的耐受性较高的结论相符合。本试验中Cr6+的24 h、48 h、72 h和96 h的LC50分别为39.47、32.68、27.25、25.72 mg/L,安全浓度达2.572 mg/L,高于我国渔业水质标准。吴贤汉等[22]对青岛文昌鱼(Branchiostomatsingdauertse)进行毒性与生长关系的研究,发现微量的Cr6+能够促进鱼类的生长发育。刘银华等[23]的研究也表明,Cr6+对黄颡鱼(Pelteobagrusfulvidraco)属低毒物质,黄颡鱼“全雄1号”苗种24、48、72、96 h的 LC50分别为168.71、84.85、52.23、34.46 mg/L,安全浓度达3.446 mg/L,其耐受性高于本试验受试对象翘嘴鲌幼鱼。
本试验的3种重金属中,Cd2+对翘嘴鲌的致死毒性最大,毒性大小顺序依次为Cd2+> Zn2+> Cr6+。吴贤汉等[22]、李健[24]的研究证明,该毒性规律也出现于青岛文昌鱼、南方鲇(SilurusmeridionalisChen)中。同时,也有研究表明,鱼类在不同生长阶段对重金属的毒性反应并不一致。如吴玉霖等[25]证明重金属对牙鲆胚胎毒性顺序依次为Cu2+> Zn2+> Cd2+> Cr6+,对牙鲆幼鱼毒性大小的顺序为Cu2+> Cd2+> Zn2+> Cr6。
3.2 联合毒性评价
Zn2+/Cr6+共存时的AI值大于Cd2+/Zn2+共存、Cd2+/Cr6+共存,说明Zn2+/Cr6+共存时的协同作用较其他两组更加明显。这一点从该组试验鱼存活率较之另两组明显下降中得到直观验证。张云龙等[26]对鲫仔鱼的研究得出同样的结论,Zn2+/Cr6+二种离子共存时毒性明显加强。Cd2+/Cr6+共存时的AI值大于0,联合毒性表现为协同作用,这与王少博等[27]对草鱼苗的毒性试验结论相同,即Cd2+/Cr6+共同作用比二者各自毒性的简单加和更强烈。
关于如何评价混合物质的联合毒性,Eaton J G[28]在1973年利用Cd与Zn的混合溶液进行毒性试验,提出多种毒物共存的联合毒性作用复杂,不能采用单独毒性直接加和的方法评价。Speher R L等[29]通过对美国旗鱼(Jordanellafloridiae)的研究,进一步证实Cd、Zn共同作用下的联合毒性远大于二者单独毒性的相加之和。陈亮等[30]经过研究也得到重金属在联合作用时能够表现出不同的毒性影响的结论。而国际上并没有统一的联合毒性药物的配比方法标准,修瑞琴等[14]提出按单一毒性最终时长LC50值进行毒性1∶1或质量浓度1∶1最为简便,这亦是本试验所采用的毒性1∶1的试验方法。
本试验研究结果对渔业用水水质环境中广布类重金属的安全性评价具有一定的指导意义,同时也可为毒理学研究提供基础依据。毒性效应影响因素多,包括温度、盐度、pH值、有机质等理化因素,而在实际鱼类生存环境评价中更需要综合考虑影响因素,并科学合理地制定相关建议方法。加之多种物质混合后的机理复杂,往往呈现出多元综合效应,这为今后进一步探究提供新方向。
