西沙永乐群岛海域弧菌的分离鉴定
2022-02-21张秀霞张泽龙李军涛鲁耀鹏郑佩华冼健安
张秀霞,张泽龙,李军涛,鲁耀鹏,郑佩华,冼健安*
(1.中国热带农业科学院热带生物技术研究所,海南省海洋生物资源功能性成分研究与利用重点实验室,海南 海口 571101;2.中国热带农业科学院海南热带农业资源研究院,海南 海口 571101)
弧菌属于细菌界(Bacteria)、变形菌门(Proteobacteria)、γ-变形菌纲 (Gammaproteobacteria)、弧菌目(Vibrionales)、弧菌科(Vibrionaceae)、弧菌属(Vibrio)[1-2]。弧菌科是弧菌目中唯一的科,包括以弧菌属为代表的8个属,共计159个种,主要分布在海洋与河口环境中,在淡水中偶尔也有分布,某些种类是水产动物与人类重要的病原菌,具有潜在的环境效应[3]。致病性弧菌如哈维氏弧菌、溶藻弧菌和副溶血弧菌等,是导致水产动物病害暴发的重要原因[4-6];人们食用了遭弧菌污染的水产动物,会引发腹泻、腹痛、呕吐等食物中毒症状[7];伤口感染了创伤弧菌,会引发组织溃烂,导致组织坏死,甚至危及生命安全[8]。在一次我国13个地区2 980份生食动物性水产品样本调查中,副溶血性弧菌检出率达到14.7%,创伤弧菌检出率为3.5%[9],可见弧菌对人类的危害性不容忽视。
16S rDNA基因序列长约1.5 kb,具有高度的保守性和特异性,常被用于原核微生物系统发育学方面的研究[10]。16S rDNA作为原核生物分类的重要分子标记,在细菌鉴定相关工作中起到重要作用[11-13]。热休克蛋白60(HSP60)基因作为HSPs家族中最为保守的亚类,广泛存在于真核生物及原核生物中,发挥重要的调控作用[14]。促旋酶(Gyrase)的B亚单位(gyrB)普遍存在于细菌核酸中,该基因呈单拷贝,比16S rDNA的进化速度快,而且包含可变区和保守区,符合用于细菌系统发育靶基因的要求,有利于细菌鉴定及快速检测[15-16]。本研究从西沙永乐群岛海域的海水中分离弧菌菌株,并用多个基因引物进行序列扩增与比对分析,确定一种可靠的海洋弧菌分子鉴定方法,同时对西沙永乐群岛海域海洋弧菌的多样性进行初步调查与评价,旨在为相关方面的研究提供参考。
1 材料与方法
1.1 试验材料
海水样品取自中国南海西沙永乐群岛7个岛礁(晋卿岛、石屿、银屿、全富岛、鸭公岛、甘泉岛、羚羊礁筐仔沙洲)近岸水域,每个岛礁设两个位点,每个取样位点的海水样品取15 L,用0.22 μL微孔滤膜进行抽滤,滤膜放于离心管中,置于-20℃冰箱中保存并带回实验室。
1.2 试验方法
1.2.1 菌株分离与纯化
配制TCBS琼脂培养基,于121℃灭菌20 min,冷却至50℃后倒入一次性培养皿中,培养基厚度约6 mm。取出微孔滤膜,浸泡于15 mLPBS缓冲液中,进行超声波振荡10 min,取100 μL涂布于TCBS平板上,然后置于30℃生化培养箱中培养24 h;另取100 μL接种到已灭菌的TCBS液体培养基中,置于30℃生化培养箱中培养24 h后,取100 μL涂布于TCBS平板上,再置于30℃生化培养箱中培养24 h。挑取不同形态特征的单菌落至TCBS平板中,利用划线分离法进一步纯化,置于30℃生化培养箱中培养24 h,重复划线分离纯化2次,获得纯种菌株。
1.2.2 菌株的鉴定
1)形态学及显微镜观察
观察菌落状态,挑选纯种菌株进行革兰氏染色,在显微镜下观察形态特征。
2)16S rDNA基因扩增及检测
挑取纯化的单菌落至20 μL无菌水中作为扩增模板。PCR扩增反应体系(25 μL):2×F8 FastLong PCR MasterMIX 12.5 μL,引物16S-F和16S-R各1 μL,模板1 μL,无菌超纯水9.5 μL。反应条件:94℃预变性4 min,94℃变性10 s,55℃退火15 s;72℃延伸15 s,34个循环,72℃温育5 min。PCR产物用含Goldview的1%琼脂糖凝胶进行电泳检测,电压110 V,时间30 min。选取大小约1 500 bp的PCR产物送样至深圳华大基因股份有限公司进行测序,将测序得到的菌株16S rDNA序列在GenBank中进行BLAST比对,若有相似度高的序列信息则进行下载,并用MEGA 6.0软件构建系统发育树。
3)HSP60基因扩增及检测
挑取纯化的单菌落至20 μL无菌水中作为扩增模板。PCR反应体系(25 μL):2×F8 FastLong PCR MasterMIX 12.5 μL,引物HSP60-F和HSP60-R各1 μL,模板1 μL,无菌超纯水9.5 μL。反应条件:94℃预变性4 min,94℃变性10 s,50℃退火15 s,72℃延伸10 s,30个循环;72℃ 温育5 min。PCR产物用含Goldview的1%琼脂糖凝胶进行电泳检测,电压90 V,时间30 min。选取大小约600 bp的PCR产物送样至深圳华大基因股份有限公司进行测序,将测序得到的菌株HSP60序列在GenBank中进行BLAST比对,若有相似度高的序列信息则进行下载,并用MEGA 6.0软件构建系统发育树。
4)gyrB基因扩增及检测
设计3对gyrB引物,见表1。挑取纯化的单菌落至20 μL无菌水中作为扩增模板,PCR反应体系(25 μL):2×F8 FastLong PCR MasterMIX 12.5 μL,正向引物和反向引物各1 μL,模板1 μL,无菌超纯水9.5 μL。反应条件:94℃预变性3 min,94℃变性10 s,55℃退火15 s,72℃延伸10 s,34个循环;72℃温育5 min。PCR产物用含Goldview的1%琼脂糖凝胶进行电泳检测,电压110 V,时间30 min。选取大小约1 200 bp的PCR产物送样至深圳华大基因股份有限公司进行测序。将测序得到的菌株gyrB序列在GenBank中进行BLAST比对,若有相似度高的序列信息则进行下载,并用MEGA 6.0软件构建系统发育树。

表1 引物序列Tab.1 Sequences of primers
2 结果
2.1 菌株的形态学分析
根据不同的菌落形态对菌株进行挑选,共挑选出菌株47株,其中晋卿岛10株、石屿5株、银屿5株、全富岛6株、鸭公岛9株、甘泉岛7株、筐仔沙洲5株。47株菌株全为革兰氏阴性菌,在显微镜下形态为短小的杆状、弯曲的弧状或者S形(表2)。
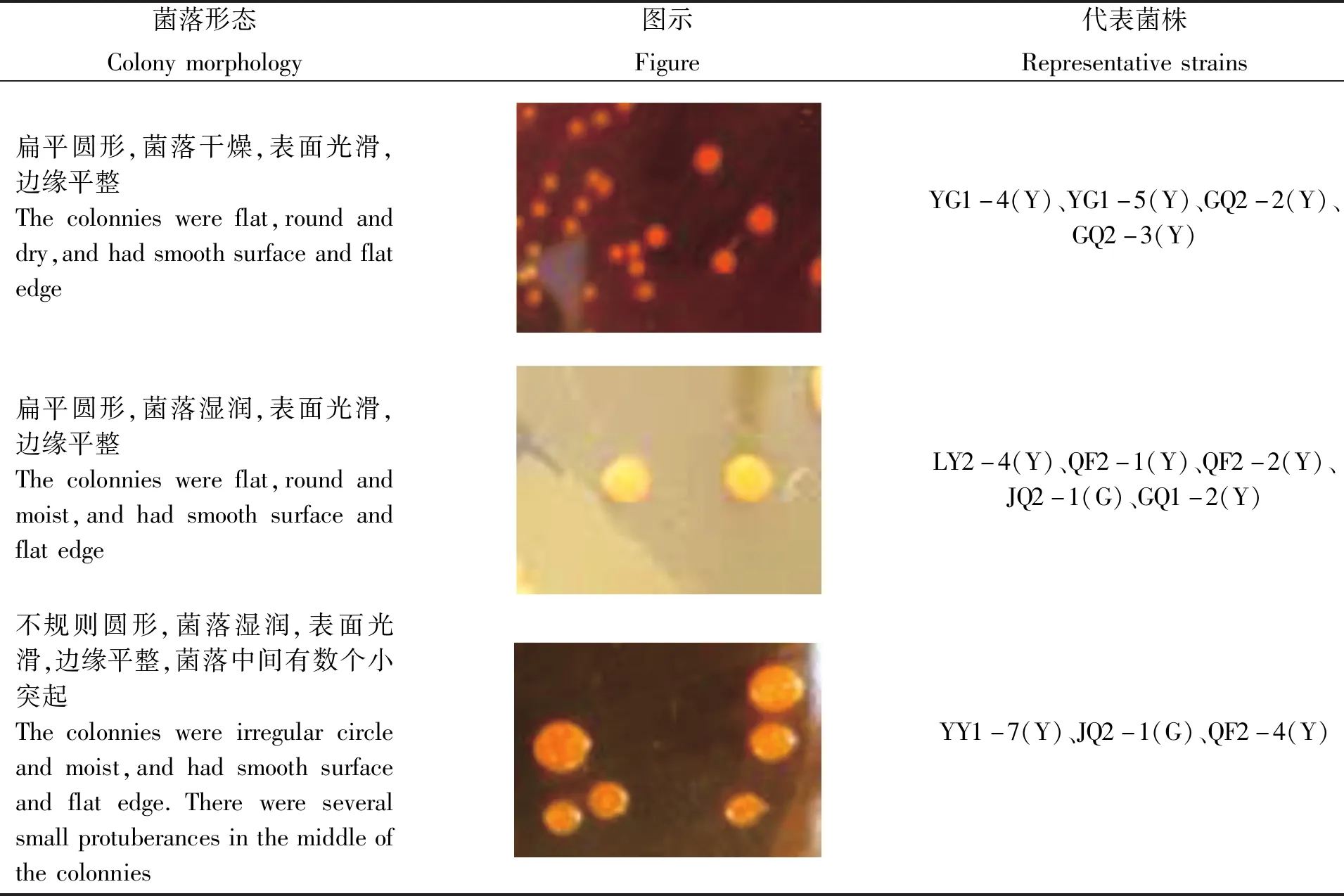
表2 菌株的菌落形态及颜色Tab.2 Colony morphology and colours of strains
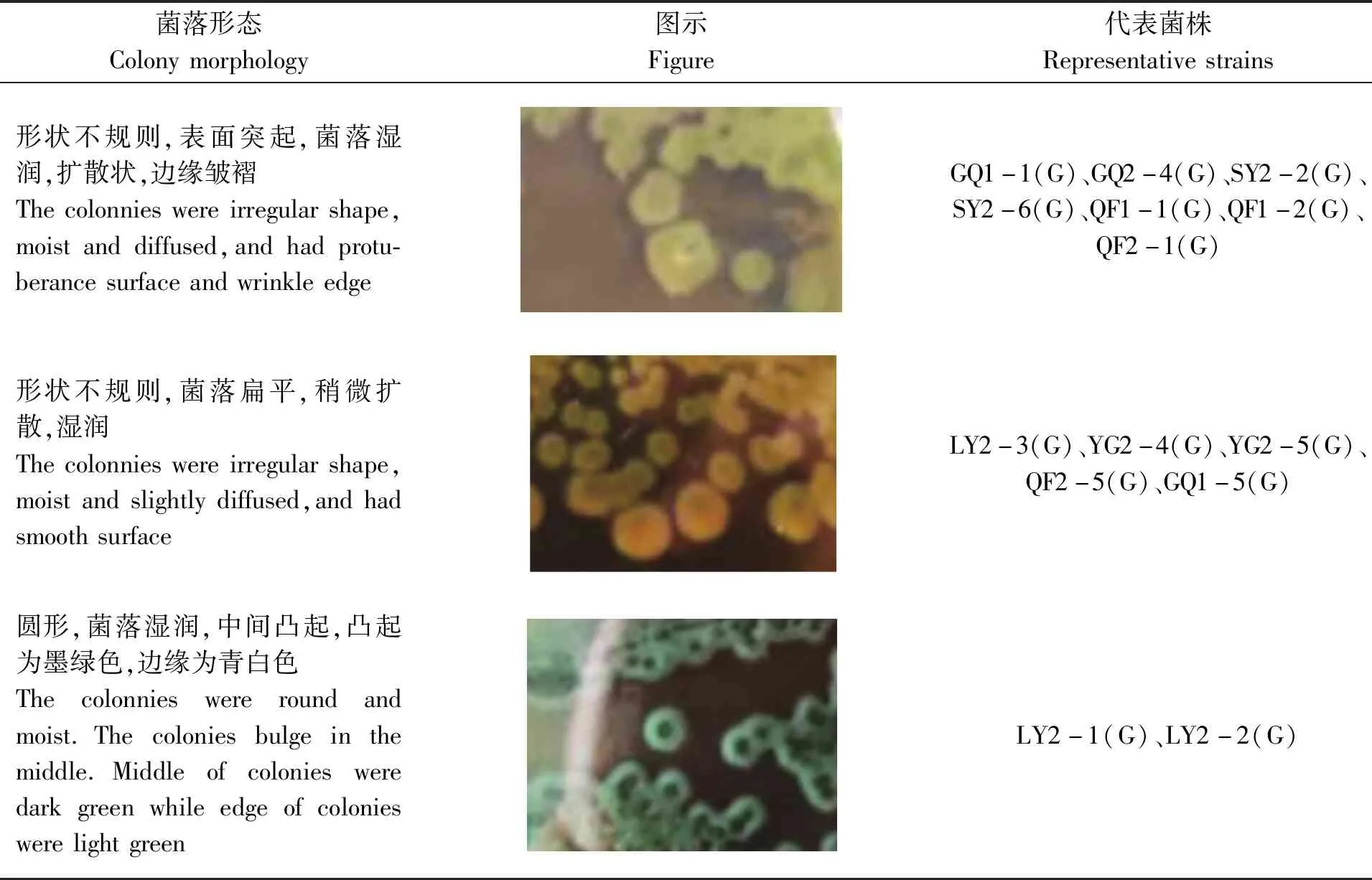
续表2
2.2 菌株的分子鉴定
2.2.1 16S rDNA鉴定
利用16S rDNA引物,47株菌株均能扩增出目标条带,部分菌株扩增条带见图1。比对结果显示,实验菌株与多个不同弧菌菌种模式菌株的序列相似性同时高于99%,在构建系统发育树时大部分实验菌株都不能与模式菌株聚为一个分支(图2),因此利用16S rDNA基因不能成功鉴定弧菌到种。

2.2.2 HSP60鉴定
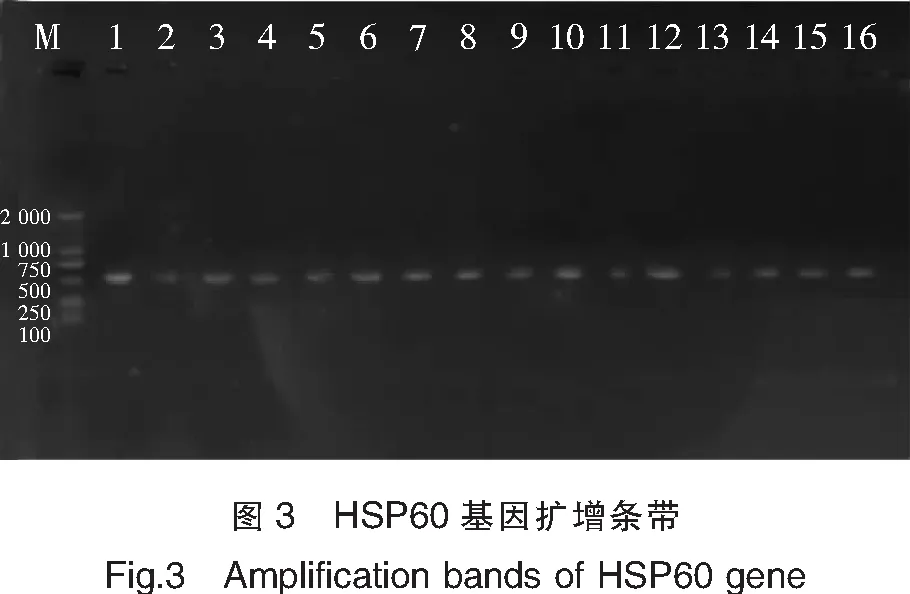
利用HSP60引物,47株菌株均能扩增出目标条带,部分菌株扩增条带见图3。47株菌株的比对结果均显示,与实验菌株相似度高于90%的菌株只有Vibrioneocaledonicus和Vibrioalginolyticus,无法构建系统发育树,因此利用HSP60基因不能成功鉴定弧菌到种。
2.2.3gyrB鉴定
分别利用gyrB1引物和gyrB2引物,均只有6株菌株能扩增出目标条带,利用gyrB3引物,47株菌株均能扩增出目标条带,部分菌株扩增条带见图4。gyrB3扩增序列比对结果显示,实验菌株序列与多个模式菌株序列相似度大于98%,能成功构建实验菌株的系统发育树(图5)。
通过gyrB3序列的系统发育分析,47株菌株分属于7个种:Vibrioalginolyticus、Vibrioharveyi、Vibriomediterranei、Vibrioowensii、Vibriocoralliilyticus、Vibriofortis、Vibriovariabilis。


2.3 不同岛礁海域的弧菌多样性分析
经gyrB3序列的分子鉴定,鸭公岛海域分离鉴定到5种弧菌,弧菌多样性最高;甘泉岛海域次之,分离鉴定到4种弧菌;石屿和羚羊礁筐仔沙洲的弧菌多样性最低,均只分离鉴定到2种弧菌。溶藻弧菌在7个岛礁海域中均被分离到,强壮弧菌只在银屿海域中被分离到(表3)。

表3 不同岛礁海域的弧菌多样性Tab.3 Diversity of Vibrio in sea area of different islands
3 讨论
弧菌是水生动物常见的致病菌[18-19],人类食用了弧菌超标的海鲜或者伤口被弧菌感染,均会对人类的健康带来严重的危害,甚至危及生命[7-8]。在水产养殖过程中,富营养化严重的养殖水体往往容易暴发弧菌疾病,因此检测水域中弧菌的种类、多样性和丰度可以在一定程度上为水域环境状况评价提供参考依据。
细菌种类鉴定是微生物领域的重要工作,近年来分子生物学技术的快速发展为微生物种类鉴定提供了技术支撑,分子生物学技术的稳定性、准确性可以很好地弥补生理生化鉴定的不足。16S rDNA序列分析法是细菌鉴定的基础方法之一,然而由于16S rDNA的高度保守性,使得16S rDNA序列在一些不同种细菌间的相似性非常高,甚至拥有完全一样的碱基序列[20]。Ohara C M等[21]和Erler R等[22]的研究表明16S rDNA序列不能区分弧菌属中的副溶血性弧菌和溶藻弧菌。本研究也发现,弧菌16S rDNA序列的种间相似度非常高,实验菌株与多个不同种模式菌株序列相似性同时高于99%,导致采用16S rDNA序列无法鉴定到种。
HSP60基因是高度保守的管家蛋白-分子伴侣蛋白编码基因,相比16S rDNA基因,HSP60的进化速度相对更快,因而更适用于作为近源关系细菌间鉴定的分子标记[23]。在本研究中也设计了一对HSP60引物,47株弧菌均能扩增出目标片段,但由于在GenBank中各类弧菌的HSP60基因信息量仍较少,相似度高于90%的弧菌仅有2种,因此目前仍无法利用HSP60基因准确鉴定弧菌到种。
gyrB为促旋酶的B亚单位基因,该基因进化速率快,每100万年的平均碱基替换率为0.7%~0.8%[24],属于信息通路中DNA复制、限制、修饰或修复有关的蛋白编码基因,存在于大多数细菌中,并且不显现频繁的水平转移,具备了作为系统发育分析靶基因的条件。由于gyrB作为蛋白编码基因,其所固有遗传密码子的兼并性使得DNA序列可以发生较多的变异而不改变氨基酸序列,因此gyrB基因在细菌的系统发育学,特别是在近缘种的菌株的区分及鉴定方面受到高度关注[25]。gyrB基因既弥补了16S rDNA的高保守性,也克服了16S-23S rDNA序列高变异性和复杂性。Venkateswaran K等[26]研究发现副溶血弧菌与溶藻弧菌的16S rDNA序列的相似率为99.7%,而1 258 bp的gyrB序列的相似率仅为86.8%,可以明显区分出这两种弧菌。Vuddhakul V等[27]通过对霍氏弧菌(V.hollisae)部分gyrB序列分析显示,该序列与副溶血弧菌的相似率为80%,可明显区分该两种弧菌。本研究选用16S rDNA、HSP60、gyrB作为靶基因对筛选的47株弧菌进行扩增及测序,通过与GenBank中相似性较高的弧菌进行同源性及系统发育树分析,结果发现16S rDNA和HSP60均不能成功鉴定弧菌到种,引物gyrB3能成功扩增所有47株菌株,且成功构建47株菌株的系统发育树,表明利用gyrB3引物进行海洋弧菌的分子鉴定是可靠有效的方法。
通过gyrB3的分子鉴定,在永乐群岛7个岛礁海域分离的47株弧菌分属于7个种,其中溶藻弧菌的存在具有普遍性,在7个岛礁海域中均有存在;而强壮弧菌仅在银屿海域中被分离到。在7个岛礁中,鸭公岛海域的弧菌多样性程度最高,甘泉岛、银屿、全富岛、晋卿岛次之,银屿和羚羊礁筐仔沙洲最低。近年来,永乐群岛的鸭公岛、银屿和全富岛开放了观光旅游,其中鸭公岛上还提供了游客的餐饮服务,餐饮垃圾与污水的排放可能是鸭公岛海域弧菌多样性较为丰富的主要原因之一。总体而言,永乐群岛7个岛礁近海海域的弧菌多样性较低。
