菜籽饼粕中多肽的提取纯化及抗肿瘤活性
2022-02-20黄文丽
熊 川, 罗 强, 黄文丽, 李 萍, 张 娟, 金 鑫, 朱 宇
(四川省农业科学院生物技术核技术研究所1,成都 610061) (重庆医科大学附属第二医院感染病分子重点实验室肝炎研究所2,重庆 623000) (四川省农业科学院茶叶研究所3,成都 610066)
油菜籽,十字花科(Cruciferae)芸薹属(Brassica)作物油菜(BrassicanapusL.)的种子,是世界范围内最主要的植物油原料之一。我国是油菜种植大国,国家统计局数据显示,2019年我国油菜种植面积为6 583.09 hm2,油菜籽产量为1 348.47万t,占世界总年产量的四分之一[1]。我国油菜籽主要用以食用油的生产,浸提或压榨后会产生大量的菜籽饼粕。目前,受制于提取加工技术研究的匮乏,菜籽饼粕主要用于燃料与肥料,其经济价值尚存极大的开发空间。菜籽饼粕营养成分含量丰富,富含蛋白质、碳水化合物、脂质、矿物质和维生素等[2]。此外,菜籽饼粕氨基酸组成接近联合国粮农组织(FAO)和世界卫生组织(WHO)推荐值,氨基酸分布平衡,含有丰富的含硫氨基酸及一定量的赖氨酸,是一种优良的天然植物蛋白资源[3]。因此,深入研究菜籽饼粕的蛋白质提取利用,对提高油菜籽产业价值链具有重大意义。
植物蛋白提取中关键的一步是破碎细胞壁以促进蛋白质溶出,一般包括单一球磨、高压均化处理,酶法以及物理法等[4],这些操作方法复合使用,能够有效去除部分纤维及还原糖,提高蛋白提取率和纯度[5]。以菜籽饼粕为原材料,获得的菜籽饼粕蛋白需要进一步酶解以获得菜籽饼粕多肽,酶解法具有反应条件温和、效率高、不产生消旋作用等优点,但是蛋白酶具有底物专一性,因此筛选合适的蛋白酶是酶法制备多肽的重要步骤[6]。菜籽饼粕多肽多是相对分子质量小于5 000 u的小肽,传统分离方法的区分精度受限,因此,需结合凝胶过滤色谱和反向高效液相色谱进行纯化。
多肽(polypeptide)是α-氨基酸以肽键连接在一起而形成的化合物,也是蛋白质水解的中间产物,是源于蛋白质的多功能化合物,且通常情况下营养和生理功能优于蛋白质(大分子蛋白质)和氨基酸。目前,获得的多肽药物主要包括多肽疫苗、抗肿瘤多肽、抗病毒多肽等,多肽药物与一般的有机小分子药物相比,具有生物活性强、用药剂量小、毒副作用低和疗效显著等突出特点[7]。菜籽饼粕是提取天然植物多肽的理想来源,目前,来源于菜籽的蛋白已有相关报道,菜籽球蛋白(Cruciferin)为11/12S球蛋白,富含赖氨酸和甲硫氨酸,平均分子量为300~360 ku,具有良好的凝胶特性[8]。菜籽白蛋白(Napin)为1.7/2S白蛋白,富含脯氨酸、谷氨酰胺和半胱氨酸,具有良好的溶解性、成膜性、较高的热稳定性及耐胃蛋白酶特性[9]。但鲜有针对菜籽饼粕多肽及其生理活性的报道。
本研究以菜籽油生产的副产物菜籽饼粕为原料,综合物理法和酶法进行提取,联用凝胶过滤色谱和反向高效液相色谱进行多肽的纯化,建立一套适宜于菜籽饼粕分离纯化的方法。进一步构建细胞模型,探索菜籽饼粕多肽的抗肿瘤活性,最终鉴定出具有抗肿瘤活性的多肽,为多肽类药物和菜籽油产业的深度开发利用提供参考。
1 材料与方法
1.1 材料与仪器
菜籽饼粕自然干燥,过100目筛后获得干粉,备用;人宫颈癌Hela细胞系、胎牛血清、DMEM培养液、青霉素、链霉素,3-(4,5-二甲基-2-噻唑)-2,5-二苯基溴化四氮唑噻唑蓝(MTT、Caspase检测试剂盒)、细胞色素C检测试剂盒;其余试剂均为分析纯。
Delta 1-24 LCS真空冷冻干燥机,Microfuge 20R高速离心机,Forma 3111 CO2细胞培养箱,Quest 10中高压层析系统,1260 Infinity II半制备型高效液相色谱,N-1210BS-WB旋转蒸发仪,SpectraMax L酶标仪,CKX53倒置显微镜。
1.2 方法
1.2.1 菜籽饼粕多肽提取与纯化
1.2.1.1 菜籽饼粕总蛋白提取
称取菜籽饼粕干粉50 g,置于烧杯中,按照菜籽饼粕干粉/PBS缓冲液(pH 6.8)的料液比1∶20加样,放入超声-微波协同萃取仪中,微波功率80 W,处理时间8 min,处理结束后转速4 000 r/min条件下离心20 min,吸取上清液,计算蛋白的提取率。
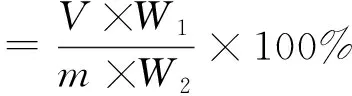
式中:V为菜籽饼粕蛋白提取液的总体积/mL;W1为提取液中蛋白的含量/g/100 mL;m为菜籽饼粕的质量/g;W2为菜籽饼粕中蛋白的含量/g/mL,W1和W2采用凯式定氮法测定。
1.2.1.2 菜籽饼粕多肽的分离
通过前期预实验,选用碱性蛋白酶Protex6L作为菜籽饼粕总蛋白的水解酶。水解条件设定为:底物添加质量分数2%,加酶量5 500 U/mL,通过添加浓度为0.5 mol/L的NaOH溶液保证反应中pH维持在10,反应时间设定为2 h,温度设定为55 ℃,反应后6 000 r/min条件下离心5 min收集上清液,冷冻干燥获得菜籽饼粕总多肽干粉。
取菜籽饼粕总多肽干粉5 g,无菌水溶解,配制成50 mg/mL的溶液,上样于Superdex 30 Increase 凝胶过滤柱,无菌水洗脱,通过Bio-rad的Quest 10中高压层析系统收集洗脱液,215 nm下测定吸光值,收集并冻干单一峰,得到菜籽饼粕总多肽复合物。
1.2.1.3 菜籽饼粕多肽的纯化与鉴定
取菜籽饼粕总多肽复合物1 g,无菌水溶解,配制成10 mg/mL的溶液,反相高效液相色谱法(RP-HPLC)纯化,收集单一峰,冷冻干燥获得菜籽饼粕多肽。反相高效液相色谱条件设定为:采用C18色谱柱,流动相A相为纯净水,流动相B相为含0.1%三氟乙酸的乙腈溶液;单针进样量为30 μL,测定流速设定为1.0 mL/min,检测波长为215 nm;检测洗脱条件设定为:A相为0~6 min,99%~97%;6~10 min,97%~96%;10~16 min,96%~80%;16~22 min,80%~99%。
通过解析菜籽饼粕多肽的氨基酸序列。液相A液为含0.1%甲酸水溶液,B液为0.1%甲酸乙腈溶液。色谱柱以A液平衡。样品由自动进样器上样,再经色谱柱梯度分离,流速为0.3 mL/min,柱温70 ℃。质谱条件:样品用TripleTOF 5600+质谱仪进行质谱分析。分析时长18 min,检测方式:正离子,一级质谱扫描范围:600~3 500 m/z。
1.2.2 菜籽饼粕多肽形态观察
取质量为1 mg的菜籽饼粕多肽置于附有铜胶带的样品台,通过离子溅射仪在样品表面镀上一层导电金粉,置于扫描电镜下观察。样品在20.0 kV加速电压下进行检查[10],选择清晰的视野拍照。
取质量为1 mg的菜籽饼粕多肽溶解于蒸馏水中,配制成0.25 mg/mL的溶液,25 ℃进行圆二色谱测定,在190~260 nm范围内,以1 nm间隔和1 nm带宽采集数据。
1.2.3 菜籽饼粕多肽对Hela细胞存活率的影响
通过含有10%FBS的DMEM培养基培养Hela细胞,取对数期细胞接种于96孔板,调整细胞密度为1×105个/mL,每孔加入细胞悬液100 μL,96孔板置于5% CO2培养箱37 ℃培养。待细胞贴壁后,将细胞分为7组,每组8个复孔,分别为对照组(100 μL含血清DMEM培养基)和6个菜籽饼粕多肽组(含有菜籽饼粕多肽的培养基),菜籽饼粕多肽的最终质量浓度依次为12.5、25、50、100、200、400μg/mL,空白孔不接种细胞,加入100 μL含血清DMEM培养基,CO2培养箱培养12 h。采用MTT法测定细胞存活率。

1.2.4 脱氧核糖核苷酸末端转移酶介导的缺口末端标记法(TUNEL)染色
按照3×105个/孔的密度接种Hela细胞于6孔板中,待细胞贴壁后,加入不同浓度(50、100、200 μg/mL)的菜籽饼粕多肽处理12 h。丢弃培养基,每个孔中的细胞用预冷的PBS溶液洗涤3次。然后用4%多聚甲醛固定细胞1 h,在冰上用渗透溶液(0.1%Triton X-100和0.1%柠檬酸钠)处理细胞2 min。最后将细胞重新悬浮在含有10 μL TUNEL反应化合物的200 μL PBS溶液中,并在37 ℃下培养1 h,用倒置荧光显微镜观察染色情况[11]。
(1)大跨度巷道不同的开挖顺序对巷道围岩破坏区域、应力分布和位移量均有明显的影响,先开挖小断面有利于巷道顶底板的稳定,而先开挖大断面有利于巷道两帮的稳定。
1.2.5 Hela细胞线粒体膜电位测定
通过5,5,6,6-四氯-1,1,3,3-四乙基咪唑啉碘化物(JC-1)测定线粒体膜电位的变化。将Hela细胞以密度为3×103个/孔接种于96孔板中,细胞培养箱中培养12 h。待细胞贴壁后,将不同质量浓度(50、100、200 μg/mL)的菜籽饼粕多肽添加到细胞中继续培养12 h。PBS溶液重悬细胞。加入JC-1于Hela细胞中,最终质量浓度为2.5 μg/mL,反应15 min。使用FACS Calibur流式细胞仪记录荧光强度,计算得出Hela细胞的线粒体膜电位的变化。
1.2.6 细胞色素C释放测定
通过蛋白免疫印迹法测定Hela细胞中细胞色素C的释放情况。Hela细胞以3×105个/孔接种于6孔板中,细胞培养箱培养12 h,细胞贴壁后用不同质量浓度(50、100、200 μg/mL)的菜籽饼粕多肽处理12 h。预冷的PBS缓冲液冲洗细胞2次,使用细胞色素C释放凋亡检测试剂盒提取细胞线粒体和胞浆蛋白质。收集的蛋白质部分装载在12%SDS-PAGE凝胶上,并通过标准的Western印迹法进行分析[12]。一抗选择细胞色素C抗体(细胞色素C兔单克隆抗体4280),二抗选择GAPDH。
1.2.7 Caspase表达活性
Hela细胞按照密度为3×103个/孔接种于96孔板中,细胞培养箱中培养12 h。待细胞贴壁后,将不同质量浓度(50、100、200 μg/mL)的菜籽饼粕多肽添加到细胞中继续培养12 h。通过PBS溶液清洗,采用Caspase-9和-3活性检测试剂盒完成Caspase活性检测。重悬并收集细胞,加入裂解液并于冰上裂解5 min,4 ℃下10 000 r/min离心10 min,反应缓冲液处理,405 nm下测定吸光值。
1.3 数据处理
2 结果与分析
2.1 菜籽饼粕的分离纯化
通过磷酸盐缓冲液(PBS)提取,结合超声-微波萃取,获得菜籽饼粕总蛋白的得率为(68.82±2.23)%。碱性蛋白酶Protex6L水解菜籽饼粕总蛋白,获得菜籽饼粕总多肽的得率为(34.41±1.96)%。
2.1.2 菜籽饼粕多肽(RMP)纯化及鉴定
将提取获得的菜籽饼粕总多肽上样于Superdex 30 Increase凝胶过滤柱进行纯化,图1a显示,菜籽饼粕总多肽依据分子量的大小能够获得3个洗脱峰,经过碱性蛋白酶Protex6L水解后,菜籽饼粕多肽分子量较小,出峰较晚。通过抗肿瘤活性的初筛,选择A2组分进一步分离纯化。如图1b所示,A2上样于RP-HPLC后,能够分离出4个组分,通过对Hela细胞生长的抑制作用初筛,B3组分具有最好的抑制活性,因此收集B3组分作为菜籽饼粕多肽(RMP)。最终通过LC-MS-MS测定,确定RMP的氨基酸组成为Asp-Val-Phe-Val-Pro-Pro-Val-Leu(图1c),相对分子质量为886 u。
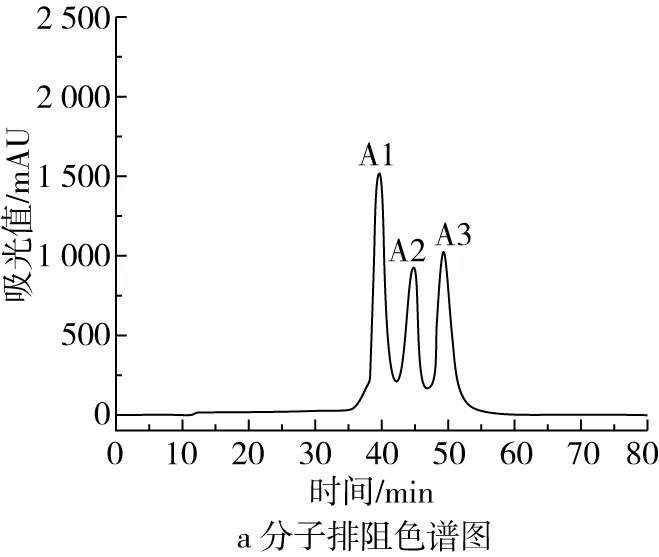


图1 RMP的分离纯化
2.2 RMP的形态观察与测定
在扫描电镜下,RMP呈现不规则的片状结构,片状结构的边缘出现不规则的卷曲(图2a)。圆二色谱的结果显示,如图2b,RMP在198 nm附近有一吸收带,在220 nm附近有一较弱吸收带,上述特征吸收表明RMP具有不规则二级结构,进一步的统计分析证实,在水溶液中,48.9%的LRP呈无规卷曲,31.7%的LRP呈β-折叠。


图2 RMP的形态观察与二级结构
2.3 RMP对Hela细胞活性的影响
RMP处理Hela细胞24 h,通过MTT法测试细胞的存活率。结果如图3所示,较低浓度的质量浓度介于12.5~25 μg/mL的RMP对于Hela细胞的活性未见明显影响。随着RMP浓度的升高,逐渐表现出对Hela细胞的抑制作用,50 μg/mL的RMP对Hela细胞的抑制率为18%,200 μg/mL的RMP则超过50%,RMP浓度进一步提高,对Hela细胞的抑制率则未见显著提升。因此,后续实验中RMP的作用质量浓度设定为50、100、200 μg/mL。
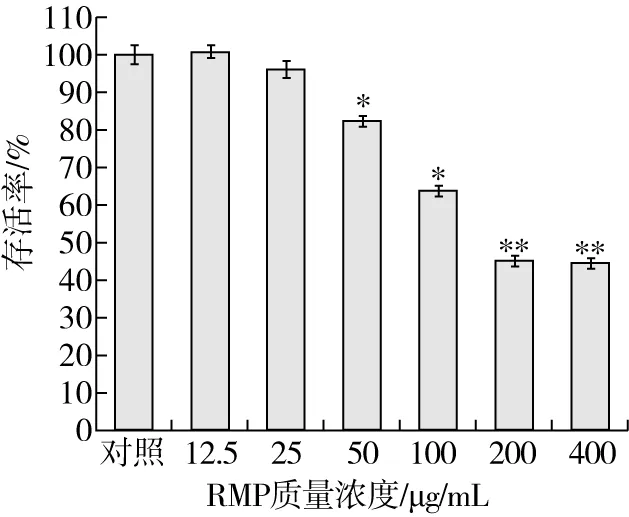
注:与对照组相比,*P<0.05, **P<0.01)。图3 RMP的细胞毒性
2.4 RMP诱导Hela细胞凋亡
为了确定RMP对Hela细胞增殖的抑制作用是否是由于细胞凋亡引起的,通过TUNEL法观察Hela细胞DNA断裂情况(图4)。结果发现,由于4′, 6-二氨基-2-苯基吲哚(DAPI)的存在,所有细胞的细胞核会被激发出蓝色荧光,而由于4甲基罗丹明-5-dUTP的存在会使得凋亡细胞的细胞核激发出红色荧光。因此,在荧光显微镜下,凋亡细胞的细胞核呈现淡绿色荧光。图4中,未处理的Hela细胞的细胞核呈现蓝色荧光。不同浓度的RMP处理后,某些细胞发生凋亡,细胞核呈淡绿色,而其他细胞依旧保持蓝色,且随着RMP作用计量的增加,细胞核呈现淡绿色荧光的细胞数量呈剂量依赖性增加。

图4 RMP引起Hela细胞细胞核形态变化观察 (比例尺=50 μm)
2.5 RMP诱导Hela细胞凋亡的机理探索
2.5.1 RMP对Hela细胞线粒体膜电位的影响
线粒体膜电位较高时,JC-1在基质中汇聚形成聚合物(J-aggregates),可以产生红色荧光,而线粒体膜电位较低时,JC-1不能聚集在线粒体基质中,以单体形式存在而产生绿色荧光。图5表明,正常细胞中,JC-1聚合物与单体的比率为(1.58±0.07),RMP处理后,Hela细胞的线粒体膜电位显著下降,且与RMP的浓度呈现计量依赖关系,200μg/mL的RMP处理12 h,聚合物与单体的比率降低为(0.18±0.02)。
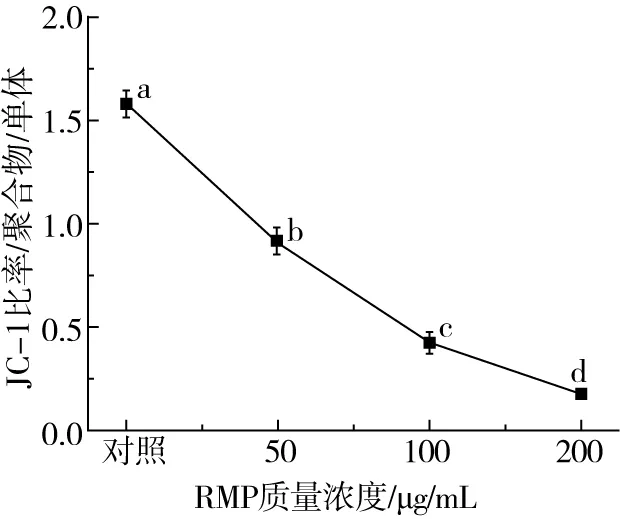
注:不同小写字母代表5%水平的差异。图5 线粒体膜电位分析
2.5.2 RMP对Hela细胞中细胞色素C释放的影响
如图6所示,正常培养的Hela细胞中未能在胞浆中检测到细胞色素C的存在,RMP作用后,Hela细胞胞浆中的细胞色素C含量显著升高,且随着RMP作用剂量的增大,逐步升高。100 μg/mL的RMP处理12 h,线粒体中细胞色素C的相对质量分数为(55.53±3.24)%,胞浆中则为(45.39±4.09)%。200 μg/mL的RMP处理12 h,线粒体中细胞色素C的相对质量分数为(43.13±3.89)%,胞浆中则为(96.98±5.51)%,与100 μg/mL处理组呈现显著性差异,结果表明细胞色素C从Hela细胞线粒体中释放而进入胞浆。

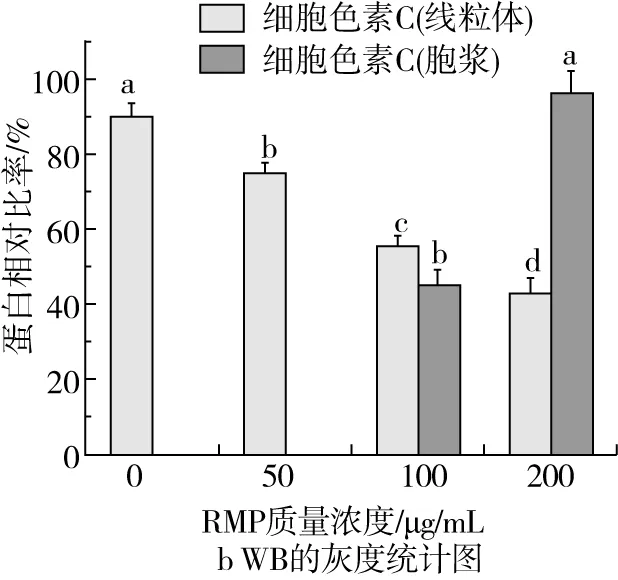
图6 RMP诱导Hela细胞中细胞色素C的释放
2.5.3 RMP对Caspase表达活性的影响
如图7所示,RMP的处理使得Hela细胞中Caspase表达活性显著升高,低质量浓度的RMP(50 μg/mL)处理12 h,Caspase-9的表达活性达到对照组的(172.26±4.68)%,Caspase-3则为(185.35±6.36)%。RMP作用浓度升高,Caspase表达活性也显著升高,200 μg/mL的RMP对应的Caspase-9为(247.62±5.66)%,Caspase-3则为(255.39±6.02)%。

图7 RMP对Hela细胞Caspase-9和-3活性的影响
3 讨论
3.1 菜籽饼粕多肽的制备
目前,以菜籽饼粕或菜籽蛋白为原料获得菜籽饼粕多肽的方法主要有酶法、化学法以及微生物发酵法,应用较广泛的为酶解法制备菜籽饼粕多肽。酶解法反应条件温和,有利于保持氨基酸的原有构型,但是蛋白酶具有底物专一性,因此,选择合适的蛋白酶是酶法制备菜籽饼粕多肽的重要步骤。本研究中,选择碱性蛋白酶Protex6L水解菜籽饼粕总蛋白制备多肽,最终得率接近35%。有报道,碱性蛋白酶Alcalase水解获得多肽的得率为40%[13],造成这种差异的原因可能在于菜籽饼粕自身蛋白质含量及酶解反应条件等。从菜籽饼粕总多肽中纯化出单一多肽的方法多在探索阶段,目前鲜有标准化流程化方法的报道。本研究中,依据分子量大小的分子排阻色谱和依据极性的反向高效液相色谱进行联用,纯化出RMP,这在天然植物多肽的纯化上应用较广[14],但在菜籽饼粕多肽上的应用则较少。此外,菜籽饼粕蛋白水解后的总多肽种类很多,其相对分子质量及结构存在差异,如何能高效分离纯化菜籽饼粕多肽是今后研究的重点。
3.2 RMP对Hela细胞的抑制作用
已有研究表明,在细胞凋亡的后期,DNA被降解成大小多为180~200 bp的片段,并且许多3′-OH末端被暴露出来,可以通过与某些特定的染料(如FITC)结合来检测细胞凋亡[15, 16]。因此,本研究中首先通过TUNEL染色来确定Hela细胞的状态,RMP的处理能够诱导Hela细胞凋亡,说明RMP抗肿瘤的活性是借助于诱导细胞凋亡实现的。
3.3 RMP诱导凋亡的作用机制探索
研究表明,在不同因素诱导的细胞凋亡中,线粒体膜电位会随着细胞形态的改变而降低,甚至在细胞形态改变之前也会降低[17, 18]。线粒体膜电位的降低常常伴随着细胞色素C的释放,而细胞色素C从线粒体释放到胞浆,是线粒体启动凋亡程序的关键步骤之一[19]。许多研究已经报道,某些天然产物可以通过促进细胞色素C的释放来促进肿瘤细胞凋亡。黑木耳(Auriculariaauricular)多糖可以促进细胞色素C释放,诱导人肝癌细胞凋亡[20]。目前,就菜籽饼粕多肽的抗肿瘤活性更多的集中于增强机体免疫力方面的研究,具体的作用通路尚不明了[21]。
研究证实,Caspases在细胞凋亡过程中起着重要作用。细胞凋亡可以认为是一种Caspases对底物进行不可逆的有限水解的级联放大反应过程。早期的研究表明,线粒体释放的细胞色素C与Caspase-9的前体结合,触发其活性[22]。激活的Caspase-9(启动子Caspase)能触发Caspase-3(效应子Caspase),Caspase-3通过水解Caspase靶蛋白引起细胞凋亡[23]。本研究中,RMP能够促进Caspase-9和-3的活性,实现Hela细胞的凋亡。
4 结论
通过分子排阻色谱和反向高效液相色谱法从菜籽饼粕中分离纯化出小分子多肽(RMP)并验证了RMP的抗肿瘤活性。RMP相对分子质量为886 u,由8个氨基酸组成,序列为Asp-Val-Phe-Val-Pro-Pro-Val-Leu,RMP结构简单,易于人工合成。分子排阻色谱和反向高效液相色谱法连用能够为菜籽饼粕多肽的分离纯化提供一种参考方法。抗肿瘤细胞实验证明,RMP能通过线粒体依赖途径诱导Hela细胞的凋亡,即降低Hela细胞线粒体膜电位,促进细胞色素C从线粒体到胞浆的释放,进而激活Caspase蛋白,执行细胞凋亡。因此,RMP有望作为一种抗肿瘤活性物质在肿瘤预防和治疗的保健品和药品中发挥作用。
