牛膝-杜仲药对对小鼠巨噬细胞RAW264.7的抗炎作用
2022-02-20高明珠陈春张巧艳卞俊鲍蕾蕾
高明珠 陈春 张巧艳 卞俊 鲍蕾蕾

中圖分类号 R965 文献标志码 A 文章编号 1001-0408(2022)03-0308-05
DOI 10.6039/j.issn.1001-0408.2022.03.09
摘 要 目的 研究牛膝-杜仲药对的抗炎作用。方法 将小鼠巨噬细胞RAW264.7分为空白组、模型组、牛膝组(800 μg/mL)、杜仲组(800 μg/mL)和牛膝-杜仲药对低、中、高浓度组(400、800、1 600 μg/mL),除空白组和模型组外,其余各组加入相应药物培养6 h后,空白组继续加入培养基,模型组加入10 μg/mL 脂多糖(以复制炎症模型),其余各组加入相应药物和10 μg/mL 脂多糖。检测各组细胞中炎症因子[一氧化氮(NO)、白细胞介素1β(IL-1β)、IL-6、肿瘤坏死因子α(TNF-α)]的水平,并采用金氏公式评价牛膝、杜仲的联合作用;检测细胞中诱导型一氧化氮合酶(iNOS)、环氧合酶2(COX-2)、核因子κB(NF-κB)抑制蛋白α(IκBα)的表达水平和NF-κB p65、IκB激酶(IKK)、p38丝裂原激活的蛋白激酶(p38 MAPK)、胞外信号调节激酶(ERK)、c-Jun N端激酶 (JNK)的磷酸化水平。结果 与空白组比较,模型组细胞中炎症因子水平以及iNOS、COX-2蛋白表达水平和NF-κB p65、IKK、p38 MAPK、ERK、JNK蛋白磷酸化水平均显著升高(P<0.01),IκBα蛋白的表达水平显著降低(P<0.01);经牛膝-杜仲药对干预后,细胞中炎症因子水平以及上述蛋白的表达水平或磷酸化水平大部分显著逆转(P<0.05或P<0.01),且牛膝-杜仲药对具有协同作用。结论 牛膝-杜仲药对对RAW264.7细胞具有协同抗炎作用,其作用机制可能与抑制NF-κB/MAPK信号通路相关蛋白表达有关。
关键词 牛膝;杜仲;药对;抗炎;NF-κB/MAPK信号通路
Anti-inflammatory effect of couplet medicinals of Achyranthes bidentata-Eucommia ulmoides on mouse macrophage RAW264.7
GAO Mingzhu1,2,3,CHEN Chun1,2,ZHANG Qiaoyan3,BIAN Jun4,BAO Leilei1,2(1. School of Pharmacy, Jiangxi University of Chinese Medicine, Nanchang 330004, China; 2. Dept. of Pharmacy, the Third Affiliated Hospital of Naval Medical University, Shanghai 200438, China; 3. School of Pharmacy, Zhejiang Chinese Medical University, Hangzhou 311402, China; 4. Dept. of Pharmacy, the First Affiliated Hospital of Naval Medical University, Shanghai 200438, China)
ABSTRACT OBJECTIVE To study the anti-inflammatory effect of couplet medicinals of Achyranthes bidentata-Eucommia ulmoides. METHODS Mouse macrophage RAW264.7 were divided into blank group, model group, A. bidentata group (800 μg/mL), E. ulmoides group (800 μg/mL) and low-, medium- and high- concentration groups of couplet medicinals of A. bidentata- E. ulmoides (400, 800, 1 600 μg/mL). Excep for blank group and model group, the other groups were added with corresponding drugs for 6 hours; then blank group was continued to add into the medium, while model group was added into 10 μg/mL lipopolysaccharide (to induce the inflammatory model); other groups were added into corresponding drugs and 10 μg/mL lipopolysaccharide. The levels of inflammatory factors [nitric oxide (NO), interleukin-1β (IL-1β), IL-6, tumor necrosis factor-α (TNF-α)] were detected, and Jin’s formula was used to evaluate the effects of A. bidentata-E. ulmoides. The expression of inducible nitric oxide synthase (iNOS), cyclooxygenase-2 (COX-2), nuclear factor kappa-B (NF-κB) and inhibitor α of NF-κB (IκBα) as well as the phosphorylation of NF-κB p65, IκB kinase (IKK), p38 mitogen-activated protein kinase (p38 MAPK), extracellular signal-regulated kinase (ERK)and c-Jun N-terminal kinase (JNK) were determined. RESULTS Compared with blank group, the level of inflammatory factors, protein expression of iNOS and COX-2 as well as the phosphorylation of NF-κB p65, IKK, p38 MAPK, ERK and JNK were increased significantly (P<0.01), while the protein expression of IκBα was decreased significantly (P<0.01). After intervention of couplet medicinals of A. bidentata-E. ulmoides, the level of inflammatory factors, the expression or phosphorylation of above proteins were reversed significantly (P<0.05 or P<0.01), and couplet medicinals of A. bidentata-E. ulmoides had a synergistic effect. CONCLUSIONS The couplet medicinals of A. bidentata-E. ulmoides have synergistic anti-inflammatory effect on RAW264.7 cells. Its mechanism may be related to the inhibition of NF-κB/MAPK signaling pathway related protein expression.
KEYWORDS Achyranthes bidentata; Eucommia ulmoides; couplet medicinals; anti-inflammation; NF-κB/MAPK signaling pathway
牛膝为苋科植物牛膝Achyranthes bidentata Bl.的干燥根,具有补肝肾、强筋骨、祛瘀通络和引血下行的作用,主要含有多糖、多肽、三萜皂苷类、酮甾类、甾醇类、生物碱类等化学成分,具有抑制神经细胞凋亡、调节免疫相关细胞因子等作用[1]。杜仲是杜仲科植物杜仲Eucommia ulmoides Oliver.的树皮,在我国有两千多年的用药历史,《神农本草经》中将其列为上品,主要用于治疗肝肾不足、腰膝酸痛、筋骨无力、头晕目眩等疾病,是中医骨伤科治疗骨关节炎的常见药物,被广泛应用于中药方剂或中成药配伍中[2]。
药对又称为对药、对子,由临床上相对固定的2味药材配伍而成,具有中药配伍的基本特点。《中药药对大全》中将牛膝、杜仲列为药对,使两者补肝肾、强筋骨之力倍增[3]。壮筋养血汤、补肾养血化瘀汤、补益干漆丸、杜仲丸和独活寄生汤均为我国治疗骨关节炎的传统方剂,这些方剂中均含有牛膝、杜仲2味药材[4-5]。骨关节炎是一种以炎症和软骨退化为特征的关节疾病[6]。基于此,本研究以小鼠巨噬细胞RAW264.7为研究对象,以脂多糖诱导建立细胞炎症模型[7],从体外层面考察牛膝-杜仲药对的协同抗炎作用,为阐明该药对治疗骨关节炎的机制提供实验基础。
1 材料
1.1 主要仪器
本研究所用主要仪器有SW-CJ-2FD型双人单面超净台(苏州净化设备有限公司)、MCO-15AC型CO2恒温培养箱(日本Sanyo公司)、DMI3000型倒置相差显微镜(美国Leica公司)、Synergy LX型连续波长酶标仪(美国Bio-Tek公司 )、LDZX-30KB型高压灭菌锅(上海申安医疗器械厂)、LP502型电子天平(常熟市衡器厂)、WD- 9413B型凝胶成像系统(北京六一生物科技有限公司)。
1.2 主要药品和试剂
本研究所用主要药品有牛膝、生杜仲(上海虹桥中药饮片公司,批号分别为210326、191231),经海军军医大学第三附属医院药剂科鲍蕾蕾副主任药师鉴定为真品。主要试剂有DMEM高糖培养基、胎牛血清(美国Gibco公司,批号分别为p002548、10099);CCK-8试剂盒、Western及IP细胞裂解液、BCA蛋白定量试剂盒、一氧化氮(nitric oxide,NO)检测试剂盒(上海碧云天生物技术有限公司,批号分别为C0038、P0013、P0012、S0021M);ECL化学发光剂(北京Biosharp公司,批号BL520B);小鼠白细胞介素6(interleukin-6,IL-6)酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)试剂盒、小鼠IL-1β ELISA试剂盒、小鼠肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)ELISA试剂盒(江苏酶免实业有限公司,批号分别为MM-0163M2、MM-0040M1、MM-0040M1);兔源诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)多克隆抗体、兔源环氧合酶2(cyclooxygenase-2,COX-2)多克隆抗体、兔源核因子κB p65(nuclear factor kappa-B p65,NF-κB p65)多克隆抗体、兔源磷酸化NF-κB p65(p-NF-κB p65)多克隆抗体、兔源NF-κB抑制蛋白α(inhibitor α of NF-κB, IκBα)多克隆抗体、兔源IκB激酶(IκB kinase,IKK)多克隆抗体、兔源磷酸化IKK (p-IKK)多克隆抗体、兔源p38丝裂原激活的蛋白激酶(p38 mitogen-activated protein kinase,p38 MAPK)多克隆抗体、兔源磷酸化p38 MAPK(p-p38 MAPK)多克隆抗体、兔源胞外信号调节激酶(extracellular signal-regulated kinase,ERK)多克隆抗体、兔源磷酸化ERK(p-ERK)多克隆抗体、兔源c-Jun N端激酶 (c-Jun N-terminal kinase,JNK)多克隆抗体、兔源磷酸化JNK(p-JNK)多克隆抗体、兔源GAPDH多克隆抗体、辣根过氧化物酶标记的山羊抗兔免疫球蛋白G二抗(美国Cell Signing Technology公司,批号分别为#13120S、#3033、#12282、#11930、#4814、#8242、#2697、#4511、#8690、#4370、#4695、#4668、#9252、#13120S、#7074S);其余试剂为实验室常用规格,水为纯净水。
1.3 细胞
本研究所用小鼠巨噬细胞RAW264.7受赠于浙江中医药大学张巧艳教授课题组。
2 方法
2.1 单一药材水提液和牛膝-杜仲药对水提液的制备
取牛膝10 g、杜仲10 g 分別加10倍量水(mL/g,下同)浸泡过夜,煎煮至沸腾后保持微沸15 min,过滤;再加等量水重复煎煮,提取2次,过滤;合并3次滤液并浓缩成浸膏。另外,取牛膝10 g、杜仲10 g混合,加入10倍量水浸泡过夜,再同上述方法煎煮、过滤,浓缩成浸膏。再将单味药以及药对的浸膏加水溶解,均制成生药量为10 mg/mL的药液。
2.2 细胞培养
将RAW264.7细胞复苏,以含5%胎牛血清、1%双抗(青霉素和链霉素)的DMEM高糖培养基(以下简称“培养基”)置于37 ℃、5%CO2培养,待细胞融合度达70%~80%时进行传代,然后进行后续实验。
2.3 牛膝-杜仲药对的细胞毒性考察
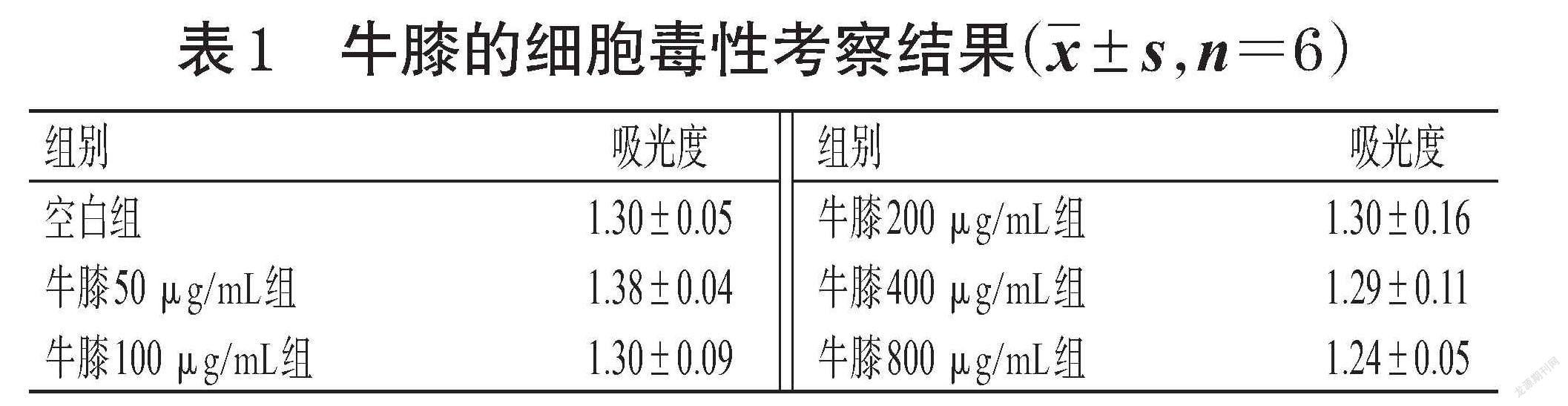
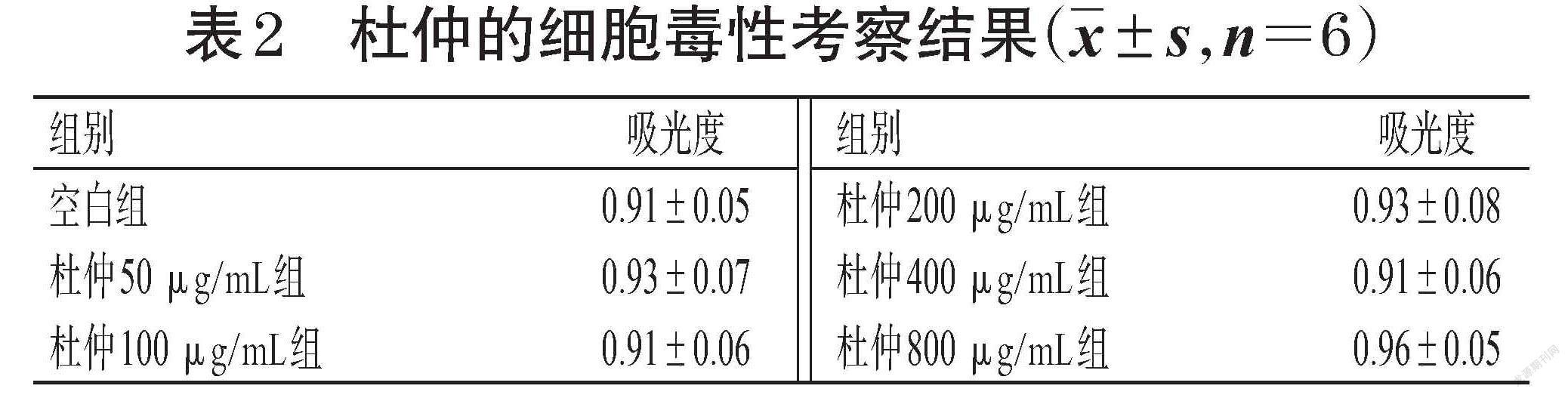
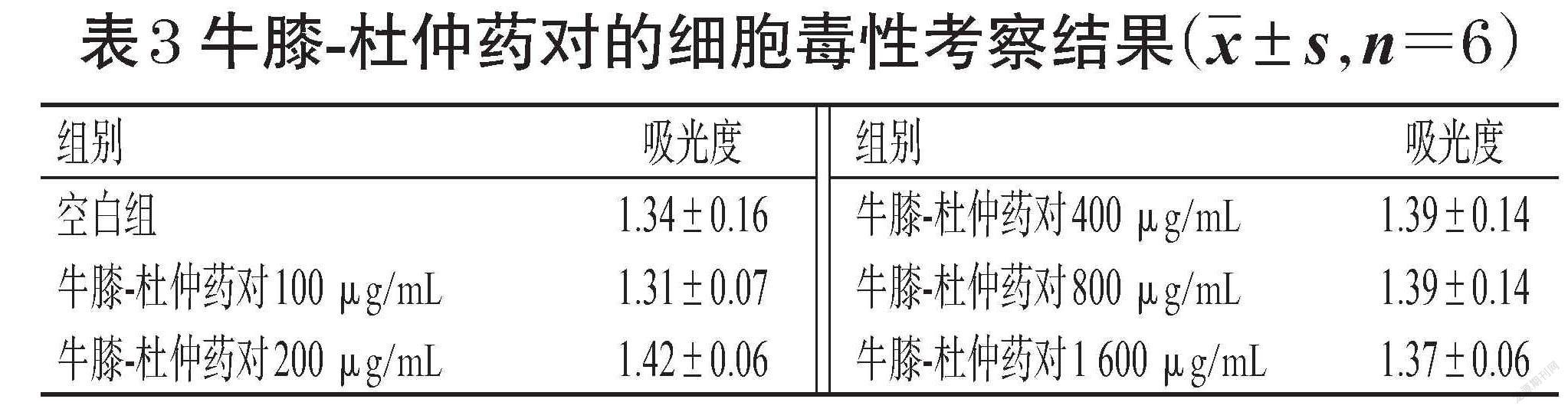
将细胞以1×105 mL-1接种于96孔板中,每孔0.2 mL,然后分为空白组、牛膝不同浓度组(50、100、200、400、800 μg/mL,以生药质量浓度计,下同)、杜仲不同浓度组(50、100、200、400、800 μg/mL)、牛膝-杜仲药对不同浓度组(100、200、400、800、1 600 μg/mL),上述各给药浓度根据本课题组前期预实验结果设置。各组细胞培养24 h后,吸弃培养基,空白组加入培养基100 μL,其余各组加入含相应药物的培养基100 μL;培养24 h后,按CCK-8试剂盒说明书方法操作,然后采用酶标仪于450 nm波长下检测各孔的吸光度,吸光度越大表明细胞存活数量越多、药物毒性越低。
2.4 分组、造模与给药
将细胞以1×105 mL-1接种于96孔板中或以8×105 mL-1接种于6孔板,然后分为空白组、模型组、牛膝组(800 μg/mL)、杜仲组(800 μg/mL)和牛膝-杜仲药对低、中、高浓度组(400、800、1 600 μg/mL),上述各给药浓度根据本课题组前期预实验结果设置。空白组和模型组加入培养基,其余各组加入含相应药物的培养基,培养6 h;弃去培养基,空白组加入培养基,模型组加入含10 μg/mL 脂多糖的培养基(以复制炎症模型),其余各組加入含相应药物和10 μg/mL脂多糖的培养基,继续培养18 h,再进行后续实验。
2.5 牛膝-杜仲药对对细胞中炎症因子表达的影响及联合作用评价
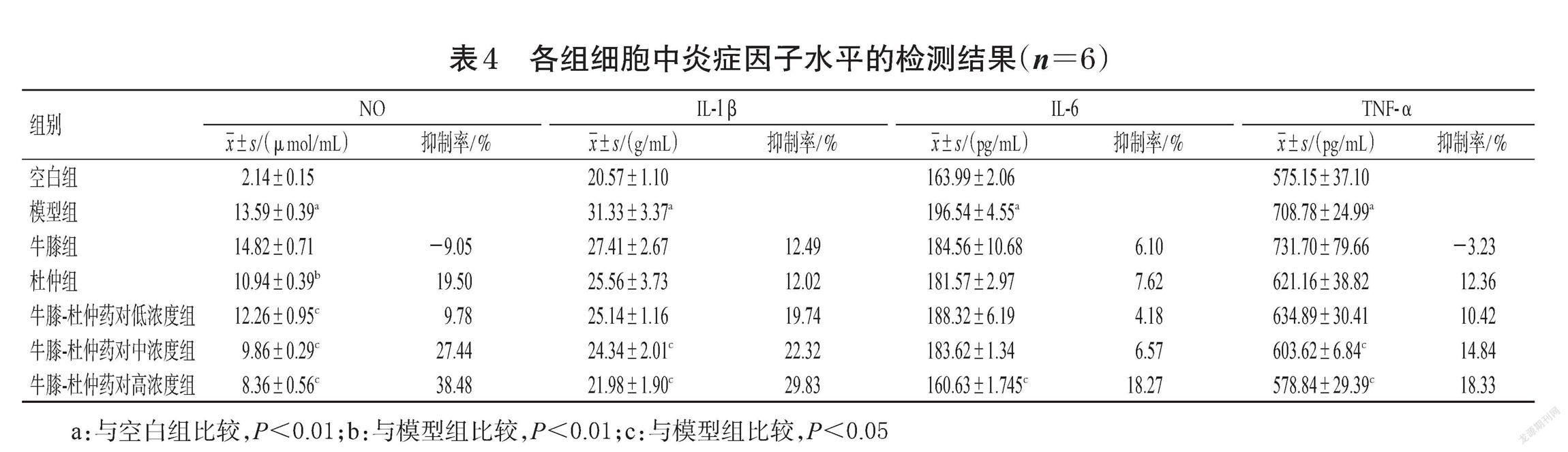
采用Griess法和ELISA法进行检测。将细胞以1×105 mL-1接种于96孔板中,每孔0.2 mL,按“2.4”项下方法分组、造模与给药,每组设置6个复孔。细胞培养结束后,取上清液,按照NO含量测定试剂盒和相应ELISA说明书相关方法操作,检测细胞中NO、IL-1β、IL-6、TNF-α的水平,并计算各炎症因子抑制率[抑制率=(模型组炎症因子水平-给药组炎症因子水平)/模型组炎症因子水平×100%]。另外,采用金氏公式(Q=[EA+BEA+EB-EA×EB] )评价牛膝-杜仲药对的联合作用,其中EA、EB分别表示牛膝、杜仲单独作用时的炎症因子抑制率,EA+B表示牛膝、杜仲联合作用后的炎症因子抑制率(此处以牛膝-杜仲药对高浓度组所得抑制率结果进行计算);当Q值大于1.15时表示两者具有协同作用,当Q值小于0.85时表示两者具有拮抗作用[8]。
2.6 牛膝-杜仲药对对细胞中炎症相关蛋白表达的影响
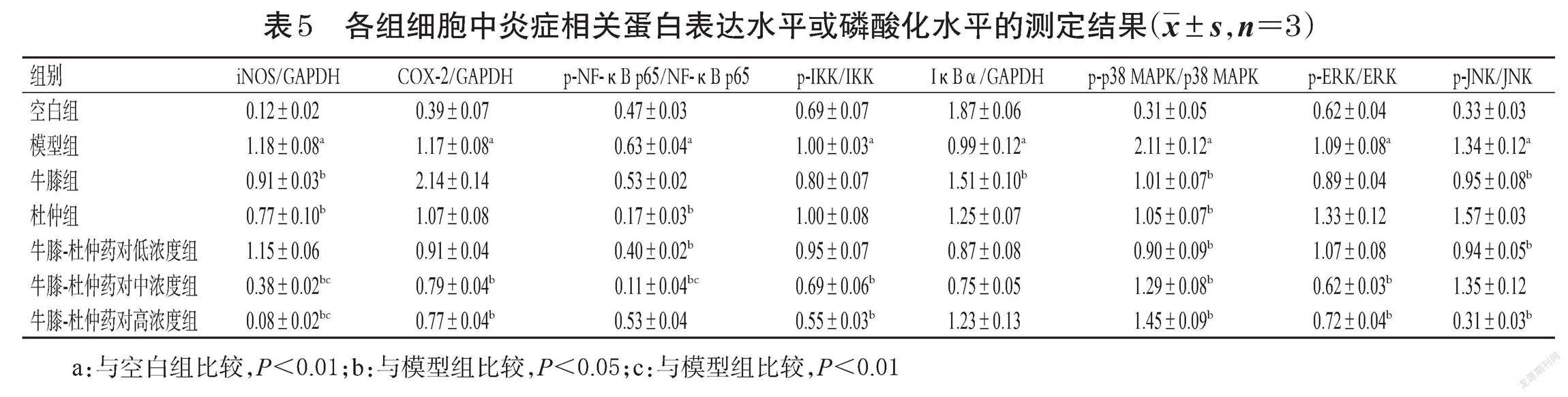
采用Western blot法进行检测。将细胞以8×105 mL-1接种于6孔板中,按“2.4”项下方法分组、造模与给药,每组设3个复孔。细胞培养结束后,弃去培养基,以PBS洗涤2~3次,加入适量RIPA裂解液提取总蛋白,并置于冰上充分裂解30 min后,于4 ℃条件下以12 000 r/min离心15 min;取上清液,采用BCA法测定蛋白浓度。蛋白经煮沸变性后,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳;转膜,以5%脱脂奶粉封闭2 h;加入iNOS、COX-2、p-NF-κB p65、NF-κB p65、p-IKK、IKK、 IκBα、p-p38 MAPK、p38 MAPK、p-ERK、ERK、p-JNK、JNK、GAPDH一抗(稀释度均为1 ∶ 1 000),4 ℃孵育过夜;以TBST洗膜10 min×3次,加入二抗(稀释度为1 ∶ 3 000),室温孵育2 h;以TBST洗膜10 min×3次,加入ECL化学发光试剂,采用凝胶成像系统成像。采用Image J 6.0软件进行分析,以iNOS、COX-2、IκBα与内参GAPDH的蛋白条带灰度值比值表示这3种蛋白的表达水平,以p-NF-κB p65与NF-κB p65、p-IKK与IKK、p-p38 MAPK与p38 MAPK、p-ERK与ERK、p-JNK与JNK的蛋白条带灰度值比值表示这5种蛋白的磷酸化水平。
2.7 统计学分析
采用GraphPad Prism、SPSS 19.0软件进行数据分析,数据以x±s表示;多组间比较采用单因素方差分析;组间两两比较时,若方差齐则采用最小显著性差异法(LSD),若方差不齐则采用Dunnett’s T3多重比较。检验水准α=0.05。
3 结果
3.1 牛膝-杜仲药对的细胞毒性考察结果
与空白组比较,单一药材不同浓度组和牛膝-杜仲药对不同浓度组细胞吸光度差异无统计学意义(P>0.05),表明牛膝、杜仲的单一药材或两者组成药对后均对RAW264.7细胞的生长无毒性作用,结果见表1、表2、表3。
3.2 牛膝-杜仲药对对细胞中炎症因子表达的影响及联合作用评价结果
与空白组比较,模型组细胞中NO、IL-1β、IL-6、TNF-α水平均显著升高(P<0.01);与模型组比较,杜仲组细胞中NO水平显著降低(P<0.01),牛膝-杜仲药对各浓度组细胞中上述指标水平大部分显著降低(P<0.05或P<0.01),结果见表4。另外,牛膝、杜仲联合作用后,对NO、IL-1β、IL-6和TNF-α抑制率的Q值分别为3.43、1.29、1.37、1.97,均大于1.15,表明两者具有协同抗炎作用。
3.3 牛膝-杜仲药对对细胞中炎症相关蛋白表达的影响
与空白组比较,模型组细胞中iNOS、COX-2蛋白的表达水平和NF-κB p65、IKK、p38 MAPK、ERK、JNK蛋白的磷酸化水平均显著升高(P<0.01),IκBα蛋白表达水平均显著降低(P<0.01)。与模型组比较,牛膝组、杜仲组以及牛膝-杜仲药对各浓度组细胞中上述蛋白的表达水平或磷酸化水平大部分显著逆转(P<0.05或P<0.01)。结果见图1、表5。
4 讨论
药对是以中医药基本理论为原则,选择性地将2味中药进行配对的组合药,以达到促进某一功效的目的,从而有利于提高临床疗效。牛膝、杜仲是补肝肾、强筋骨的常用药对,杜仲主下部气分,长于补益肾气;牛膝主下部血分,偏于益血通脉;两者配伍可兼顾气血,使补肝肾、强筋骨之力倍增[9]。Jian等[10]通过网络药理学方法和分子对接法鉴定出牛膝-杜仲药对治疗骨关节炎的活性成分包括槲皮素、山柰酚、汉黄芩素、黄芩素等。这提示,牛膝-杜仲药对在治疗骨关节炎方面具有一定潜力。
骨关节炎是一种退行性关节疾病,但目前其具体发病机制尚不明确,推测其可能与炎症因子、基质金属蛋白酶有关[11-12]。在炎症反应中,炎症因子NO、IL-1β、IL-6和TNF-α均具有重要作用:低浓度的NO可促进炎症、诱导血管扩张,高浓度的NO可调节黏附因子、诱导炎症细胞凋亡[13];IL-1β可促进炎症,对宿主感染和损伤的防御反应至关重要[11];IL-6由单核巨噬细胞产生,在机体的抗感染免疫反应中具有重要作用[14];TNF-α在细胞炎症、增殖、分化和凋亡中具有重要作用[15]。这些炎症因子可诱导基质金属蛋白酶和前列腺素的产生,抑制蛋白多糖和Ⅱ型胶原的合成,从而促进骨关节炎的病情发展[16]。本研究结果显示,经牛膝-杜仲药对干预后,RAW264.7细胞中NO、IL-1β、IL-6、TNF-α水平均顯著降低,这表明牛膝-杜仲药对对细胞具有抗炎作用,且两者具有协同作用。
NO是一种自由基,主要由一氧化氮合成酶家族催化合成,其中包括内皮细胞一氧化氮合酶、iNOS以及神经元性一氧化氮合酶;当炎症因子刺激巨噬细胞或软骨细胞时,iNOS的表达水平增加,进而导致NO大量产生[17]。NF-κB 是经典的炎症信号通路,当发生炎症反应时,该通路被激活,IκBα与NF-κB p65发生解离,IκBα的表达减少,NF-κB p65进入细胞核内,进一步促进炎症因子如NO、IL-1β、IL-6和TNF-α等的转录[18]。MAPK (其亚单位包括p38 MAPK、ERK、JNK等)是NF-κB的上游调控因子,可加速炎症反应,激活iNOS、COX-2,进一步催化前列腺素E2的生成,从而诱导IL-1β、IL-6和TNF-α的分泌[18]。本研究结果显示,经牛膝-杜仲药对干预后,细胞中iNOS、COX-2蛋白表达水平和NF-κB p65、IKK、p38 MAPK、ERK、JNK蛋白的磷酸化水平等指标大部分显著降低(P<0.05或P<0.01)。这表明牛膝-杜仲药对对RAW264.7细胞的抗炎作用可能与NF-κB/MAPK信号通路有关。
综上所述,牛膝-杜仲药对对RAW264.7细胞具有协同抗炎作用,其作用机制可能与抑制NF-κB/MAPK信号通路相关蛋白表达有关。
参考文献
[ 1 ] HE X R,WANG X X,FANG J C,et al. The genus Achyranthes:a review on traditional uses,phytochemistry,and pharmacological activities[J]. J Ethnopharmacol,2017,203:260-278.
[ 2 ] 魏锦强,孙赫,曹学伟,等.牛膝治疗骨关节炎作用机制的网络药理学探讨[J].中药新药与临床药理,2020,31(9):1052-1060.
[ 3 ] 胥庆华.中药药对大全[M].北京:中国中医药出版社,1996:464-465.
[ 4 ] 袁玉影,李浩,张正午,等.独活寄生汤对胶原诱导性关节炎大鼠血清中炎症因子的影响[J].中国临床新医学,2020,13(8):786-789.
[ 5 ] 徐志斌.壮筋养血汤对兔膝骨性关节炎NO、IL-1、iNOS表达的影响[D].福州:福建中医药大学,2015.
[ 6 ] FEI J L,LIANG B,JIANG C Z,et al. Luteolin inhibits IL-1β-induced inflammation in rat chondrocytes and atte- nuates osteoarthritis progression in a rat model[J]. Biomed Pharmacother,2019,109:1586-1592.
[ 7 ] CAO Y,CHEN J H,REN G F,et al. Punicalagin prevents inflammation in LPS-induced RAW264.7 macrophages by inhibiting FoxO3a/autophagy signaling pathway[J]. Nutrients,2019,11(11):2794.
[ 8 ] 王佳艺,何俊劲,郝静超,等.多肽AP25与多西他赛联合用药对人乳腺癌裸鼠移植瘤的抑制活性研究[J].中国药理学通报,2015,31(9):1233-1238.
[ 9 ] 孔韶阳,温彬,颜冰.基于网络药理学探讨杜仲-牛膝治疗骨质疏松症分子机制[J].中医临床研究,2020,12(35):1-6.
[10] JIAN G H,SU B Z,ZHOU W J,et al. Application of network pharmacology and molecular docking to elucidate the potential mechanism of Eucommia ulmoides-Radix Achyranthis Bidentatae against osteoarthritis[J]. BioData Min,2020,13:12.
[11] ANSARI M Y,AHMAD N,HAQQI T M. Oxidative stress and inflammation in osteoarthritis pathogenesis:role of polyphenols[J]. Biomed Pharmacother,2020,129:110452.
[12] ZHENG L L,ZHANG Z J,SHENG P Y,et al. The role of metabolism in chondrocyte dysfunction and the progression of osteoarthritis[J]. Ageing Res Rev,2021,66:101249.
[13] COLEMAN J W. Nitric oxide in immunity and inflammation[J]. Int Immunopharmacol,2001,1(8):1397-1406.
[14] TANAKA T,NARAZAKI M,MASUDA K,et al. Regulation of IL-6 in immunity and diseases[J]. Adv Exp Med Biol,2016,941:79-88.
[15] ZELOVÁ H,HOŠEK J. TNF-α signalling and inflammation:interactions between old acquaintances[J]. Inflamm Res,2013,62(7):641-651.
[16] WANG T T,HE C Q. Pro-inflammatory cytokines:the link between obesity and osteoarthritis[J]. Cytokine Growth Factor Rev,2018,44:38-50.
[17] AHMAD N,ANSARI M Y,HAQQI T M. Role of iNOS in osteoarthritis:pathological and therapeutic aspects[J]. J Cell Physiol,2020,235(10):6366-6376.
[18] ZHANG Q,ZHANG J H,HE Y Q,et al. Iridoid glycosides from Morinda officinalis How. exert anti-inflammatory and anti-arthritic effects through inactivating MAPK and NF-κB signaling pathways[J]. BMC Complement Med Ther,2020,20:172.
(收稿日期:2021-07-19 修回日期:2021-11-14)
(編辑:唐晓莲)
基金项目:上海市科研计划项目(No.19ZR1456500)
硕士研究生。研究方向:中药药理学。E-mail:576436541@qq.com
通信作者:副主任药师,硕士生导师。研究方向:中药药理学。 E-mail:annabao212@126.com
