聚苯乙烯微塑料对典型农作物种子发芽和幼苗生长的影响
2022-02-19陈赋秋雪唐思琪袁昊马子轩陈坦杨婷张冰刘颖
陈赋秋雪,唐思琪*,袁昊,马子轩,陈坦, ,杨婷, ,张冰, ,刘颖,
1.中央民族大学生命与环境科学学院,北京 100081;2.中央民族大学北京市食品环境与健康工程技术研究中心,北京 100081
人类活动产生的塑料制品在环境中暴露,经风化等作用后,破碎成尺寸小于5 mm的塑料称为微塑料(Richard et al.,2004;Law et al.,2014),常见聚苯乙烯(PS)、聚乙烯(PE)、聚丙烯(PP)、聚氯乙烯(PVC)等材质(Cole et al.,2011;侯军华等,2020)。微塑料粒径小、质量轻,能在外力作用下远距离迁移,在水体、土壤、大气等介质中普遍检出(Alimi et al.,2018;邵媛媛等,2020),可进入生物体(Chae et al.,2018;任欣伟等,2018)。每年进入农业用地中的微塑料量极大,可能超过海洋中微塑料的总量(Nizzetto et al.,2016)。农膜的广泛应用是农业生态系统中土壤微塑料的主要来源之一(任欣伟等,2018;胡桂林,2019)。
土壤是人类农业活动的重要介质,作物的生长不可避免地受到土壤环境中微塑料等各种物质的影响。微塑料可改变土壤的物理、化学和生物特性,直接或间接影响植物的生长(Wan et al.,2019;Shi et al.,2022)。已有研究表明,100 nm的聚苯乙烯微塑料降低了蚕豆(Vicia faba)根系生物量和过氧化氢酶活性,对其植株生长有抑制作用(Jiang et al.,2019)。亚微米级球状微塑料被植物吸收、转运和积累,可随蒸腾作用和营养运输从根部转移到茎、叶等上部器官(Li et al.,2020),进入细胞连接或细胞壁孔隙,造成细胞破损,影响营养运输及植株生长(李连祯等,2019),从而影响作物代谢、发育特性,进而影响作物和土壤生态环境,甚至可能在作物中生物富集,通过食物链威胁人体健康(Kong et al.,2018;骆永明等,2018)。在作物萌发及生长初期,种子各项生理活动活跃,对外界环境敏感,且与作物幼苗后续生长密切相关,观察种子萌发和早期幼苗生长情况是目前评估高等植物生理毒性的重要方法(Gong et al.,2001)。分析微塑料对不同作物萌发和生长初期的影响,对认识微塑料的生态风险及毒性具有重要意义。
农业环境中的微塑料已引起广泛关注,目前关于微塑料对萌发和生长初期农作物影响方面的研究尚待深入。由于具有良好的化学性能和较低的价格,PS常被用于如农膜等各种产品的生产,因此也已成为当前土壤生态系统中最常见的污染物之一(Dong et al.,2020)。因此,本文以农膜常用材料PS为例,选择中国种植面积广、产量大的主要粮食作物小麦(Triticum aestivum)、玉米(Zea mays)、谷子(Setaria italica)及重要经济作物花生(Arachis hypogaea)、向日葵(Helianthus annuus),观测 5 μm聚苯乙烯微塑料(5 μm-MPs)悬浮液中几种作物种子发芽及污染土壤中幼苗生长情况,分析微塑料对作物种子及幼苗生理生化指标的影响,为揭示微塑料对作物的生态毒性作用机制积累基础数据。
1 材料与方法
1.1 供试材料
小麦种子、花生、玉米、向日葵、谷子种子分别选购鲁丰济麦22、山东红皮花生、水果玉米中农甜488、美国矮向日葵、黄谷小米黄金谷21。土培基质购自黑龙江杨晓东育苗基质加工厂生产,由有机营养土、木屑、细椰糠、珍珠岩、蛭石等混合制备,微塑料含量极少,含水率25%—30%,可溶性有机碳(DOC)、可溶性全氮(DTN)、可溶性硝态氮(DNN)、可溶性铵态氮(DAN)、可溶性有机氮(DON)的质量分数分别为 (120.00±13.79)、(91.43±13.46)、(38.87±2.97)、(10.33±4.61)、(42.27±15.72)mg·kg−1。5 μm-MPs 粉末购自苏州瑞纳新材料科技有限公司,聚苯乙烯材质,标称粒度5 μm。超氧化物歧化酶(SOD)试剂盒选用北京索莱宝科技有限公司的BC0170型SOD活性检测试剂盒。
1.2 试验方法
1.2.1 种子发芽试验
实验方法参考Sjollema et al.(2016)、连加攀等(2019)、廖苑辰等(2019)、刘蓥蓥等(2019)报道。种子发芽实验选用5种作物种子(小麦、花生、玉米、向日葵、谷子),设置7个外加5 μm-MPs质量浓度梯度(0、2、5、10、20、50、100 mg·L−1),3个重复。分别将0.4、1、2、4、10、20 mg 5 μm-MPs及2滴Tween 20溶液稀释于200 mL超纯水中,超声水浴制备各质量浓度梯度的5 μm-MPs悬浮液。将经过去离子水浮选和1.5% H2O2溶液浸泡后的参试种子用去离子水反复冲洗并浸泡6 h后,均匀置于铺有两层滤纸并以去离子水润湿的玻璃培养皿中,每皿10粒(谷子种子体积过小,每皿50粒)。培养皿中分别加入10 mL 0、2、5、10、20、50、100 mg·L−1微塑料悬浮液(超纯水配置),在25 ℃无光照恒温培养箱中培养7 d,从第3天开始打开培养皿每天补充1—2 mL去离子水以补偿蒸发水分。
第3、5、7天分别观测发芽数和芽长。小麦胚根长度超过2 mm记为发芽,玉米露白超过0.5 mm记为发芽,花生及向日葵胚根突破种皮且长度超过种子的一半记为发芽,谷子萌发露白即视为发芽。种子的发芽情况及活力指数的计算公式如下:
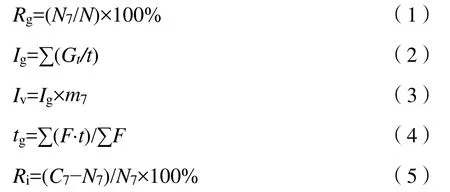
式中:
Rg——发芽率;
N7——7 d内供试种子发芽数;
N——供试种子总数;
Ig——发芽指数,单位为d−1;
Gt——t天内的发芽数;
t——对应的发芽天数;
Iv——活力指数,单位为 g·d−1;
m7——第7天的苗干质量,单位为g;
tg——平均发芽时间,单位为d;
F——种子在第t天的新发芽数;
Ri——抑制率;
C7——7 d内对照组发芽数。
1.2.2 土培试验
土培试验采用盆栽。选用3种作物种子(小麦、玉米、花生),设置4个外加5 μm-MPs质量分数梯度(0、20、50、100 mg·kg−1,以土壤鲜质量计),每个梯度设置2个平行重复,按1.2.1方法配制悬浮液,在花盆内加入约 3.75 kg土壤与悬浮液搅拌均匀,以超纯水调节土壤含水率至约40%,制成微塑料梯度污染土壤。种子预处理方法同种子发芽实验方法,播种于土壤约1 cm深处,每盆15粒,室温、自然光照下培养,每隔1天浇1次去离子水保持土壤湿度大体稳定(约40%)。
种子发芽破土后每隔2天记录幼苗生长情况,在第1片叶片达到约3 cm宽后每隔4 d用叶绿素测定仪(北京金科利达,TYS-4N型)测量叶片叶绿素相对含量SPAD值、氮含量。在加入5 μm-MPs悬浮液前及33 d土培试验结束后,每个处理从各平行组分别取 10 g土壤样品混合均匀得到混合土壤样品。以 0.01 mol·L−1CaCl2溶液浸提法(固液比1꞉10,平衡时间2 h)处理混合土壤样品得到浸出液,按照HJ 501—2009、HJ 668—2013等标准方法分别测定混合土壤样品浸出液的DOC、DTN;按标准方法NY/T 1116—2014测定混合土壤样品中的DNN、DAN,以差值法计算可DON含量。在种植33 d时,称取鲜质量0.2 g作物叶片研钵粉碎加入25 mL 80%丙酮充分浸泡 10 min,离心(4800 r·min−1,10 min)后取上清液,使用酶标仪(SpectraMax i3x,美国Molecular Devices)测定663 nm(叶绿素a)、645 nm(叶绿素b)处的吸光度,计算叶绿素a和叶绿素b含量。平行组中分别取等量叶片,剪碎混匀后称量0.1 g(鲜质量),以SOD试剂盒法测定样品中SOD的活性。
实验数据采用显著性差异分析统计,P<0.05时认为差异显著。
2 结果与讨论
2.1 水培条件下5 μm-MPs对作物发芽的影响
微塑料往往通过土壤水直接与植物作用,在作物生长初期,种子对土壤水更敏感。种子发芽试验可直观反映微塑料对种子发芽的影响,是通过观察作物种子发芽情况来评估生理毒性的重要方法。以微塑料 2、5 mg·L−1为低质量浓度,10、20 mg·L−1为中质量浓度,50、100 mg·L−1为高质量浓度。
萌发期的种子对外界环境因子敏感,种子发芽率和抑制率可以反映种子的萌发能力。如图 1a、b所示,综合两个指标可知,各质量浓度5 μm-MPs处理组中小麦发芽均受抑制;玉米、向日葵除部分高质量浓度(玉米为 100 mg·L−1,向日葵为 50 mg·L−1)表现为促进外其余质量浓度均表现为抑制;谷子为5 μm-MPs低质量浓度无影响,中高质量浓度发芽得到促进。水培中5 μm-MPs对上述4种作物萌发能力的影响尽管在统计学意义上不显著,但趋势大多与微塑料可抑制或延缓种子发芽的报道一致(纪红等,2021)。各质量浓度处理组中花生萌发能力均受到抑制,且表现为5 μm-MPs质量浓度越大,发芽受到的抑制越明显,20、50、100 mg·L−1处理组中花生的萌发能力受到显著抑制(P<0.05),100 mg·L−1处理组花生发芽率最低 (43.33%±5.77%),抑制率达到125.56%。综上所述,不同作物种子萌发对微塑料的敏感度存在差异。
发芽指数和活力指数体现种子活力,这两个指标越大则种子活力越强,种子在试验条件下生长情况越好。如图1c、d所示(谷子苗干质量过小,未测算活力指数),小麦表现为50 mg·L−1质量浓度处理组种子发芽指数显著降低,其余质量浓度无显著差异;花生种子活力表现为中高质量浓度处理组(20—100 mg·L−1)显著降低,且 5 μm-MPs质量浓度越高种子活力降低幅度越大,在100 mg·L−1时达到最低,发芽指数、活力指数分别仅为 5.51 d−1、31.34 g·d−1;玉米、谷子、向日葵种子活力对微塑料不敏感,除向日葵在部分处理组(5—20 mg·L−1)得到促进外其余均抑制,但各质量浓度处理组均无显著影响。总体上,水培条件下花生对较高质量浓度微塑料更敏感,发芽率、活力指数等指标在中高质量浓度都显著降低。文献报道20 nm PS塑料在质量浓度 200 mg·L−1时对大豆(Glycine max)种子活力抑制最强,100 nm PS微塑料在高质量浓度(1000 mg·L−1)时对种子活力抑制程度最强(吴佳妮等,2020),在高质量浓度时对大豆种子活力的抑制程度较大的结果与本研究花生种子活力指数的结果类似。其余作物种子活力受影响程度与微塑料的质量浓度未表现一致相关性,对微塑料的敏感程度也不同。
种子平均发芽时间越长,发芽越慢,种子对实验条件的适应越难。如图1e所示,5 μm-MPs暴露下小麦平均发芽时间主要表现为低、中质量浓度抑制,高质量浓度促进;花生主要表现为低、高质量浓度抑制,中质量浓度促进;玉米主要表现为低质量浓度促进,中质量浓度抑制,高质量浓度抑制减弱;向日葵则在50 mg·L−1时促进,其余质量浓度均抑制;谷子表现为 2、10、100 mg·L−1时抑制,其余质量浓度促进。统计学意义上,水培条件下 5 μm-MPs对 5种作物的平均发芽时间影响均不显著(P>0.05),这与文献报道的聚甲基丙烯酸甲酯微塑料对小麦种子平均发芽时间无显著影响的结果相似(连加攀等,2019)。
5 μm-MPs对作物水培7 d芽长的影响如图1f所示(因芽长过短未测量谷子)。小麦主要表现为5 μm-MPs质量浓度越高,芽长越短,但在统计学意义上无显著性差异。花生在100 mg·L−1时受到抑制并具有显著性差异(P<0.05),其余处理无显著规律。玉米在 10 mg·L−1时受到抑制,其余处理均得到促进,向日葵的芽长在各处理下均为促进,但上述趋势在统计学意义上不显著。各作物种子芽长对微塑料的敏感程度不同,其中花生芽长对微塑料较敏感,花生芽长在 100 mg·L−15 μm-MPs处理下受到显著抑制。
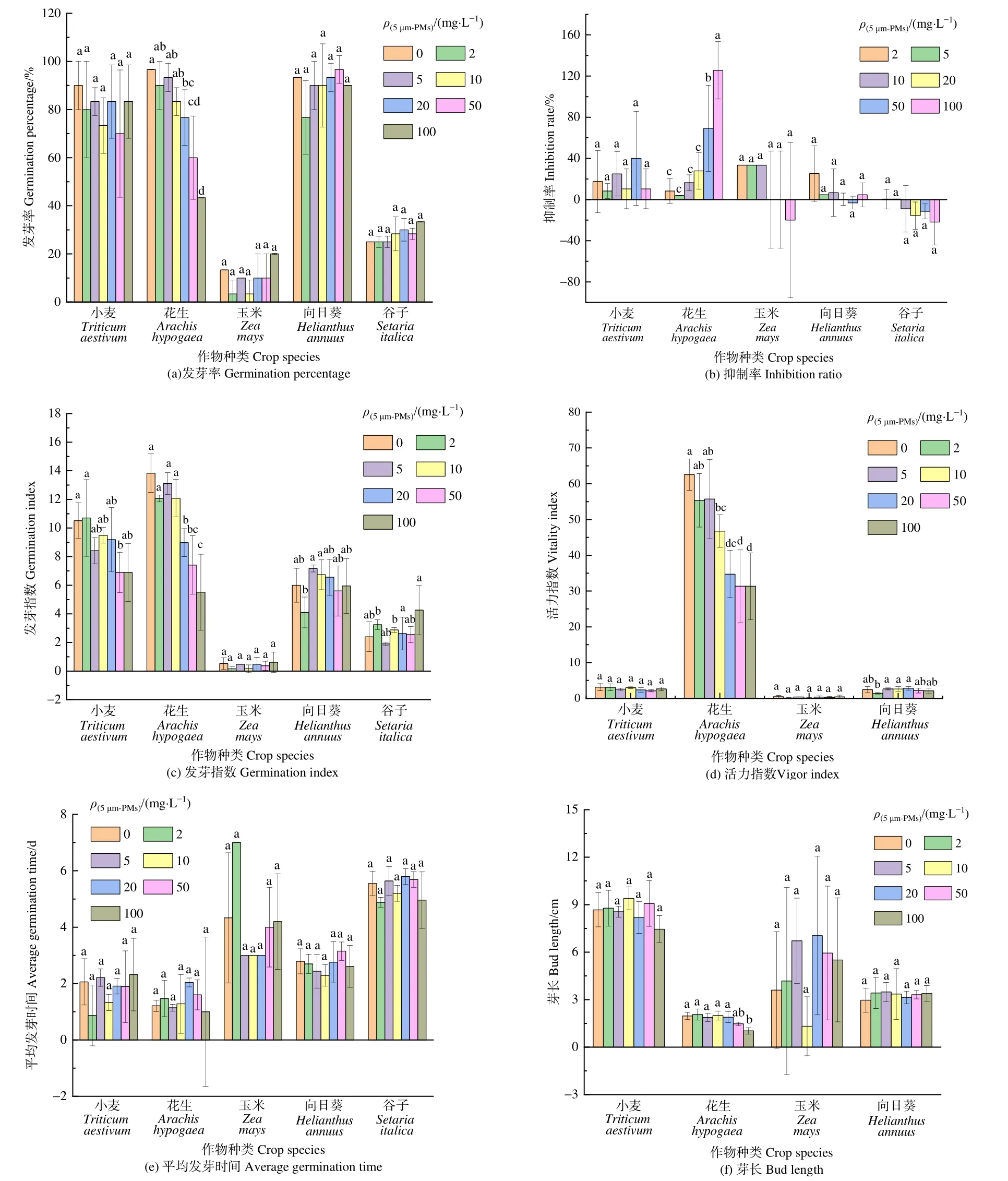
图1 不同质量浓度微塑料暴露下5种作物的发芽情况Figure 1 Germination of 5 species of crops exposed to microplastics of different mass concentrations
综合以上指标可知,5种作物中花生种子的萌发对微塑料更敏感。微塑料影响种子萌发及活性的机制与水培条件较相关的可能主要有两种,(1)微塑料的积累使种子表面孔隙物理性堵塞。微塑料具有疏水性,粒径小、比表面积大,易附着于种子上,堵塞种子孔隙,抑制植物种子的水分吸收(李瑞静等,2021),进而影响种子萌发及活性。如Bosker et al.(2019)发现聚苯乙烯荧光微塑料可在水芹(Lepidium Sativum)种衣壳的孔隙中积累。(2)微塑料进入种子的细胞内部,影响种子的生理活动。如粒径超过植物细胞壁孔径的纳米级塑料微珠可通过内吞作用进入烟草(Nicotiana tabacum)BY-2细胞(cv.Bright Yellow 2)(Liu et al.,2009;Vera et al.,2012)。考虑到实验中选用 5 μm-MPs的粒度,导致本研究结果的原因更可能以前者为主,花生对微塑料的敏感可能是由于花生某些结构比其余4种作物更易于吸附或积累微塑料,表面孔隙的堵塞影响了花生种子吸收水分,进而影响其活性、萌发及芽长。文献报道,0、0.1%、0.5%、1%、2%的PE微塑料(13、58、178 μm)均不同程度抑制了玉米和黄瓜(Cucumis sativus)种子的活力指数及芽长,且与粒径相比,微塑料的质量分数是植物种子发芽的影响更显著(刘晓红等,2022)。本研究中微塑料质量浓度越大,花生发芽及活性受到的抑制越强,更可能是由于高质量浓度下微塑料的团聚行为对种子吸水的机械阻碍更大所致。
2.2 土培条件下 5 μm-MPs对作物生长特性的影响
2.2.1 株高
土培实验结果可更好地反映作物的实际生长情况,株高是反映土培效果的重要形态学指标,如图 2所示。小麦在土培 15 d时各质量分数 5 μm-MPs下的幼苗株高均受到显著抑制(P<0.05),且随5 μm-MPs质量分数增大受到的抑制减弱,处理质量分数为 20 mg·kg−1时受到的抑制最强[仅为(15.17±3.67) cm,较空白组抑制了10.82%];在土培30 d时,各质量分数5 μm-MPs处理下株高均受到抑制,且随质量分数升高抑制作用先增大后减小,在50 mg·kg−1时抑制最强,但在统计学意义上各处理无显著性差异(P>0.05)。廖苑辰等(2019)报道土培中5 μm PS对小麦株高有抑制作用,且在土壤中微塑料质量分数为 50、100 mg·kg−1时对小麦株高均无显著影响,这与本文土培中小麦株高的结果趋势相似。对于玉米,除 50 mg·kg−15 μm-MPs在种植第15天和第30天时对幼苗株高有促进作用外,其他质量分数均为抑制作用,但在统计学意义上各质量分数的抑制作用不显著(P>0.05)。花生在土培 15 d时,幼苗株高在处理质量分数为50 mg·kg−1时受到抑制,其余处理受到促进,但在统计学意义上各处理影响均不显著(P>0.05);在土培30 d时,各质量分数5 μm-MPs下株高均受抑制,但在统计学意义上无显著影响(P>0.05)。
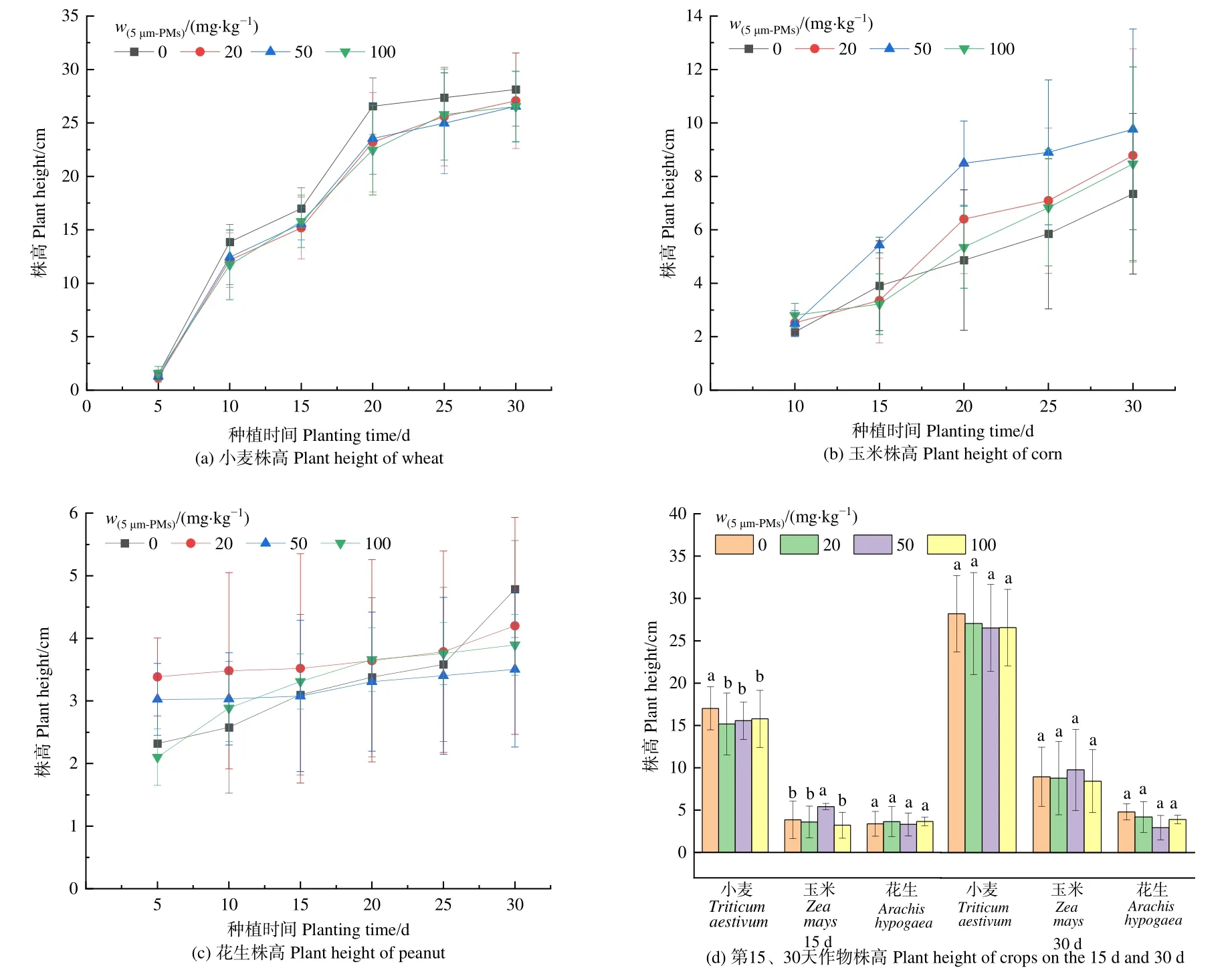
图2 土培不同质量分数微塑料胁迫下小麦、玉米、花生的株高Figure 2 Plant heights of wheat, corn and peanut under the stress of microplastics with different mass fractions in soil culture
就培养时间而言,土培条件下不同生长时期中作物幼苗的株高对5 μm-MPs的敏感程度不同。微塑料在种植期间第15天对幼苗株高影响的显著性频次数据比第30天的大,生长前期的微塑料影响机制可能主要为通过堵塞植物根部通道影响植物营养水分传递,进而影响株高,但细胞损伤可能可逆,随着作物的生长,作物幼苗对微塑料的抗性有所提高,削弱了微塑料的抑制作用。文献报道,相比质量浓度,PE微塑料对玉米株高有更显著的粒径效应(刘晓红等,2022)。本研究中较多质量浓度下5 μm-MPs对作物株高的影响不显著,符合前述文献报道的规律,推测影响机制可能为根部的物理堵塞。
2.2.2 叶片叶绿素
植物叶绿素的含量反映了植物光合能力的强弱,是植物生理水平的重要指征,叶绿素仪能够在种植过程中实时监测植物叶面的SPAD值并以此表示植物叶片叶绿素的相对含量。培养过程中花生叶片较小无法检测其SPAD值,因此只检测了小麦及玉米叶面SPAD值变化。如图3a所示,小麦叶片的SPAD值随培养时间的延长而降低,各处理组中SPAD 值除 21 d 的 20 mg·kg−1和 50 mg·kg−1处理外,其余均低于对照组,在第17天的 50 mg·kg−1处理下显著偏低(P<0.05)。Lian et al.(2020)报道0.1 mg·L−1和 1 mg·L−1的 PS 纳米塑料可显著提高小麦的SPAD值,这与本研究结果有差异,推测纳米级别和微米级别微塑料对植物的影响机制不同(Tan et al.,2018),微塑料对植物生长的影响与微塑料粒径关系密切。如图3b所示,培养过程中玉米叶片SPAD值随种植时间呈现先增后减的趋势,除第29天的100 mg·kg−1、第33 天的 20、100 mg·kg−1处理外,其余均低于对照组。在统计学意义上,仅第33天的20 mg·kg−1处理显著高于对照组(P<0.05)。SPAD 值表示植物叶片叶绿素相对含量,上述SPAD值变化情况反映了作物叶面叶绿素含量变化趋势,本研究结果说明不同作物的叶片叶绿素含量对 5 μm-MPs的敏感程度不同,且随着培养时间延长,作物对微塑料胁迫的反应也有变化。文献报道聚氯乙烯(PVC)微塑料在7 d内对大豆幼苗光合效率影响不大,更长时间则表现出微塑料低质量分数抑制,中、高质量分数恢复的趋势(安菁等,2021),这与本文玉米叶片叶绿素含量结果在时间上的变化趋势相似,可能是由于植物体内叶绿素合成等相关转化过程因植物更易于利用或吸收低浓度微塑料所致(廉宇航等,2022)。叶片的光合作用与叶片氮含量有关,通常叶片氮会分配到叶绿体中参与光合作用(Evans,1989;Warren et al.,2022)。小麦叶片叶绿素含量与叶片氮的质量分数的变化趋势有一定相似性,而玉米叶片氮的质量分数与叶绿素含量变化趋势无一致性,印证了微塑料对不同作物的叶片氮的质量分数及叶绿素含量影响机理可能存在差异。
图3 土培不同质量分数微塑料胁迫下小麦、玉米生理指标变化Figure 3 Changes of physiological indexes of wheat and corn under the stress of microplastics with different mass fractions in soil culture
培养33 d时,如表1所示,相比对照组,5 μm-MPs各处理组小麦叶片的叶绿素 a质量分数均降低,20、100 mg·kg−1处理下叶绿素a的质量分数都显著减少(P<0.05),其中 20 mg·kg−1处理最低(2.97 mg·g−1);叶绿素 b 的质量分数随 5 μm-MPs的质量分数增加先降低后恢复,但在统计学意义上与对照组无显著差异(P>0.05)。玉米叶片叶绿素a、叶绿素b的质量分数相比对照组均显著下降(P<0.05),随5 μm-MPs的质量分数增加均呈先降低后升高趋势,其中20 mg·kg−1处理时叶绿素a及叶绿素b的质量分数最小,分别仅为 2.07 mg·g−1和 4.66 mg·g−1。5 μm-MPs使两种作物的叶绿素a/b比值均降低,小麦在 20 mg·kg−1处理出现最小值(0.60),玉米在 50、100 mg·kg−1时均出现最小值(0.42)。黑藻(Hydrilla verticillata)在3 μm聚苯乙烯不同浓度胁迫下叶绿素总含量、叶绿素a和叶绿素a/b比值均显著降低(张晨等,2021),与本文结果一致,与总叶绿素含量受影响的机理类似,这也可能是因为微塑料进入到植物体内,抑制了叶绿素a、b的合成代谢途径。文献报道玉米的幼苗的根体积和根表面积与PE微塑料的质量分数呈显著负相关(刘晓红等,2022),本研究中高于 20 mg·kg−15 μm-MPs处理对小麦及玉米叶片叶绿素的胁迫效应反而下降也可能与此有关,即较高质量分数微塑料的团聚作用削弱了微塑料与植物根系的接触。
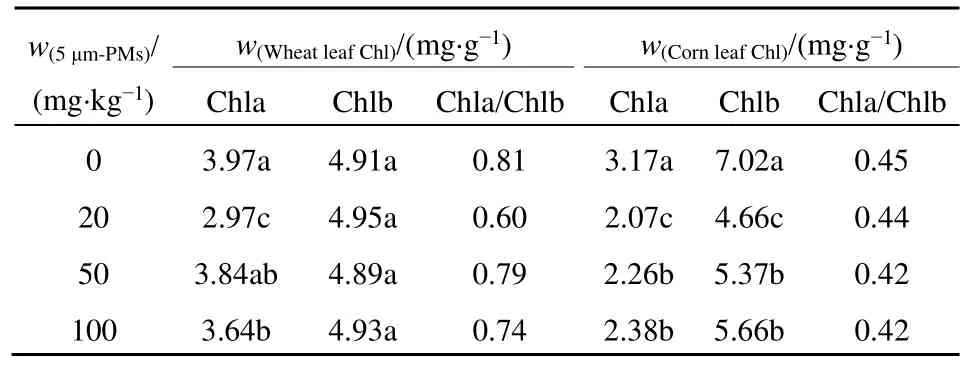
表1 土培不同质量分数微塑料胁迫下小麦、玉米叶绿素a、叶绿素b的质量分数Table 1 Contents of chlorophyll a and chlorophyll b in wheat and corn under the stress of microplastics with different mass fractions in soil culture
2.2.3 SOD活性
SOD是植物体中抗氧化作用的主要酶类,可清除生物体内自由基,其活性水平体现了植物受外界逆境影响的程度(徐荣乐等,2010)。当外界逆境超过承受阈值后,植物体内的活性氧含量将超过正常的歧化能力,而对组织和细胞多种功能膜及酶系统造成破坏,抑制植物叶片内的SOD活性(谢勇等,2021),SOD的活性下降幅度越大说明植物SOD体系受到的抑制越强。由图3e可知,各处理组中小麦和玉米叶片SOD活性均显著低于对照组(P<0.05),但小麦的SOD活性随5 μm-MPs质量分数提升而先增加后减少,在20 mg·kg−1处理达到最小,与对照组相比下降了 35.5%;而玉米的 SOD活性随着 5 μm-MPs质量分数提升呈持续上升趋势,20 mg·kg−1处理显著抑制SOD活性且达到最小值(P<0.05),与对照组相比下降了50.6%。
5 μm-MPs暴露引起了小麦、玉米叶片SOD活性的显著下降,5 μm-MPs的胁迫对两种作物的抗氧化体系产生了不同程度的负面影响,20 mg·kg−1处理对两者造成的负面影响更大。已有研究发现随着PVC微塑料(<15 μm)质量分数增大,大豆的SOD浓度会显著提高(安菁等,2021),这与本文中小麦、玉米SOD活性的变化趋势不同,可能与不同作物抗氧化系统抗刺激和抗逆能力的差异有关。有文献报道通过基因转录组测序发现,塑料可以直接作用于根部诱导抗氧化活性相关基因的下调(孙晓东,2019),该机制可能是微塑料抑制植物 SOD活性的原因。
2.3 土培中碳、氮的质量分数变化
叶片中氮的质量分数是反映植物生长状态的重要指标。由于培养过程中花生叶片较小,无法检测氮的质量分数,仅检测小麦和玉米叶片氮的质量分数变化(图3c、d)。小麦幼苗在生长过程中,叶片氮的质量分数除第21天的 20 mg·kg−1处理高于对照组外,其余均低于对照组;第29天在 100 mg·kg−1处理受到显著抑制(P<0.05),相比对照组抑制率为8.43%,其余时间及处理下均无显著影响(P<0.05)。玉米叶片氮的质量分数在各时间、各 5 μm-MPs质量分数处理组均受到抑制,第29天在各5 μm-MPs质量分数处理组下均受到显著抑制(P<0.05),抑制率在16%—23%之间,其余均无显著影响(P<0.05)。有研究表明葱(Allium fistulosum)暴露在聚酯纤维微塑料中其叶片中氮的质量分数降低(de Souza Machado et al., 2019),5 μm-MPs在小麦及玉米幼苗的生长中也可能存在类似机制。
微塑料会影响土壤中的可溶性营养物质,而土壤的可溶性营养物质含量与植物生长有着密切的联系。如表2所示,种植小麦、玉米、花生的土壤在幼苗培养周期结束后,其 DOC、DTN、DNN、DAN、DON质量分数相较培养前增加,而随着土壤中5 μm-MPs质量分数的增加,土壤中DNN质量分数不断下降,其余4种指标均上升。100 mg·kg−15 μm-MPs胁迫下,玉米土壤DON质量分数增长最多,达到35.5 mg·kg−1。这与高质量分数聚丙烯微塑料可显著增加土壤DON与DOC的报道相似(Liu et al.,2017)。
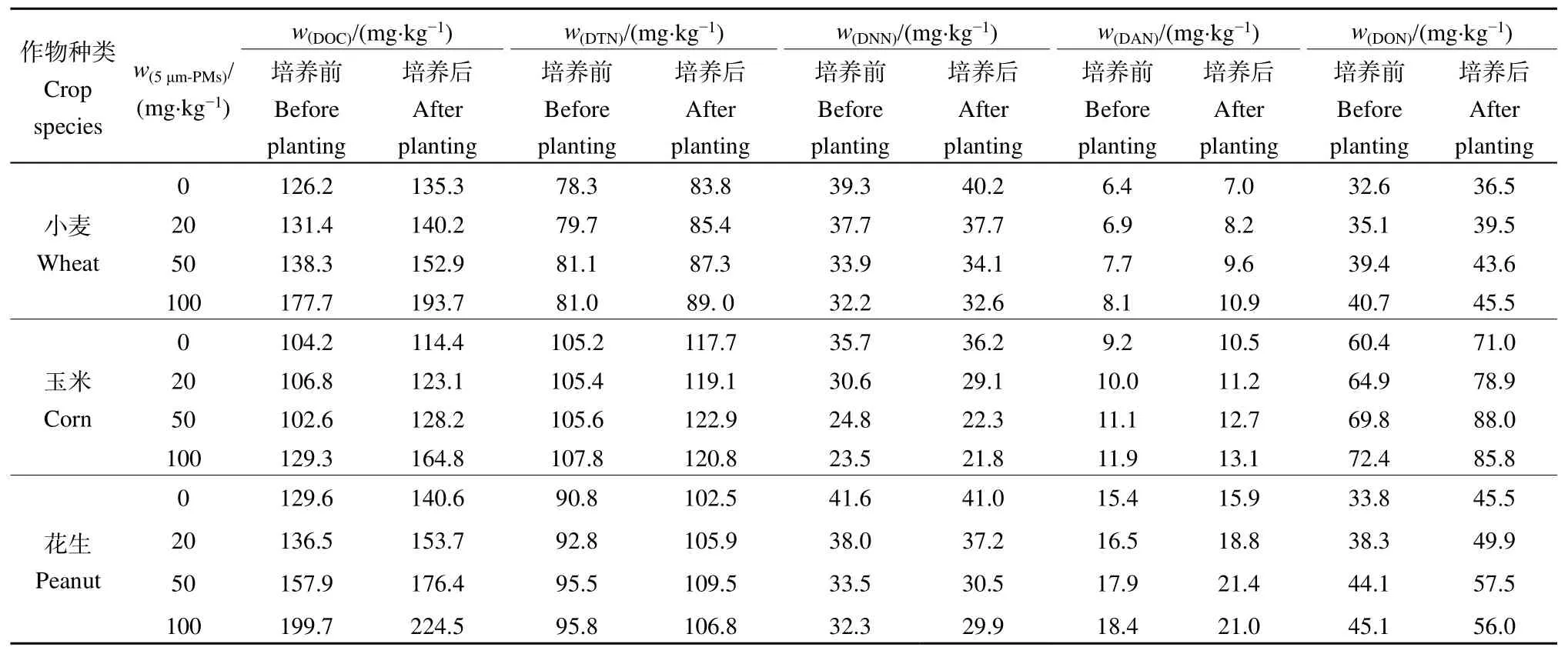
表2 培养前后作物土壤中可溶性营养物质的质量分数Table 2 Mass fractions of some elements in crop soil before and after culture
土壤、微塑料、植物三者是相互作用、相互影响的(冯雪莹等,2021),一方面高质量分数的微塑料在土壤中可能刺激作物中某些酶的活性(陈熹等,2020;刘玲等,2021),进而导致土壤中的碳元素和氮元素等主要营养元素或其他微量营养元素含量积累变化(Fei et al.,2020),而土壤环境营养元素的变化可进一步导致植物的株高、叶面氮质量分数等生长特性指标的改变,如廉宇航等(2022)报道的0.1%的PE微塑料处理下大豆根部Fe含量升高,从而引起大豆叶绿素含量升高;另一方面微塑料通过影响植物生长过程改变了土壤物质的含量,如Zang et al.(2020)在研究PVC微塑料引起的植物-土壤系统中14C分配的变化时发现,高质量分数污染会引起微生物活性和根系分泌物周转率增加,从而使土壤中 DOC质量分数增加。将土壤中氮磷的质量分数的变化趋势结合叶面氮含量变化趋势看,仅玉米叶面氮的质量分数与土壤硝态氮的质量分数在添加微塑料后呈下降趋势外,其余指标变化趋势并不具有一致性。玉米土壤氮的质量分数的实验结果与吾兰(2021)的研究结果相似,该研究认为植物吸收氮肥的主要形态是NO3−,微塑料增强了土壤中促进NO3−转化相关的酶活性,因此微塑料积累可能会通过降低土壤有效养分而间接影响玉米生长。而小麦的叶面氮的质量分数与土壤DOC、DTN、DAN、DON的质量分数变化趋势不一致,有研究认为高等植物发达的根系增加了与微塑料颗粒相互作用的可能性(Sander et al.,2019),从而减少植物对营养物质的吸收。
目前研究认为土培中微塑料影响作物生长的机制可能有6种(Gabriela et al.,2017;Li et al.,2020;纪红等,2021):(1)尖锐、锋利的微塑料可通过机械损伤降低植物细胞根长和根细胞活力;(2)堵塞根部通道,控制植物营养及水分传递;(3)微塑料可直接进入细胞连接或细胞壁孔隙,造成植物细胞的破损,影响植物正常的营养运输;(4)改变土壤结构理化性质,影响植物养分吸收及传递;(5)影响土壤-根系体系中的微生物;(6)污染物协同作用或转运有害物质(刘沙沙等,2022;谢洁芬等,2022)。从培养时间看,土培中5 μm-MPs在种植第30天对作物除株高外的其余指标的影响大于第15天,结合上述机制假说,5 μm-MPs对土培作物各监测生理指标的影响应是多种机制综合作用产生的。本研究中微塑料可能随着培养时间延长伴随土壤生物运动机械损伤而降低植物根细胞活性,同时也可能因比表面积较大,吸附于植物根细胞表面,发生物理堵塞根部通道,影响植物根对水及营养物质的吸收,进而抑制植物光合作用及 SOD活性,而对光合作用的影响表现为抑制作物叶绿素的含量及叶面氮含量。而由于作物种类不同,其结构、代谢途径也有差异,因此影响的主导机制和作用方式也存在一定差异,微塑料对不同作物及同种作物的不同指标影响程度也不尽相同。
3 结论
5 μm-MPs质量浓度在 0—100 mg·L−1范围内,经7 d种子发芽试验发现:(1)5 μm-MPs对小麦、玉米、向日葵、谷子的种子发芽能力和种子活力无显著影响,对花生显著抑制,质量浓度越大抑制越显著,100 mg·L−1处理与对照组相比发芽抑制率达到125.56%,抑制效果明显。(2)与对照组相比,5 μm-MPs对5种作物种子的平均发芽时间均无显著影响。
5 μm-MPs质量分数在 0—100 mg·kg−1范围内,经33 d土培试验发现,(1)株高上,5 μm-MPs对玉米、小麦、花生3种作物大体表现为抑制,种植第15天未表现相同显著影响趋势,第30天时对3种作物均无显著影响。(2)不同处理均可显著诱导小麦、玉米叶片SOD活性下降,20 mg·kg−1处理下两者叶片SOD相比对照组活性下降最大。(3)高质量分数5 μm-MPs对小麦叶绿素表现为显著抑制,中低质量分数对玉米叶绿素表现为显著抑制;但均使两者叶绿素a/b比值降低。(4)相比对照组,含有5 μm-MPs的土壤氮含量在种植后显著增加,但5 μm-MPs处理组中小麦、玉米的叶面氮的质量分数在种植期间均偏低。
