低量水铁矿促进稻田梭菌Clostridium sp.BY-1产氢效率
2022-02-19张亚平陈慧敏吴志宇汤佳谢章彰刘芳华
张亚平,陈慧敏, ,吴志宇, ,汤佳,谢章彰*,刘芳华*
1.广东工业大学环境科学与工程学院,广东 广州 510006;2.广东省科学院生态环境与土壤研究所/华南土壤污染控制与修复国家地方联合工程研究中心/广东省农业环境综合治理重点实验室,广东 广州 510650;3.烟台大学生命科学学院,山东 烟台 264003
氢气作为一种重要的还原力和气态分子,在水稻土生态系统中扮演了重要的角色。首先,氢气的扩散能力强,容易渗透进入微生物细胞(Morita,1999),常作为电子供体被水稻土中的产乙酸菌、产甲烷菌、硫酸盐还原菌等微生物利用,如同型产乙酸菌可以利用氢气固定二氧化碳产生乙酸盐,后者可作为碳源被周围微生物群落利用(Muller,2003);硫酸盐还原菌能够利用氢气将土壤中的硫酸盐还原成硫化氢,生成的硫化氢可固定土壤中的重金属铅和镉,进而降低重金属对植物的胁迫(Yang et al.,2021)。其次,氢气作为一种重要的气体信号分子,能提高水稻的抗氧化酶及同工酶活性,进而提高水稻对抗非生物胁迫的能力,如盐度胁迫、铝等(Xu et al.,2013;Xu et al.,2017)。因此产氢微生物对土壤微生物的代谢活动及植物的生长起着重要的作用。
铁氧化物是土壤中最常见的矿物种类,在珠江三角洲地区土壤中的含量高达 2%(Tao et al.,2012),根据其结晶程度可简单分为无定形和晶型两种。有研究发现水稻土淹水后,铁氧化物的形态主要为弱晶型或者无定形(陈娅婷等,2016);Zhang et al.(2003)也发现,淹水后弱晶型铁氧化物浓度增加,尤其在红壤水稻土中的增幅最高能达到213.6%。水铁矿作为水稻土中常见的弱晶型铁氧化物,其生物相容性较好,微生物对水铁矿的还原率比其他三价铁氧化物高(Peak et al.,2012),因而水铁矿在周期性干湿交替的稻田土壤中表现出活跃的价态变化,从而影响其他营养元素的生物地球化学循环。
已有研究表明,水铁矿可以促进产氢菌产氢。如Zhang et al.(2020a,2020b)在混合菌发酵产氢体系中加入100 mg·L−1的水铁矿,发现水铁矿不仅可以重塑细菌群落,还能够有效调节产氢菌氢化酶或铁氧还蛋白所需亚铁的释放,改变产氢菌代谢途径;与此同时,水铁矿能在还原过程中消耗质子,缓冲发酵体系中由有机酸累积导致的pH值下降,从而更好地促进微生物的生长。Zhang et al.(2019a)研究发现加入浓度范围为50—200 mg·L−1的水铁矿后,水铁矿不仅能促进巴氏梭菌Clostridium pasteurianum产氢,且促进产氢的效果优于磁铁矿,原因在于水铁矿的加入提高了葡萄糖的转化效率和产氢酶基因的表达。pH是影响酶活性和产氢的关键因素之一(Fang et al.,2002),而水铁矿能有效缓冲有机酸积累引起的系统酸化,提高产氢酶酶活性,促进微生物的生长。
根据现有研究,水铁矿促进微生物产氢的可能机制有:缓冲体系pH、提高微生物产氢酶酶活性、促进微生物电子传递、促进微生物生长等。但由于水铁矿对产氢体系pH的缓冲作用也能够提高微生物产氢酶酶活性、促进微生物生长,因此并不清楚水铁矿对微生物产氢代谢的提升是水铁矿的直接作用还是缓冲pH所造成的间接作用。而在实际水稻土环境中,当水铁矿对稻田土pH的缓冲作用有限时,其对产氢微生物的影响仍是未知的。因此,本研究以稻田土来源的产氢梭菌Clostridiumsp.BY-1为研究对象,从低浓度水铁矿着手,通过规避高浓度水铁矿对体系pH的缓冲作用,分析水铁矿促进微生物产氢的深层作用机制,从而更深入理解稻田土壤中水铁矿对微生物产氢的影响。
1 材料与方法
1.1 水铁矿的制备与表征
材料制备:水铁矿的制备根据(Lovley et al.,1986)描述方法,称取162.2 g的FeCl3在磁力搅拌作用下溶于1 L的超纯水中,用1 mmol·L−1的NaOH溶液调节pH至7,直至出现红褐色胶体悬浮物。随后将上述溶液在4000 r·min−1下离心10 min后倒掉上清液,并用超纯水清洗5—8次。随后将清洗后的沉淀物用超纯水定容至1 L,并测定该溶液中Fe(III)离子浓度,置于黑暗条件下保存。
表征:将制备好的水铁矿用去离子水洗涤 3—4次后,采用真空冷冻干燥机冷冻干燥24 h,利用透射电镜(TEM)和X-射线衍射仪(XRD)进行材料的表征。采用Hitachi HT7700透射电镜,在100 kV下获得透射电镜图像,对水铁矿的形貌进行表征。XRD图谱在Bruker AXS D8 Advance射线衍射仪上采集,该X射线衍射仪采用Cu靶Kα辐射、LynxEye探测器,在40 kV和40 mA条件下工作,扫描角度的范围为5°—90°,扫描步长0.02°,停留时间为0.1 s。
1.2 菌株来源与培养
菌株来源:水稻土采自中国科学院华南植物园水稻土实验田(113°21′10″E,23°10′38″N),通过五点采样法收集 0—20 cm的新鲜土壤,剔除可见根系和石块并混匀后过筛,放进样品袋中于 4 ℃保存。将采集的土样接种到MSG基础培养中富集培养,随后利用Hungate滚管法从该稻田土中纯化分离出一株产氢梭菌Clostridiumsp.BY-1。
富集培养:称取50 g稻田土加入500 mL MSG基础培养基中混匀,分装至西林瓶中用氮气除氧,于95 ℃热处理15 min,消除产甲烷菌和非孢子形成菌的影响。随后将热处理后的样品置于 37 ℃条件下暗培养,每2天转接1代。分离鉴定:将第9代富集产物逐级稀释后,用Hungate滚管法进行单菌落分离,将分离出的菌株进行16S rRNA扩增。PCR扩增反应体系:2×Taq mix 12.5 μL,通用引物27f(5′-AGAGTTTGATCMTGGCTCAG-3′)和1492r(5′-GGTTACCTTGTTACGACTT-3′)各 1 μL,菌液模板 0.5 μL,ddH2O 10 μL,体系总体积 25 μL。PCR扩增程序:95 ℃预热5 min;循环程序:95 ℃裂解30 s,55 ℃退火30 s,72 ℃延伸30 s,循环30次;终延伸72 ℃运行10 min;扩增后的样品与4 ℃保存(郝钦钦等,2020)。随后对扩增产物进行琼脂凝胶电泳胶实验,检测菌落PCR是否成功,成功后送样测序。将测序结果在NCBI上进行比对。
MSG 基础培养基成分(g·L−1):大豆蛋白胨0.50,胰蛋白胨0.50,葡萄糖10.00,L-半胱氨酸0.50,NaCl 5.00,KH2PO40.544,K2HPO42.10,刃天青 3—5滴。配制完成后用0.5 mol·L−1的NaOH或者HCl调节pH至6.8±0.2。随后在西林瓶(125 mL)中分装30 mL的培养基,用橡胶塞和铝盖密封后,采用抽换气装置进行除氧(抽真空900 s,冲氮气200 s,循环10次),于115 ℃高压蒸汽灭菌30 min。灭菌后,按照基础培养基:混合溶液(100꞉1)的体积比加入经过滤除菌的混合溶液。其中混合溶液按照:矿物盐溶液꞉微量元素꞉维他命溶液=48꞉1꞉1的体积比进行混合(刘进超等,2020)。矿物盐溶液主要成分(g·L−1):NH4Cl 6.0,NaCl 6.0,CaCl2·2H2O 0.2,MgCl2·6H2O 2.0。微量元素主要成分(g·L−1):FeCl2·4H2O 2.00,ZnCl20.05,MnCl2·4H2O 0.05,CuCl2·2H2O 0.03,(NH4)6Mn7O24·4H2O 0.05,AlCl30.05,CoCl3·6H2O 0.20,H3BO3饱和溶液 1 mL,浓HCl 1 mL。维他命溶液主要成分(g·L−1):生物素0.002,叶酸0.002,维生素B60.010,核黄素0.005,维生素B10.005,盐酸0.005,维生素B120.005,对氨基苯甲酸0.005,泛酸0.005。
1.3 低量水铁矿对Clostridium sp.BY-1产氢的影响
在实验开始之前,将无菌注射器和已灭菌的装有培养基的西林瓶置于超净台紫外灯照射 30 min后再进行接菌。该反应体系在125 mL的西林瓶进行,培养基的体积为30 mL。随后添加不同量的水铁矿至西林瓶中,实验组中不同西林瓶水铁矿的最终浓度分别为 1、5、15、50 mg·L−1,空白对照组不加水铁矿,每个浓度设置3个对照组。实验组和对照组均接种5%的指数生长期的Clostridiumsp.BY-1,在60 h内每间隔10 h测定体系产氢量、葡萄糖、有机酸、OD600和Fe(II)浓度,并在发酵第10小时时测定产氢酶酶活性。
1.4 产气量的测定及产氢动力学分析
气相色谱分析:取0.2 mL顶空体积,使用配有TCD检测器的气相色谱仪(Agilent 8860)对H2进行测定,TCD温度设置为 150 ℃,进样口温度为80 ℃,柱温箱温度为80 ℃。以N2为载气,流速为 10 mL·min−1。
产氢动力学分析:用冈伯茨(Gompertz)模型进行模拟和分析产氢动力学(Winsor,1932),计算公式为:

式中:
H——累计产氢量(mmol);
P——最大产氢潜能(mmol);
Rm——最大产氢速率(mmol·h−1);
λ——产氢延迟时间(h);
e——自然常数。
1.5 发酵液中有机酸、葡萄糖和二价铁浓度的测定
高效液相色谱法测定有机物浓度:发酵液用0.22 μm聚醚砜膜过滤后,用高效液相色谱(Agilent 1260)检测乙酸、乳酸和丁酸的产量。实验采用C18柱(250 mm×5 μm)作为固定相,流动相为 18 mmol·L−1磷酸二氢钾(磷酸调节 pH 至 2.15),流速1 mL·min−1,柱温 35 ℃,检测波长 210 nm,进样量 10 μL。
葡萄糖测定:采用3, 5-二硝基水杨酸检测发酵液中的葡萄糖,取100 μL的发酵液将其稀释10倍,随后将稀释后的发酵液和DNS溶液按1꞉10的体积比混匀,将混合溶液于沸水浴中加热5 min,黄色的3, 5-二硝基水杨酸在碱性条件下沸水浴后与葡萄糖反应,会被还原成棕红色的3-氨基-5-硝基水杨酸,在波长为 540 nm处用紫外可见光分光光度计(Techcomp UV1102)检测其吸光度。
邻菲啰啉显色法检测二价铁离子:按照 HJ/T 345—2007水质铁的测定-邻菲啰啉分光光度法(试行)(国家环境保护总局,2007)测定发酵液中的二价铁。
1.6 生物量和产氢酶活性测定
采用BCA蛋白试剂盒(Solarbio)检测细菌的生物量。取0.5 mL细菌悬液于8000 r·min−1条件下离心5 min,用PBS溶液洗涤3次后,加入0.5 mL 0.2 mol·L−1的 NaOH溶液涡旋振荡。在 4 ℃条件下冷藏保存 1 h,每 15分钟涡旋振荡 1次。随后在−80 ℃冷冻保存10 min,90 ℃恒温水浴10 min,重复3次。随后将处理好的样品按照试剂盒方法测定蛋白含量。
细菌氢化酶活性采用亚甲基蓝还原法测定(Zhang et al.,2019a)。在 5 mL血清瓶中加入1.5 mL的 0.2 mmol·L−1亚甲基蓝溶液,除氧后加入过量的氢气。随后加入0.5 mL的细菌悬液,37 ℃暗保存7 min后,于570 nm波长下测定吸光度。
2 结果与讨论
2.1 材料的表征
采用XRD和TEM分别对合成的水铁矿进行物相分析和形貌表征。TEM观测结果显示合成水铁矿为絮状的聚合体(图1a)。如图1b所示,XRD表征图谱显示水铁矿的衍射峰较少且宽,表明水铁矿结晶度较低。在35°与62°附近观察到2线水铁矿(2LFh)的两个特征峰,分别对应(110)和(115)晶面(Michelle et al.,2014)。与 Cornell et al.(2004)所报道的标准XRD图谱一致,证明合成材料为2LFh。根据TEM和XRD的分析结果表明,本实验合成的水铁矿为纳米级大小的弱结晶型铁氧化物。

图1 合成水铁矿的表征Figure 1 Characterization of synthetic ferrihydrite
2.2 水铁矿对梭菌产氢及发酵体系pH变化的影响
本实验以葡萄糖为暗发酵底物,研究低量水铁矿(1、5、15 和 50 mg·L−1)对梭菌Clostridiumsp.BY-1产氢量和发酵体系pH变化的影响。从图2a可知,Clostridiumsp.BY-1发酵产氢时,前10 h为产氢延迟期,随后产氢过程均进入快速增长阶段,30 h后产氢速率显著降低,累计产氢量缓慢增加直至50 h达到最大累积量。与空白对照相比,所有实验组的产氢量和产氢率都有显著的增强,在水铁矿添加量为1、5、15和50 mg·L−1的培养体系中,累计产氢量分别为2.24、2.34、2.68和2.67 mmol,与空白对照组的1.45 mmol累计产氢量相比,分别提升了54.87%、61.64%、85.34%和84.17%。促进产氢的水铁矿最佳投加质量浓度为15 mg·L−1,氢气产率为1.77 mol H2/mol葡萄糖,相较于空白组的H21.12 mol/mol葡萄糖提升了 58%。水铁矿投加量为 1 mg·L−1时,氢气产率为 H21.48 mol/mol葡萄糖,相比空白组提高了32.17%。因此,在添加量为0—15 mg·L−1质量浓度范围内,水铁矿浓度与累计产气量正相关。但水铁矿超过50 mg·L−1质量浓度时,其累计产氢量和 15 mg·L−1累计产氢量结果相近,原因可能是水铁矿的Fe(III)还原是消耗电子的过程,当体系中的水铁矿过多时可能会降低产氢量。Zhang et al.(2019b)在探究水铁矿对双酶梭菌产氢的影响时,发现加入50—200 mg·L−1的水铁矿对氢有一定的抑制作用,原因是铁还原过程与产氢过程存在电子竞争,导致产氢量减少。
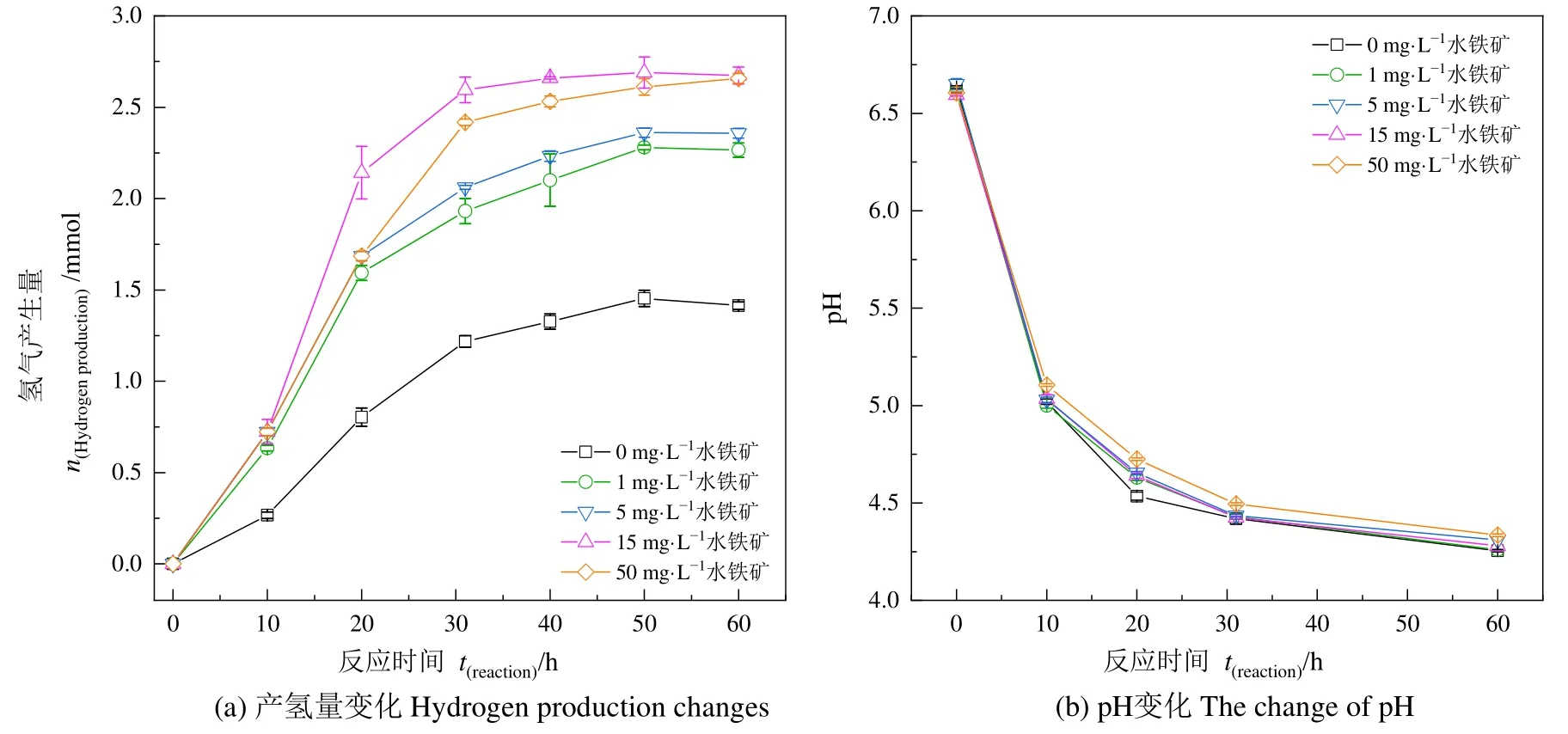
图2 水铁矿对Clostridium sp.BY-1累计产氢量及暗发酵体系pH变化的影响Figure 2 Effect of ferrihydrite on the cumulative hydrogen production of Clostridium sp.BY-1 and pH change in dark fermentation system
采用 Gompertz模型对产氢实验数据进行了动力学分析(表1),在该模型下数据的相关系数均高于0.99,说明该模型能与实验数据进行较好拟合。拟合结果显示添加水铁矿后,最大产氢能力(P)和最大产氢速率(Rm)都有显著的提升,当水铁矿的添加量为15 mg·L−1时效果最好,P和Rm的值比空白对照组分别提高了0.86倍和2.05倍。因此,较低浓度的水铁矿具有较好的促进产氢效果。
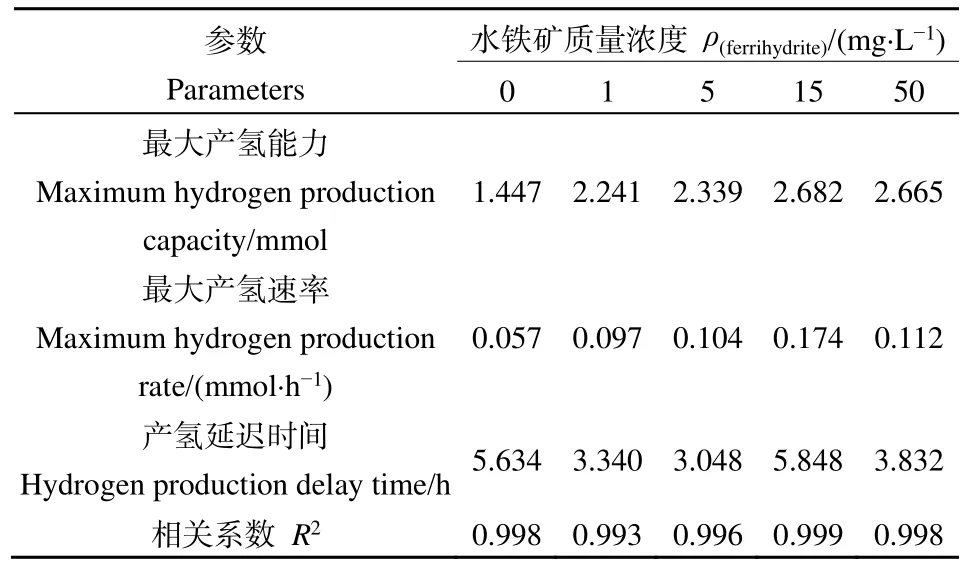
表1 不同质量浓度水铁矿下Clostridium sp. BY-1产氢动力学参数Table 1 Kinetic parameters of hydrogen production by Clostridium sp. BY-1 at different concentrations of ferrihydrite
实验过程中对水铁矿添加体系中pH变化进行了监测。结果如图2b所示,水铁矿的加入对体系初始pH(6.6)值的影响较小。随着发酵时间的延长,所有体系中pH均不断降低,最终达到4左右,梭菌产氢代谢过程中除生成的有机酸类物质如乙酸、丁酸和乳酸外,梭菌产氢过程生成的二氧化碳溶解后也会导致pH下降。空白组和水铁矿添加实验组间发酵体系pH的下降速率和最终pH值无明显的差异。虽然水铁矿通过消耗体系中的质子可以缓冲体系pH,使得体系pH上升,从而更好地促进微生物的生长(Zhang et al.,2019a),但由于本实验体系中水铁矿添加量较少,所以其对体系的缓冲效果不显著,因此,可忽略水铁矿通过缓冲pH对产氢的贡献。而该结果也进一步证明,即使在pH缓冲效果不好的情况下,水铁矿仍然具有良好的促进产氢效果。
2.3 铁还原过程对梭菌产氢的影响
梭菌属微生物是一类典型的发酵型铁还原细菌(张月超等,2018),作为弱结晶型的铁氧化物,水铁矿的 Fe(III)很容易被梭菌还原成 Fe(II),而铁还原过程与产氢过程具有电子竞争关系,对产氢过程可能会有抑制作用,如Zhang et al.(2019b)在探究水铁矿对双酶梭菌产氢的影响时,发现加入水铁矿后,用于产氢的电子被Fe(III)还原分流,从而导致产氢量有些许降低。因此,我们测定了体系中Fe(II)的生成情况,判断在该体系中 Fe(III)还原是否抑制产氢。图3显示实验前20 h体系中水铁矿逐步被还原成Fe(II),随后Fe(II)的浓度在体系中达到稳定。在 1、5、15、50 mg·L−1体系中,Fe(II)的产生量分别占水铁矿加入量的 70.43%、77.38%、76.04%和83.86%,其中可能有部分铁离子被微生物自身利用。以铁还原量最大的50 mg·L−1体系为例,在该体系中产氢量为2.665 mmol,产生2.665 mmol的氢气需要消耗5.34 mmol电子,而该体系Fe(II)的产生量为 23.40 μmol,即将水铁矿还原为 Fe(II)仅需要消耗23.40 μmol电子。因此在该条件下,铁还原电子消耗量仅占产氢电子消耗的0.43%,说明发酵型铁还原菌Clostridiumsp.BY-1仅有少量电子传递至胞外用于三价铁还原过程,对产氢电子的分流较小。虽然铁还原过程与产氢有电子竞争,但其对产氢的影响较低。另外,[Fe-Fe]氢化酶和Fdred是产氢代谢中的重要物质,其活性中心为铁离子(Gadhe et al.,2015),因此梭菌铁还原形成的Fe(II)可以被梭菌直接利用合成氢化酶和Fdred。

图3 体系中Fe(II)的量随反应时间变化情况Figure 3 The amount of substance of Fe(II) in the system vary with the reaction time
2.4 水铁矿对梭菌葡萄糖利用及生长的影响
为了深入探究水铁矿对暗发酵产氢的影响,我们对底物葡萄糖的消耗情况和微生物的生长状况进行分析,具体数据如图4所示。水铁矿的添加不仅促进了葡萄糖的消耗,还能显著提高微生物的生物量。如图4a所示,实验组的葡萄糖消耗量在30 h后减缓,并在40 h后达到平台期,对照组葡萄糖在前20 h内迅速降低随后缓慢减少。其中,空白对照组的葡萄糖的消耗量在60 h后为77.66%,加入水铁矿后实验组葡萄糖利用率均增加至91.40%,因此水铁矿能有效提高底物的转化效率。葡萄糖的利用率提高,说明有更多的ATP产生用于微生物的生命活动,其次葡萄糖经过糖酵解途径生成丙酮酸的同时会生成还原性NADH,而NADH的产生利于氢气的产生(Wang et al.,2021),因此葡萄糖利用率的提高有利于梭菌的产氢。随后,对水铁矿添加体系中细菌的OD600值进行了测定,结果如图4b所示。培养20 h后各体系中OD600值均达到最大,与空白对照组相比,添加水铁矿后的生物量有显著提高,加入1 mg·L−1水铁矿后,其OD600值从空白对照组的1.06增加至1.80,是空白组的1.69倍,说明水铁矿能有效促进微生物的生长,并且随着浓度的增加,微生物的生物量也不断增加,更高的生物量说明有更多的梭菌参与产氢过程,导致梭菌的产氢量增大。而其生物量增加的可能原因是水铁矿提供了微生物生长必需的Fe。以上结果表明,水铁矿的加入不仅能提高葡萄糖的转化效率,也能促进微生物的生长。

图4 水铁矿对葡萄糖消耗和生物生长OD600的影响Figure 4 Changes in glucose consumption and biological growth OD600 in the system with the increase of reaction time
2.5 水铁矿对梭菌产氢酶酶活性的影响
氢化酶是生物制氢中最有效的酶(Latifi et al.,2019),它的氢转化率比固氮酶高1000倍。已有文献报道中,梭菌中主要包含[Fe-Fe]氢酶和[Ni-Fe]氢酶这两类氢化酶,而铁均是构成氢化酶的关键元素(Calusinska et al.,2010)。氢化酶活性的强弱会直接影响产氢效率,因此对氢化酶的比酶活性(每毫克生物质的酶活性)进行了测定,衡量水铁矿对梭菌产氢酶酶活性的影响。如图5所示,水铁矿能提高梭菌的比酶活性,且随着水铁矿浓度(0—15 mg·L−1)增加,比酶活性不断增大。最佳比酶活性出现在水铁矿添加量为 15 mg·L−1体系中,其比酶活性相较于空白对照组提高了0.80倍。梭菌的3种产氢代谢途径中,氢化酶都是至关重要的参与者,加入水铁矿后酶活性提高,则梭菌产氢代谢过程被增强,因而会有更多的氢气产生。Zhang et al.(2019a)研究表明,水铁矿促进了巴氏梭菌7种氢化酶合成相关基因的表达上调。因此可推测水铁矿可能也促进了Clostridiumsp.BY-1相关氢酶基因的表达,从而提高氢酶的酶活性;或者铁元素可能通过提高类似于铁氧还蛋白等酶的活性或表达量间接提高产氢酶效率。综上,水铁矿能促进氢化酶的酶活性,进而促进梭菌的产氢。但50 mg·L−1体系的比酶活性相对于空白组仅提高了0.54倍,原因可能是高浓度水铁矿具有一定的细胞毒性,对细胞产生不利影响进而间接抑制了产氢酶的活性(Zhu et al.,2014)。

图5 不同浓度水铁矿体系中氢化酶活性Figure 5 Hydrogenase activity in ferrihydrite systems with different concentrations
2.6 水铁矿对产氢代谢途径的影响
对发酵液进行液相色谱分析后,菌株的主要代谢方式为产乙酸(2)、产丁酸(3)和产乳酸(4)代谢。添加不同浓度水铁矿后,各主要代谢产物的产生量如图6所示。与空白对照组相比,水铁矿的加入能增强产丁酸代谢和产乙酸代谢,抑制产乳酸代谢过程。其中产丁酸量会随着水铁矿浓度增加而增加,水铁矿添加量为 50 mg·L−1时丁酸产生量最大,从空白对照组的0.40 mmol提高至0.63 mmol,提高了57.5%;添加水铁矿能够促进乙酸的产生,在15 mg·L−1水铁矿体系中,乙酸从空白对照组的 0.175 mmol增加至 0.3 mmol左右,相对于空白组提升71.42%;乳酸产量与水铁矿的加入呈现负相关,随着水铁矿质量浓度增加乳酸产量不断减少,其中50 mg·L−1水铁矿体系中,乳酸累积量减少至 0.262 mmol,仅为空白对照的60.93%。
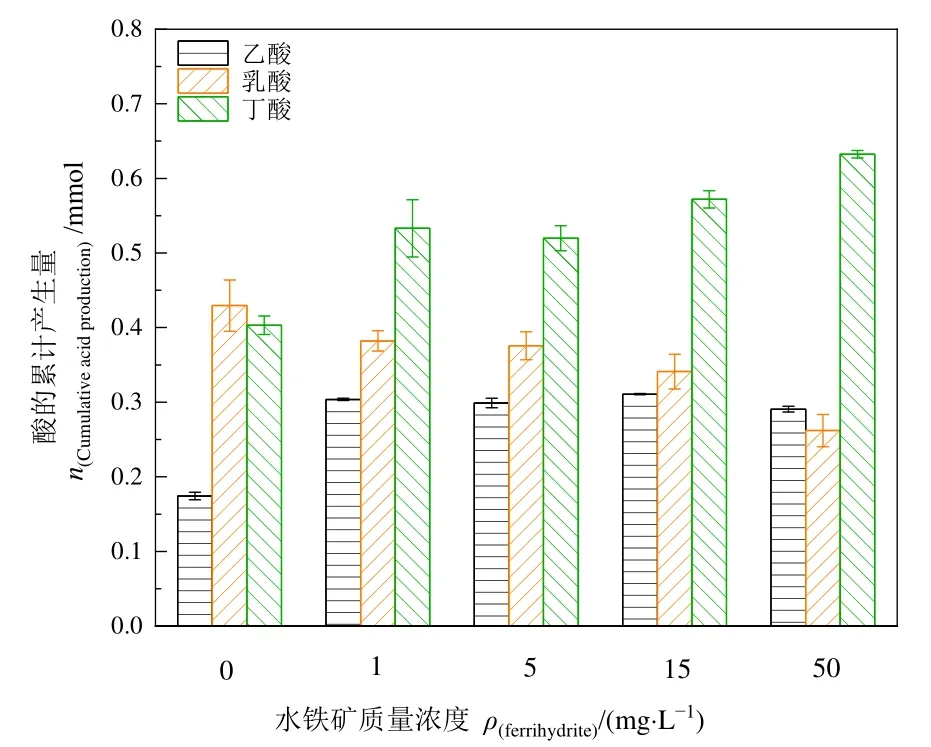
图6 添加不同浓度的水铁矿对Clostridium sp. BY-1产酸代谢的影响Figure 6 Effects of different concentrations of ferrihydrite on acid-producing metabolism of Clostridium sp. BY-1

以葡萄糖为底物的暗发酵产氢代谢中,葡萄糖氧化成丙酮酸和丙酮酸氧化成乙酰辅酶A,这两个过程为氢气的产生提供电子(Antonopoulou et al.,2011)。梭状芽孢杆菌有两种可能的产氢途径:(1)在氢酶的作用下铁氧还蛋白(Fdred)被氧化并利用质子作为末端电子受体产生氢气(Calusinska et al.,2010);(2)糖酵解过程中的NADH再氧化,即胞质氢化酶与NADH及铁氧还蛋白氧化还原酶耦合,利用NADH作为电子供体将质子还原为氢(Peters et al.,2016)。因此,产生NADH和Fdred的途径有利于氢气的产生,而消耗NADH和Fdred途径则会限制氢气的产生(Wang et al.,2021)。产乳酸代谢需要消耗NADH,产乙酸代谢不需要消耗NADH且伴随着ATP的产生,因此抑制乳酸产生和促进乙酸产生均有利于氢气的生成。但随着发酵过程中氢气的累计,氢气分压的增加可以显著刺激丁酸的产生,来维持微生物的氧化还原平衡(Wang et al.,2021)。虽然产丁酸过程会消耗 NADH,但其产生过程会伴随ATP的产生,并且有研究发现丁酸产氢途径与乙醇产氢途径竞争,对高效制氢至关重要(Yu et al.,2013)。因此,水铁矿能调节梭菌的代谢方式,增加乙酸和丁酸产量,抑制乳酸产量,其原因可能是 NAD(P)H是生物体内各种氧化还原反应重要参与者,当产氢代谢增加消耗大量的NADH后会改变梭菌体内的代谢平衡状态,从而导致各有机酸代谢产量的变化(Zigova et al.,2000)。
2.7 环境意义分析
水稻土淹水形成的厌氧环境及其中丰富的有机质为梭菌提供了适宜的生存环境,而梭菌产生的氢气对水稻土中微生物的活性和水稻的生长都有重要的影响。首先,氢气作为电子供体,可提高微生物的活性,降低铅、镉等重金属的活性,减少重金属在水稻中的积累(Fu et al.,2019)。其次,当水稻受到如高盐、重金属污染等外源胁迫时,氢气作为信号分子能调控水稻相关基因的表达来降低不利环境对植物的伤害(Xu et al.,2013;Xu et al.,2017)。此外,Cheng et al.(2021)研究还发现氢气的添加可以提高水稻的产量与籽粒的质量。
铁氧化物作为水稻土中常见的矿物,已有研究发现其会与产氢梭菌发生相互作用,影响微生物的代谢(Ren et al.,2021)。在本研究中,我们发现在无pH缓冲作用的情况下,低量水铁矿也可以显著促进梭菌的产氢。根据实验数据和已有研究,可推测在实际环境下水稻田中的水铁矿可以提高微生物的产氢量,进而提高稻田微生物的活性,促进稻田元素循环,降低重金属活力,提升水稻的生长速度。研究低量水铁矿对梭菌产氢的影响,不仅对水铁矿促进产氢的机制有了深入了解,也为其在自然环境中的生态意义提供了一定的理论支持。但目前的研究仅在实验室水平进行,后期仍需要结合实际水稻土开展相关的研究,从而为水铁矿促进梭菌产氢的实际应用提供更有用的数据支撑。
3 结论
(1)添加低量水铁矿后,虽然暗发酵体系的pH无明显的变化,但氢气的产量和产率能得到较大的提升。
(2)低量水铁矿促进梭菌产氢的可能机制有:提高梭菌葡萄糖的代谢速度,促进生长;提高梭菌产氢酶的活性,加速氢气的产生;增强梭菌产乙酸和产丁酸代谢,抑制产乳酸代谢,调节梭菌的代谢向利于产氢的方向改变。
