基于网络药理学分析瑞香素抗多种肿瘤的作用机制及体外实验验证
2022-02-19张小东覃亚亚
冯 松,张小东,覃亚亚,彭 彬*
1川北医学院;2川北医学院附属医院,南充 637000
瑞香素提取于瑞香属植物,为我国首创的天然药物单体[1],因其具有抗凝作用,目前临床主要用于心血管疾病治疗。另外,大量研究表明瑞香素对多种肿瘤细胞有抑制作用,其机制包括通过MAPK1/2-JNK1/2-Akt通路抑制乳腺癌、作用于Bcl-2/Bax靶点进而抑制肝癌、通过Akt/NF-κB通路抑制肺腺癌[2]、通过AMPK/Akt/mTOR通路抑制卵巢癌[3],瑞香素抗肿瘤作用的靶点及通路有一定共通性。肿瘤是严重危害人类健康的重大疾病,其发病率逐年上升。其中肝癌是致死性最高的恶性肿瘤[4];三阴性乳腺癌是女性乳腺癌中恶性程度较高,且治疗困难的一种[5];恶性胶质瘤是致残、致死率均高的神经系统恶性肿瘤[6]。既往研究表明瑞香素有明确的抗多种肿瘤的作用,但其抗肿瘤作用是否存在共同的靶点或通路尚未见报道。因此,本研究拟通过网络药理学预测瑞香素治疗恶性胶质瘤、肝癌、三阴性乳腺癌的共同靶点或通路,并对其进行体外实验验证,为瑞香素在抗肿瘤中的临床应用提供实验依据。
1 材料与方法
1.1 网络药理学预测瑞香素抗胶质瘤、肝癌、乳腺癌的共同靶点及通路
通过PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)查询瑞香素(daphnetin)的二维结构,使用Swiss Target Prediction数据库(http://www.swisstargetprediction.ch/)预测瑞香素的潜在作用靶点,剔除其中可能性为“0”的靶点。
通过GeneCards(https://www.genecards.org/)数据库中搜索“Malignant Glioma”、“Adult Hepatocellular Carcinoma”、“Triple Negative Breast Neoplasms”,分别检索出恶性胶质瘤、肝癌和三阴性乳腺癌的靶点,去除relevance score<10的靶点。上述靶点取交集,得到三种肿瘤共同靶点。
将三种肿瘤交集靶点和瑞香素预测靶点分别输入到Cytoscape(version 3.7.1)中,用该软件构建瑞香素-三种肿瘤蛋白质-蛋白质相互作用(protein-protein interaction,PPI)图。使用“Cyto NCA”插件,根据“degree、betweenness、closeness”数据筛选出核心靶点。
将筛选出的核心靶点导入Metascape数据库(https://metascape.org),对瑞香素抗肿瘤靶点进行GO及KEGG富集分析。以P< 0.01作为筛选标准。
分子对接实验,将瑞香素三维结构导入ChemBio3D Ultra 14.0进行能量最小化,AutodockTools 1.5.6进行加氢、计算电荷、分配电荷、设置可旋转键。从PDB(http://www.rcsb.org/)数据库下载关键靶点蛋白,使用Pymol 2.3.0去除蛋白结晶水、原始配体等,将蛋白结构导入AutodockTools 1.5.6进行加氢、计算电荷、分配电荷、指定原子类型。采用AutoDock Vina 1.1.2进行对接。结果利用PyMOL 2.3.0和LigplotV 2.1进行相互作用模式分析。
根据人类蛋白图谱数据库(www.proteinatlas.org),筛选出RRM2表达较高的细胞系。
1.2 体外实验验证
1.2.1 细胞、试剂与仪器
恶性胶质瘤细胞株(U-251 MG)、肝癌细胞株(HepG-2)、三阴性乳腺癌细胞株(MDA-MB231)由川北医学院基础医学院创新平台提供。瑞香素(北京索莱宝科技公司);DMEM培养基(GIBCO公司);胎牛血清(杭州四季青公司);CCK-8试剂盒、P53、RRM2抗体(武汉博士德生物工程有限公司);羊抗兔IgG抗体(北京华兴博创生物技术中心);细胞培养箱(美国Thermo公司);Bio-Radimark全自动酶标仪、Bio-Rad chemiDoc XRS+化学发光凝胶成像系统(美国Bio-Rad)。
1.2.2 细胞培养
上述肿瘤细胞使用含10%胎牛血清、1%青霉素链霉素的培养基,在37 ℃,5% CO2培养箱中培养,于倒置显微镜观察细胞生长情况,取对数生长期细胞做后续实验。
1.2.3 CCK8法检测细胞抑制率
分别将U-251 MG、HepG-2和MDA-MB231细胞以每孔5×103细胞(100 μL悬液)接种于96孔板中,各接种15孔。于37 ℃、5% CO2下培养24 h后,每种细胞分别加入含瑞香素浓度为0(对照组)、10、20、40和80 μg/mL完全培养基100 μL,各设3复孔。于48 h后,每孔加90 μL无血清DMEM及10 μL CCK-8溶液,继续培养2 h,后用酶标仪在450 nm波长下测定各孔吸光度,实验重复3次。
细胞抑制率=[1-(A对照孔-A实验孔)/(A对照孔-A空白孔)]×100%
1.2.4 Western blot检测P53、RRM2
分别用0(对照组)、40和80 μg/mL的瑞香素处理U-251 MG、HepG-2和MDA-MB231细胞48 h后,加入适量的RIPA裂解细胞提取蛋白,BCA法蛋白定量,样品在10% SDS-PAGE行电泳,然后电转至PVDF膜上,5%脱脂牛奶封闭,P53、RRM2和GAPDH兔来源一抗于4 ℃孵育15 h后,山羊抗兔二抗于室温孵育2 h,发光试剂(ECL)显影,凝胶成像系统成像,其结果用软件Image J进行分析。
1.3 统计学方法
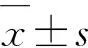
2 结果
2.1 网络药理学分析结果
将瑞香素的结构(见图1)导入Swiss Target Prediction数据库预测得到瑞香素潜在靶点100个,其中Probability为0的有43个,删除该靶点,得到有效治疗靶点57个。
图1 瑞香素的结构Fig.1 Structure of daphnetin
通过GeneCards数据库筛选得到恶性胶质瘤靶基因426个、肝癌靶基因886个和三阴性乳腺癌靶基因1197个,所得到的靶基因取交集后得到三种肿瘤的共同靶基因253个(见图2)。
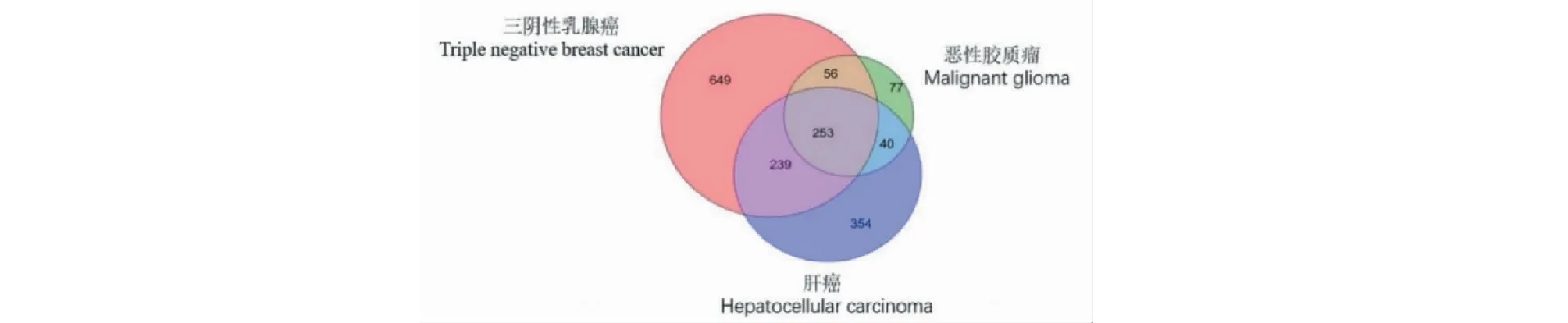
图2 恶性胶质瘤、肝癌、三阴性乳腺癌靶点交集的韦恩图Fig.2 Venn diagram of intersection targets of malignant glioma,hepatocellular carcinoma and triple-negative breast cancer
用Cytoscape构建瑞香素-三种肿瘤PPI图,筛选出P53、ESR1、CUL3、MCM2、CDK2等56个基因为瑞香素抗三种肿瘤的核心靶点(见图3)。

图3 瑞香素潜在治疗恶性胶质瘤、肝癌及三阴性乳腺癌共同作用靶点PPI网络图Fig.3 PPI network of potential therapeutic targets of daphnetin for malignant glioma,hepatocellular carcinoma and triple-negative breast cancer注:以节点大小和颜色深浅标识靶点连接度。Note:The node size and color in the figure indicate the target connectivity.The larger the node,the deeper the color,and the higher the connectivity.
对这56个核心靶点进行GO富集分析,发现瑞香素抗三种肿瘤的机制主要与细胞周期的调节、促进细胞凋亡以及DNA的合成和修复等生物过程有关(见图4)。
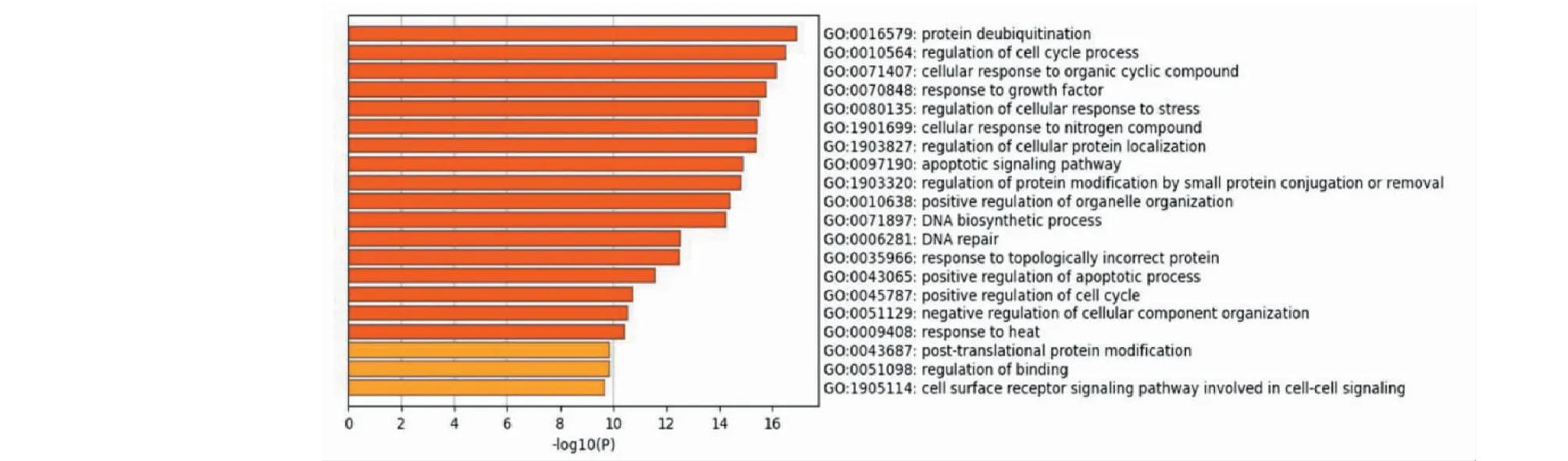
图4 GO功能富集分析图Fig.4 GO functional enrichment analysis diagram
对瑞香素与恶性胶质瘤、肝癌、三阴性乳腺癌相关靶点交集基因的KEGG通路富集分析结果显示,P53通路及癌症通路为瑞香素抗肿瘤的主要通路(见图5)。
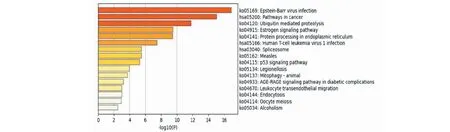
图5 KEGG通路富集分析图Fig.5 KEGG pathway enrichment analysis diagram
通过KEGG数据库查询到的P53通路图显示P53R2是DNA修复的重要通路(见图6)。在KEGG数据库及网络药理学分析中认为P53R2即为RRM2[7],而核糖核酸还原酶M2亚基(ribonucleotide reductase subunit M2,RRM2)是调控DNA合成和修复的关键酶亚基[8]。
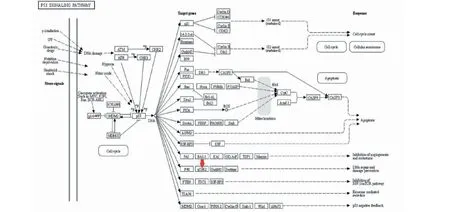
图6 P53通路图Fig.6 P53 pathways in KEGG database注:红色箭头表示p53R2(P53/RRM2)通路。Note:The red arrow indicates the p53R2 (p53/RRM2) pathway.
通过cBioPortal数据库分析显示RRM2在恶性胶质瘤、肝癌和乳腺癌中高表达(见图7)。因此我们选择对P53/RRM2通路进行实验验证,明确其是否是瑞香素抗三种肿瘤的共同通路。
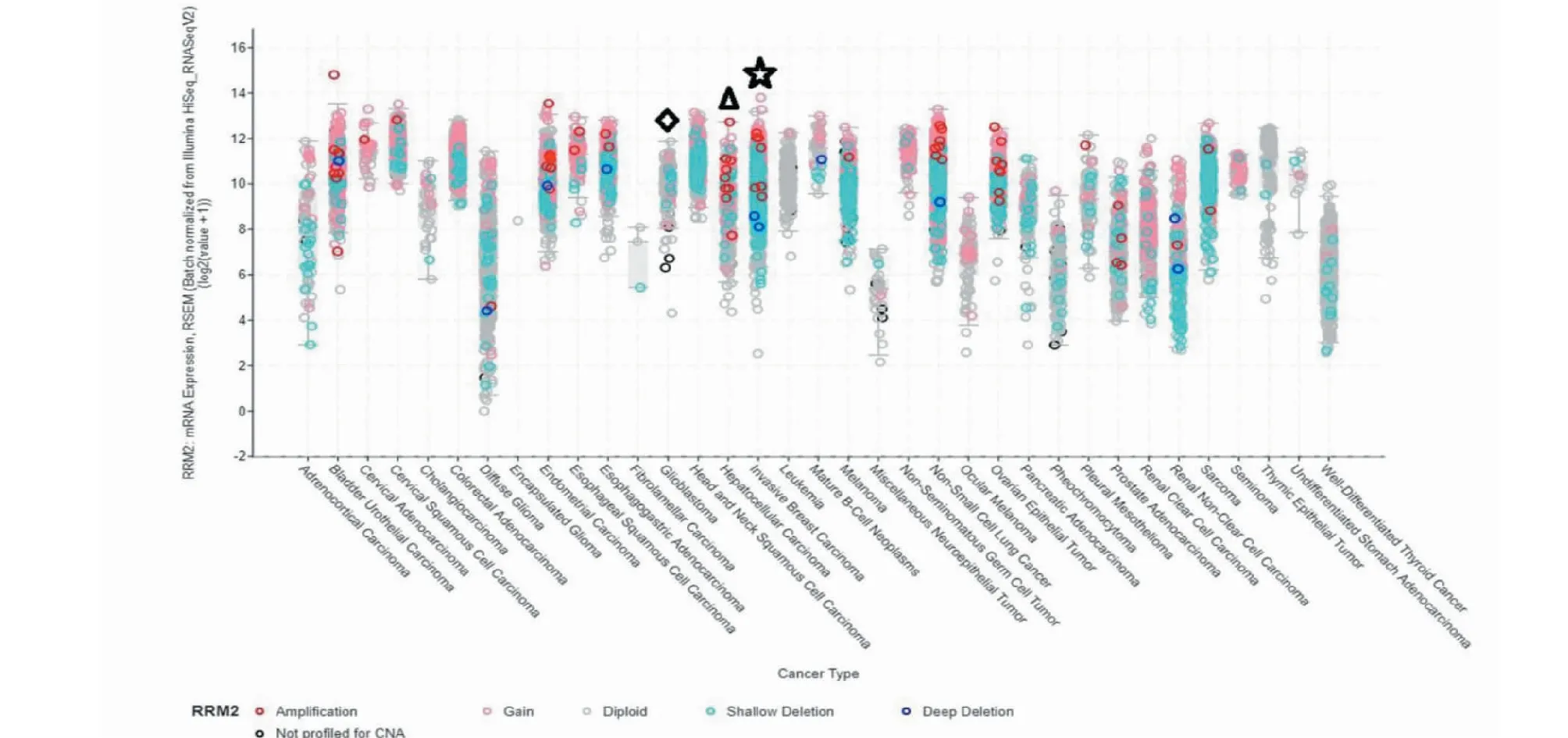
图7 cBioPortal数据库中RRM2 mRNA在不同肿瘤的表达水平Fig.7 Expression level of RRM2 mRNA in different cancer in cBioPortal database注:◇:恶性胶质瘤;△:肝癌;☆:乳腺癌。Note:◇:Malignant glioma;△:Hepatocellular carcinoma;☆:Breast carcinoma.
分子对接结果显示,瑞香素与P53蛋白的结合能为-5.7 kcal/mol,其主要是通过形成氢键以及疏水作用力,与Arg267(A)、Ser99(A)形成3个氢键,氢键长度分别为3.19、3.18、3.21 Å;与Leu264(A)、Ile254(A)、Pro98(A)、Thr256(A)具有疏水作用。瑞香素与RRM2蛋白的结合能为-6.7 kcal/mol,其主要是通过形成氢键以及疏水作用力,与Tyr323(A)、Arg330(A)分别形成4个氢键,氢键长度分别为2.87、3.19、2.80、3.24Å;与Val327(A)、Ser263(A)、Phe240(A)、Met350(A)、Gly267(A)、Gly233(A)、Gys270(A)具有疏水作用。提示瑞香素与P53及RRM2均具有较好的结合作用(见图8、9)。
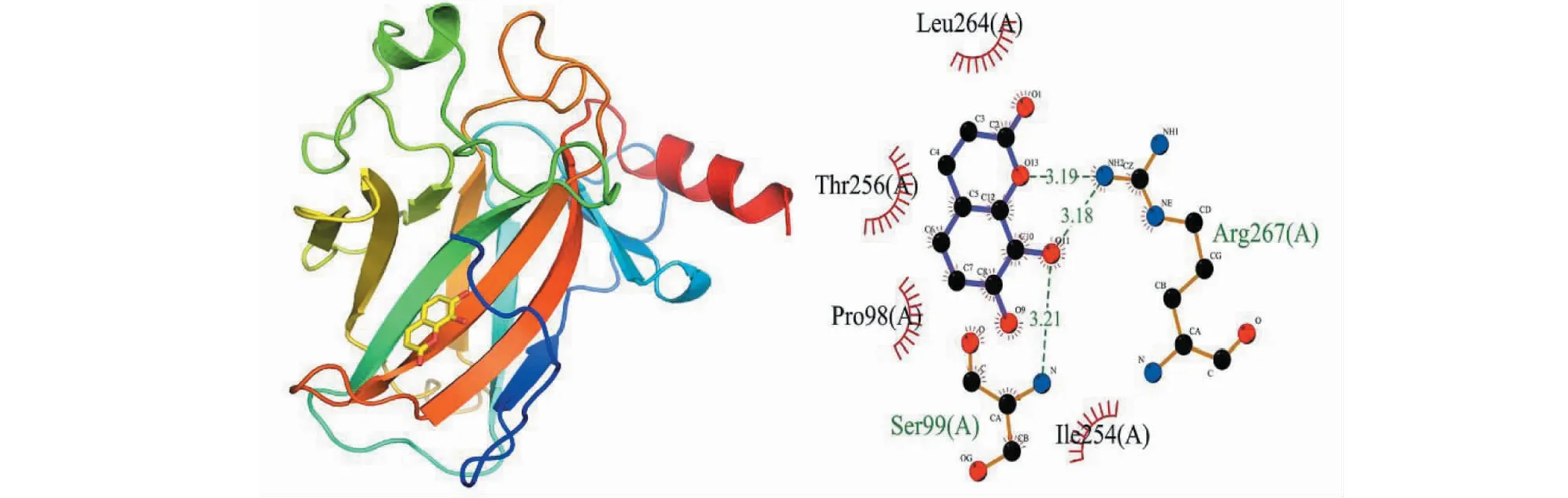
图8 瑞香素与P53蛋白对接图Fig.8 The molecular docking diagram of daphnetin with P53 protein
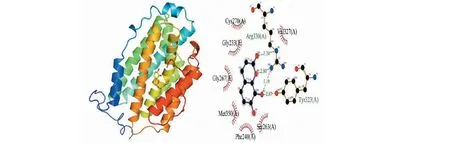
图9 瑞香素与RRM2蛋白对接图Fig.9 The molecular docking diagram of daphnetin and RRM2 protein
通过人类蛋白图谱数据库获得RRM2在正常组织(见图10A)和肿瘤细胞系(见图10B)中的表达水平。从中筛选出RRM2较正常脑组织和肝组织表达较高的U-251 MG、HepG-2细胞系。另外,Yun等研究显示乳腺癌中MDA-MB231细胞系的RRM2表达较高[9],因此我们选择上述三个细胞系进行后续体外验证实验。
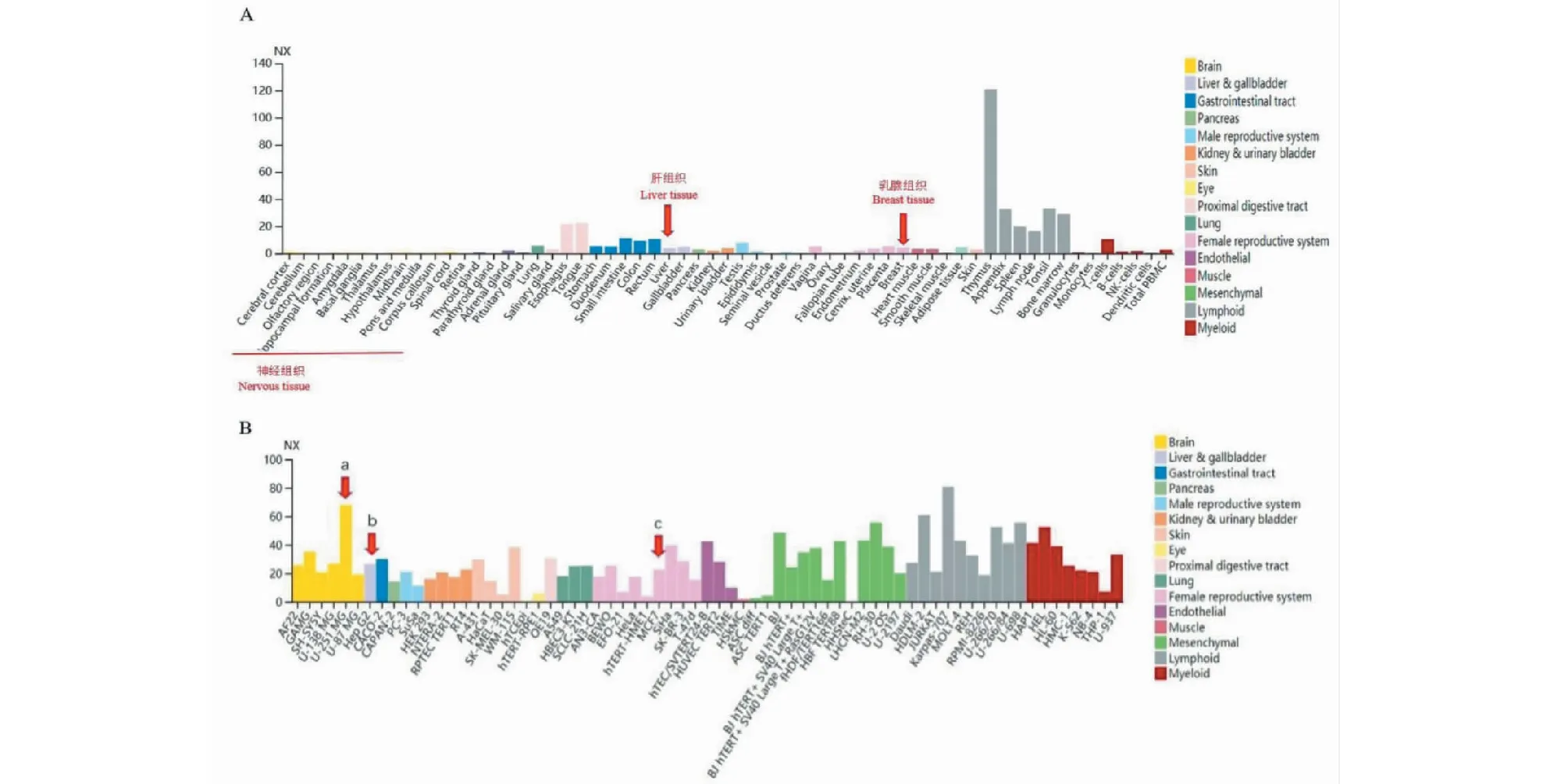
图10 人蛋白质数据库中RRM2在不同组织中的表达水平Fig.10 The expression of RRM2 in different tissues in human protein database注:A:正常组织;B:肿瘤细胞系(a:胶质瘤U-251 MG细胞系;b:肝癌HepG-2细胞系;c:乳腺癌)。Note:A:Normal tissue;B:Tumor cell lines (a:Glioma cell line U251-MG;b:Hepatocellular carcinoma cell line HepG-2;c:Breast carcinoma).
2.2 瑞香素对肿瘤细胞增殖的影响
与对照组比较,瑞香素(10、20、40、80 μg/mL),处理肿瘤细胞48 h后,能显著抑制U-251 MG、HepG-2、MDA-MB231细胞增殖,且呈剂量依赖性。瑞香素为10 μg/mL时,三个细胞系间,抑制率无明显差异;瑞香素为20 μg/mL时,U-251 MG的抑制率较HepG-2、MDA-MB231高(P< 0.05),HepG-2和MDA-MB231的抑制率无明显差异;瑞香素为40 μg/mL时,三个细胞系间,抑制率差异明显(P<0.01),以HepG-2抑制率最高;瑞香素为80 μg/mL时,HepG-2抑制率最高,与U-251 MG、MDA-MB231差异明显(P< 0.01),而U-251 MG和MDA-MB231抑制率无明显差异(见图11)。

图11 不同浓度瑞香素对肿瘤细胞的抑制率(n = 3)Fig.11 Inhibitory rate of daphnetin at different concentrations on tumor cells (n = 3)注:与对照组比较(相同细胞系内),*P < 0.05,**P < 0.01,***P < 0.001;不同细胞系间比较(相同浓度瑞香素),#P < 0.05,# #P < 0.01。Note:Compared with the control group in the same cell line,*P < 0.05,**P < 0.01,***P < 0.001;Comparison of different cell lines treated with daphnetin at the same concentration,#P < 0.05.
2.3 瑞香素对肿瘤细胞P53和RRM2蛋白表达的影响
与对照组比较,40、80 μg/mL的瑞香素处理U-251 MG、HepG-2、MDA-B231细胞48 h后,P53表达均显著增高(P< 0.01),RRM2的表达均显著降低(P< 0.05)。与40 μg/mL组比较,80 μg/mL的瑞香素处理U-251 MG、HepG-2、MDA-MB231细胞48 h后,P53表达均显著增高(P< 0.01),RRM2的表达均显著降低(P< 0.05)。瑞香素为40 μg/mL时,U251-MG细胞系中RRM2的表达量与MDA-MB231细胞系间差异明显(P< 0.05),而HepG-2和MDA-MB231细胞系间RRM2的表达量无明显差异;瑞香素为80 μg/mL时,三个细胞系间RRM2的表达量无明显差异。瑞香素为40 μg/mL时,三个细胞系间P53表达量无明显差异;HepG-2抑制率最高;瑞香素为80 μg/mL时,U-251 MG细胞系中P53的表达量与HepG-2和MDA-MB231差异明显(P< 0.05),而HepG-2和MDA-MB231细胞系中P53的表达量无明显差异(见图12)。
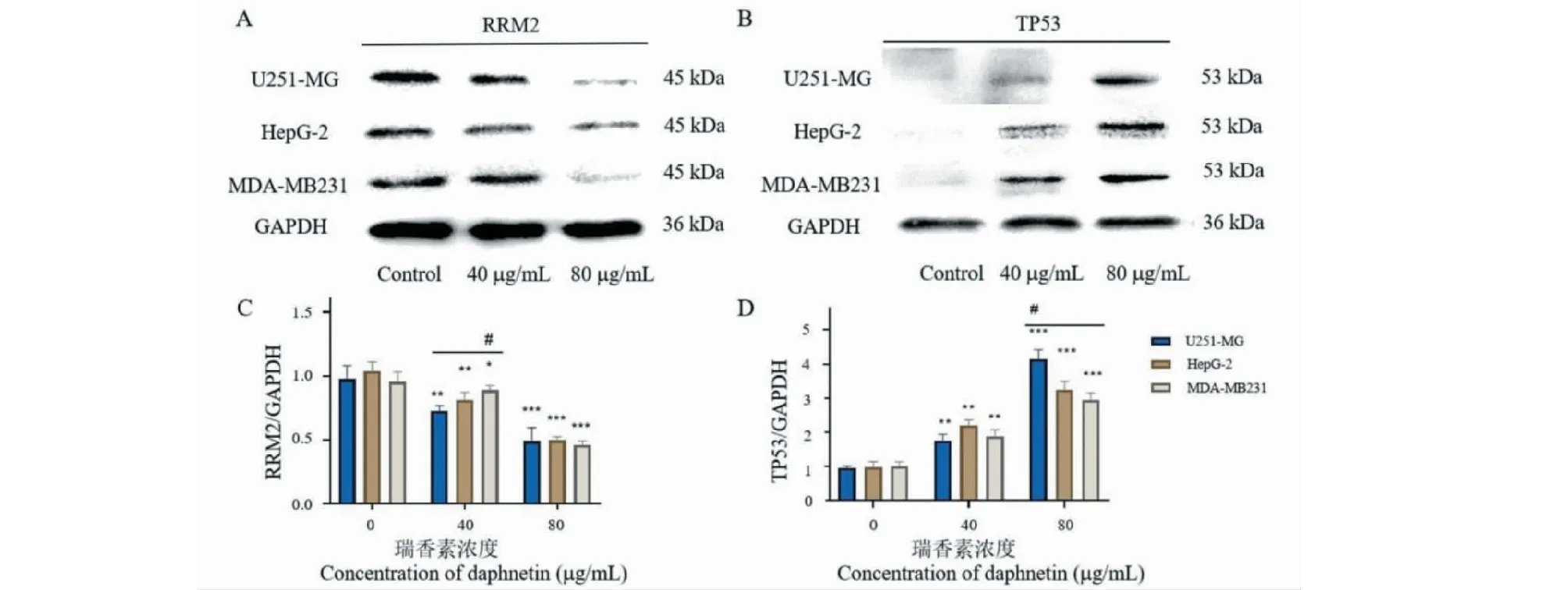
图12 瑞香素对U-251 MG、HepG-2和MDA-MB231细胞中P53和RRM2蛋白表达的影响(n = 3)Fig.12 Effect of daphnetin on p53 and RRM2 protein expression in U-251 MG,HepG-2 and MDA-MB231 cells (n = 3)注:A表示瑞香素(0、40、80 μg/mL)处理48 h后RRM2蛋白质印迹条带;B表示瑞香素(0、40、80 μg/mL)处理48 h后P53蛋白质印迹条带;C、D分别表示RRM2和P53与内参GAPDH的比率。与对照组比较(相同细胞系内),*P < 0.05,**P < 0.01,***P < 0.001;不同细胞系间比较(相同浓度瑞香素),#P < 0.05。Note:After treatment with daphnetin (0,40 and 80 μg/mL)for 48 h,A and B showed Western blot bands of RRM2 and p53,respectively;C and D showed the ratio of RRM2 and p53 to GAPDH,respectively.Compared with the control group in the same cell line,*P < 0.05,**P < 0.01,***P < 0.001;Comparison of different cell lines treated with daphnetin at the same concentration,#P < 0.05.
3 讨论与结论
本研究首先采用网络药理学分析,发现P53通路是瑞香素抗恶性胶质瘤、肝癌和乳腺癌的共同通路。同时,本研究通过体外验证实验发现瑞香素在浓度为40、80 μg/mL时均能显著抑制U-251 MG、HepG-2及MDA-MB231三种细胞的增殖,并显著提高这三种肿瘤细胞中P53蛋白的表达水平。P53是重要的抑癌基因,其机制主要包括细胞周期阻滞、促进肿瘤细胞衰老和凋亡、抑制血管生成和肿瘤转移以及促进DNA合成和修复和调节等[10]。我们的研究结果表明瑞香素可增加上述三种肿瘤细胞中P53表达,进而发挥抑癌作用。RRM2是P53通路中调控DNA合成和修复的关键酶,且在P53通路中富集[11]。大量研究也证明P53能通过RRM2调控细胞周期、DNA合成及修复,并诱导肿瘤细胞凋亡[12]。因此RRM2成为多种肿瘤治疗的重要靶点[13]。
结果发现,40、80 μg/mL的瑞香素处理U-251 MG、HepG-2和MDA-MB231细胞后,其RRM2蛋白表达均显著降低。RRM2为核糖核酸还原酶(ribonucleotide reductase,RR)中最重要的亚基,是生物体内催化DNA合成和修复的关键酶[14]。目前研究表明RRM2在胶质瘤、乳腺癌、肝癌等疾病中高表达,是肿瘤治疗的靶点[11,15,16],其与肿瘤细胞的侵袭转移能力、药物抵抗和细胞周期调控等相关[15,17,18]。
RRM2含酪氨酸自由基及Fe-S基团,故目前所开发的靶向药物多是基于上述靶点开发,如自由基清除剂、铁螯合剂、铁类似物等,部分RRM2抑制剂已应用于肿瘤的临床治疗[19],但有血液-淋巴系统代谢紊乱,肝肾功能失调,胃肠道反应等多种副作用[20]。瑞香素是一种具有铁螯合功能的天然植物活性成分,已有研究发现瑞香素可抑制疟原虫中RR活性及表达[21],我们的结果进一步证明瑞香素能抑制多种人体肿瘤细胞中RRM2蛋白的表达。因RRM2在DNA复制与修复中的重要作用,推测瑞香素能抑制多种肿瘤细胞,与其调控RRM2的表达密切相关。瑞香素可作为一种新的RRM2抑制剂应用于肿瘤的治疗,且具有安全性高、分布广等特点[22]。
综上所述,我们的结果表明瑞香素可抑制U-251 MG、HepG-2、MDA-MB231细胞系增殖,瑞香素与P53及RRM2有较好的结合能力。瑞香素抗多种肿瘤的机制可能与P53/RRM2通路有关。瑞香素可作为一种新的RRM2抑制剂,极具开发前景。
