两种连接臂的mPEG-羟基喜树碱纳米粒的性能研究
2022-02-19韩露葛小玲宋坤杨祚辉周倩袁泽轩眭维恕袁华兵易晓芳
韩露 葛小玲 宋坤 杨祚辉 周倩 袁泽轩 眭维恕 袁华兵 易晓芳
〔摘要〕 目的 設计两种连接臂的聚合物纳米粒,研究其自组装性能及酸度调控下的缓释性,为肿瘤组织外酸度调控下的药物定位释放提供研究基础。方法 使用丁二酸酐(succinic anhydride, SA)、乌头酸酐(cis-aconitic anhydride, CA)作为连接臂,将10-羟基喜树碱(10-hydroxycamptothecin, 10-HCPT)与聚乙二醇单甲醚(methoxypolyethylene glycols, mPEG)连接,形成mPEG-SA-HCPT(PSH)、mPEG-CA-HCPT(PCH)聚合物。透析法制备纳米粒,核磁共振氢谱、动态光散射、透射电镜、紫外光谱对纳米材料进行性能研究及其体外释放性能测定。结果 核磁共振氢谱结果表明,聚合物成功合成。动态光散射测定PCH纳米粒径约为84.27 nm,负载HCPT后约为90.67 nm,PSH纳米粒径约为94.42 nm,负载HCPT后粒径约为110.8 nm,透射电镜显示纳米粒形态为均匀的圆形。紫外光谱测定载药的PSH纳米粒载药量约为22.1%,载药的PCH纳米粒的载药量约为25.8%。载药后的PSH纳米粒具有明显缓释性,48 h药物释放量达53.26%,pH值为6.8的释放介质下,药物释放明显加快,48 h药物释放量达到85.53%。而载药的酸敏感性的纳米粒子在48 h药物释放率为46.73%,在pH为6.8的条件下48 h释放率为95.77%。结论 两亲性聚合物可以自组装形成圆形纳米粒,通过化学连接和物理包埋两种手段可以得到高负载药物量的纳米粒。聚合纳米材料中的酸敏感连接臂能调控聚合物纳米粒的缓释性。
〔关键词〕 10-羟基喜树碱;动态光散射;乌头酸酐;核磁共振氢谱;透射电镜
〔中图分类号〕R28 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2022.01.008
〔Abstract〕 Objective To study the self-assembly properties and the slow and controlled-release properties under the control of acidity by designing two kinds of polymer nanoparticles with connecting arms, in order to provide a research basis for drug localization and release under the regulation of acidity outside tumor tissue. Methods Succinic anhydride (SA) and aconitic anhydride (CA) was used as connecting arms, 10-hydroxycamptothecin (10-HCPT) was linked with methoxypolyethylene glycols (mPEG) to form mPEG-SA-HCPT (PSH) and mPEG-CA-HCPT (PCH) polymers. The nanoparticles were prepared by dialysis and the properties of nanomaterials were studied by nuclear magnetic resonance (NMR), dynamic light scattering (DLS), transmission electron microscopy (TEM), ultraviolet (UV) spectroscopy and the property of the in vitro release was studied. Results NMR spectroscopy results showed that the polymer was synthesized successfully. The size of PCH nanoparticles was about 84.27 nm, 90.67 nm after loading HCPT, and the size of PSH nanoparticles was about 94.42 nm, 110.8 nm after loading HCPT. TEM showed that the shape of the nanoparticles was uniform and spherical. UV spectroscopy showed the drug loading capacity of PSH nanoparticles and PCH nanoparticles were about 22.1% and 25.8%, respectively. PSH nanoparticles after drug loading showed obvious sustained release, and the drug release reached 53.26% at 48 h. In the release medium of pH 6.8, the drug release was significantly accelerated, and the drug release reached 85.53% at 48 h. The drug release rate of acid sensitive nanoparticles was 46.73% at 48 h and 95.77% at pH 6.8. Conclusion Amphiphilic polymers can self assemble into spherical nanoparticles, and high drug loading nanoparticles can be obtained by chemical bonding and physical embedding. The acid sensitive arm in polymeric nanomaterials can control the slow release property of polymer nanoparticles.
〔Keywords〕 10-hydroxycamptothecin; dynamic light scattering; aconitic anhydride; nuclear magnetic resonance spectroscopy; transmission electron microscopy
结肠癌是常见的发生于结肠部位的消化道恶性肿瘤,发病率占胃肠道肿瘤的第三位[1-2]。目前,化疗是临床治疗结肠癌的主要手段,喜树碱(camptothecin, CPT)是常用的抗消化道肿瘤的化疗药物。10-羟基喜树碱(10-hydroxycamptothecin, 10-HCPT)为S期特异性的抗肿瘤药物,拓扑异构酶I为CPT的主要作用部位,在体外和体内都能显著抑制人结肠细胞系的生长[3]。然而,同许多小分子抗癌药物一样,10-HCPT的水溶性很差,导致其生物利用度低;靶向性差,导致其产生不良反应。若能将10-HCPT制成一种制剂,提高其水溶性,并使其靶向到肿瘤组织,便能有效改善10-HCPT临床治疗的效力[4]。
纳米靶向制剂是目前癌症治疗的一种新型手段,利用纳米胶束特定的尺寸能使其高效到达靶组织,实现药物在靶组织的富集[5-6]。纳米粒子对肿瘤组织的靶向是靠其特定的尺寸实现的,由于肿瘤组织血流供应丰富,存在着特殊的高通透性和滞留效应(enhanced permeability and retention effect, EPR),粒径在100 nm左右的纳米粒子可以通过EPR效应透过肿瘤组织处的血管内皮,实现其在肿瘤组织处的被动靶向[7-9]。使用納米粒子作为药物载体时,可以使用接枝、包埋等方法将疏水药物负载于疏水核心里,可以极大地提高药物的溶解度,改善其生物利用度。未经修饰纳米胶束在循环系统被血浆中的调理素、整合素等吸附,使其易于被吞噬细胞识别,进而被单核吞噬细胞系统及网状内皮系统吞噬,降低了药物的生物利用率[10]。聚乙二醇单甲醚(methoxypolyethylene glycols, mPEG)是一种用途极为广泛的高分子化合物,具有优异的生物相容性[11-12]。研究表明,用mPEG修饰纳米胶束表面时,纳米胶束表面形成一层水化膜,使其难以被调理素、整合素吸附,从而避免了血液中的单核细胞和巨噬细胞的吞噬,使其在血液中的驻留时间延长,达到长循环的效果[13-14]。
但是,mPEG在保护纳米胶束的同时,也减少了肿瘤细胞对纳米胶束的吞噬[15]。因此,如果让纳米胶束被动靶向至肿瘤组织处后,可以在细胞外定位释放,就能提高抗癌药物在细胞局部的浓聚,从而提高治疗效力。由于大多数肿瘤细胞会通过糖酵解方式生成ATP,肿瘤细胞微环境积聚大量乳酸,细胞外环境呈弱酸性[16-17]。有报道表明,选用乌头酸酐(cis-aconitic anhydride, CA)作为酸敏感连接臂[18],双键共轭酸生成的酯在酸性条件容易水解。因此,本研究用CA作为连接臂将mPEG与10-HCPT接枝,形成两亲性聚合物,同时采用常用的普通连接臂丁二酸酐(succinic anhydride, SA)作为对比研究。两亲性聚合物在水溶液中可以自组装成为亲水基壳,疏水基为核的壳-核结构纳米粒。疏水核心可以通过疏水作用力负载疏水药物,形成负载药物的纳米粒。传统聚合物纳米胶束多采用高分子亲水性聚合物作为基本骨架,导致载药量低下。得到一种结构简单、载药量高的纳米胶束是解决纳米胶束药物临床应用的关键点。
针对传统纳米粒子的载药率低、结构复杂等问题,本研究设计了一种新型的酸敏感连接臂载药mPEG-CA-HCPT(PCH)纳米粒和普通连接臂的mPEG-SA-HCPT(PSH),其结构简单、具有化学连接10-HCPT和物理包埋10-HCPT双载药特性。由于结肠癌组织的EPR效应,通过双载药物纳米粒的小尺寸效应,被动靶向肿瘤组织,以提高治疗效力。
1 材料和方法
1.1 材料
10-HCPT(上海能源化学有限公司,批号:19685-09-7,纯度99%);1-乙基-3-(3-二甲基氨基丙基)碳二亚胺盐酸盐[1-ethyl-3-(3-dimethylaminopropyl) carbodiimide hydrochloride, EDCI](批号:7084-11-9,纯度98%)、4-二甲基氨基哌啶(4-dimethylaminopyridine, DMAP)(批号:1122-58-3,纯度99%)均购自上海阿拉丁试剂有限公司。
1.2 仪器
紫外分光光度计(型号:VF 3001)、透射电子显微镜(型号:JEM-100C)均购自美国赛默飞世尔科技公司;动态光散射仪(英国马尔文仪器有限公司,型号:ZS-90);核磁共振氢谱仪(德国布鲁克科技有限公司,型号:AVANCE-Ⅲ500)。
1.3 聚合物的合成及表征
1.3.1 mPEG-CA的合成 取2 g mPEG(2000 Da)、0.15 g CA、0.18 g DMAP、0.28 g EDC-HCl溶于20 mL二氯甲烷,将圆底烧瓶置于磁力恒温搅拌器上,50 ℃恒温条件下,反应48 h。将反应液移入旋转蒸发仪中,处理过后收集固体并加水溶解,使用纤维素透析袋(截留量1000 kDa)透析24 h,冻干即得mPEG-CA。
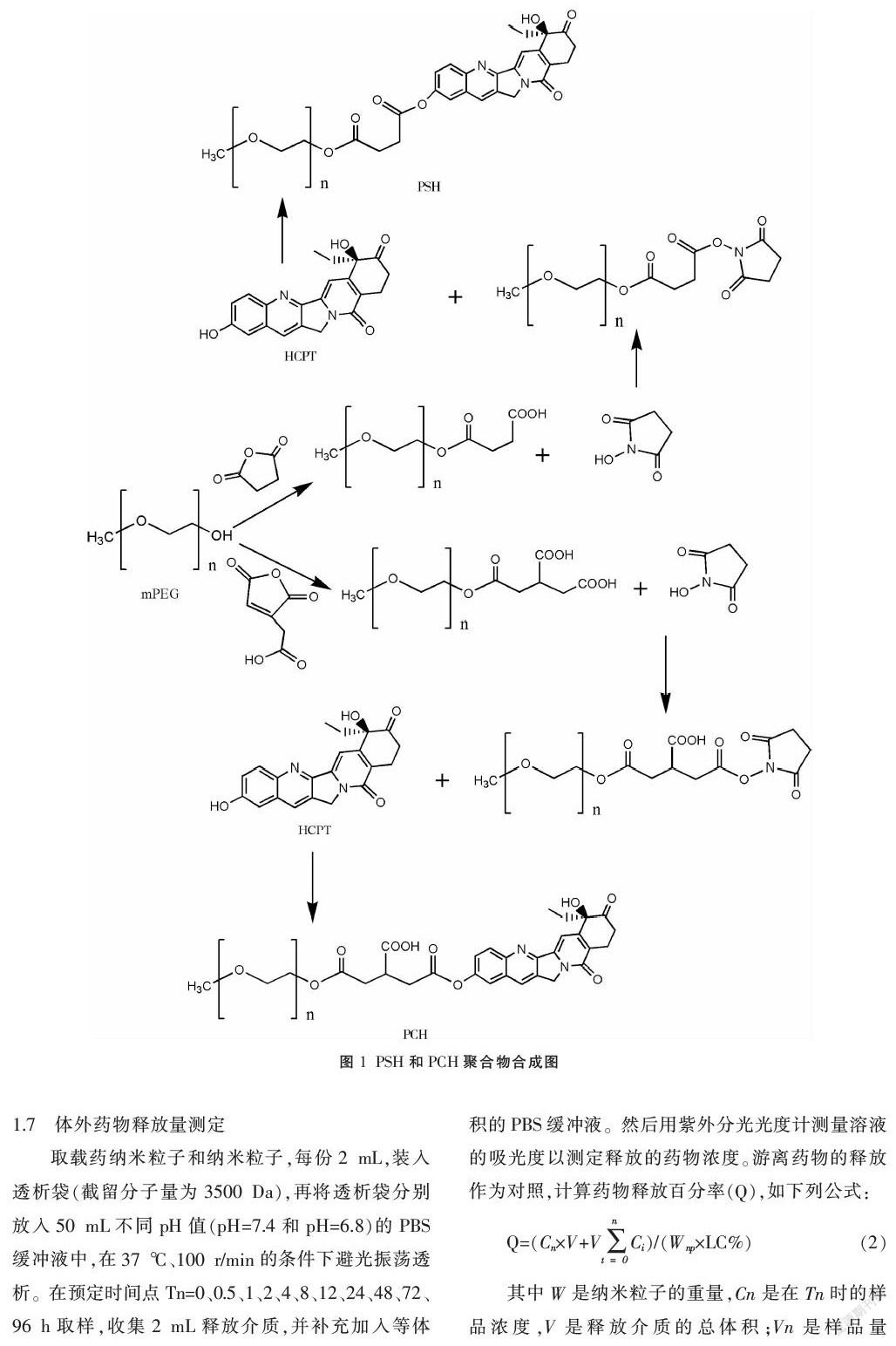
1.3.2 PCH的合成 取0.34 g mPEG-CA、0.025 g DMAP、0.023 g NHS在10 mL N,N-二甲基甲酰胺常温下充分反应。加入50 mg HCPT,向烧杯中通入氮气,常温下避光反应48 h。将反应液边搅拌缓缓倒入100 mL乙醚/乙酸乙酯(1∶1)溶液中,抽滤,洗涤,得到固体,将固体移入圆底烧瓶。加入150 mL DCM,搅拌至溶解,用30 mL(pH=7.4)NaHCO3溶液洗涤两次。加入适量无水Na2SO4,静置2 h,过滤至滤液澄清透明,再用旋转蒸发仪处理滤液,收集固体,如图1所示。抽滤,无水乙醚洗涤,干燥后储存。
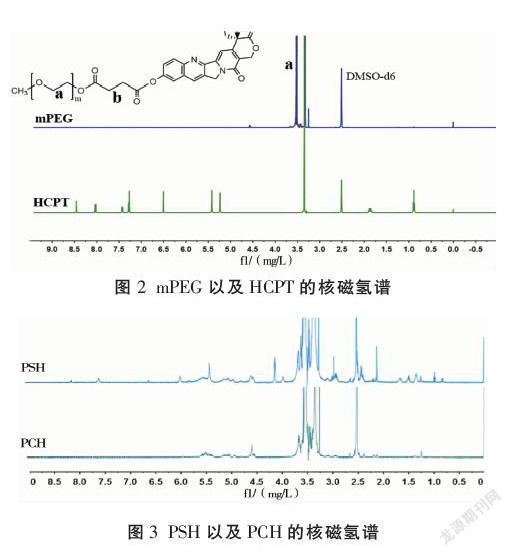
1.3.3 核磁共振氢谱 取少量PEG、HCPT、PSH和PCH固体,溶于适量氘代DMSO中。将溶液移至试样管中,至液层高35~40 mm,加入TMS等基准物质,进行核磁共振氢谱测定。
1.4 载药PSH纳米粒的制备
将PSH聚合物2.5 mg加入圆底烧瓶,加入2 mL DMSO,恰好完全溶解,室温下搅拌5 min。然后将溶液缓慢滴入5 mL PBS(pH=7.4)中,室温下轻搅30 min。将溶液以16 000 r/min的转速离心10 min(离心半径6 cm),用PBS洗涤后再次以16 000 r/min的转速离心10 min(离心半径6 cm)。最后用PBS将溶液定容至0.5 mg/mL,4 ℃下冷藏备用。取10 mg的PSH聚合物,1 mg的HCPT,溶于适量的DMSO中,待完全溶解后转入透析袋,避光透析,每次加500 mL蒸馏水,前3 h每1 h换水1次,后6 h每2 h换水1次,将DMSO透析干净,自组装制备载药纳米粒,备用。
1.5 载药PCH纳米粒的制备
参照“1.4”方法取10 mg的PCH聚合物、1 mg的HCPT,自组装制备载药纳米粒,备用。
1.6 纳米粒子的表征
1.6.1 动态光散射 取已制备的纳米粒样品2 mL,分别用0.45 μm微孔滤膜过滤,然后用动态光散射仪测定纳米粒子样品的尺寸和电位。
1.6.2 載药量的测定 配置一系列不同浓度(0.1、0.2、0.3、0.4、0.5 mg/mL)的HCPT溶液,将溶液依次移入比色皿,测定在265 nm处的吸光度。再分别取适量制备的3种载药纳米胶束(均已定容至0.5 mg/mL)移入比色皿,测定在265 nm处的吸光度。按下列公式计算载药量(LC):
LC=纳米粒子中的药物量/纳米粒子重量×100%(1) 1.7 体外药物释放量测定
取载药纳米粒子和纳米粒子,每份2 mL,装入透析袋(截留分子量为3500 Da),再将透析袋分别放入50 mL不同pH值(pH=7.4和pH=6.8)的PBS缓冲液中,在37 ℃、100 r/min的条件下避光振荡透析。在预定时间点Tn=0、0.5、1、2、4、8、12、24、48、72、96 h取样,收集2 mL释放介质,并补充加入等体积的PBS缓冲液。然后用紫外分光光度计测量溶液的吸光度以测定释放的药物浓度。游离药物的释放作为对照,计算药物释放百分率(Q),如下列公式:
Q=(Cn×V+VCi)/(Wnp×LC%)(2)
其中W是纳米粒子的重量,Cn是在Tn时的样品浓度,V是释放介质的总体积;Vn是样品量(2 mL);Ci是Ti处的样品浓度(i=0,0.5,1,…,n,V0和C0均等于0)
2 结果
2.1 核磁分析
mPEG的特征峰(3.0~4.0 mg/L)和HCPT的特征峰(4.0~8.5 mg/L)相应在PSH、PCH中出现,表明二者合成成功。见图2-3。
2.2 纳米粒子的表征
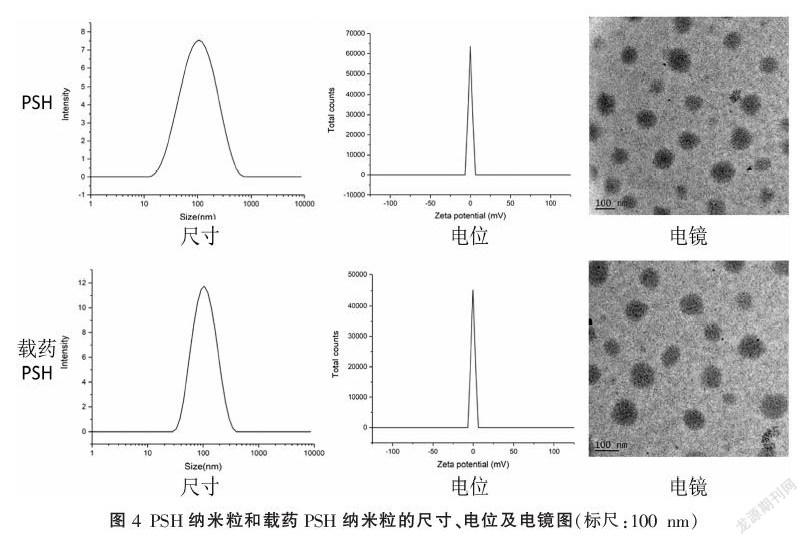
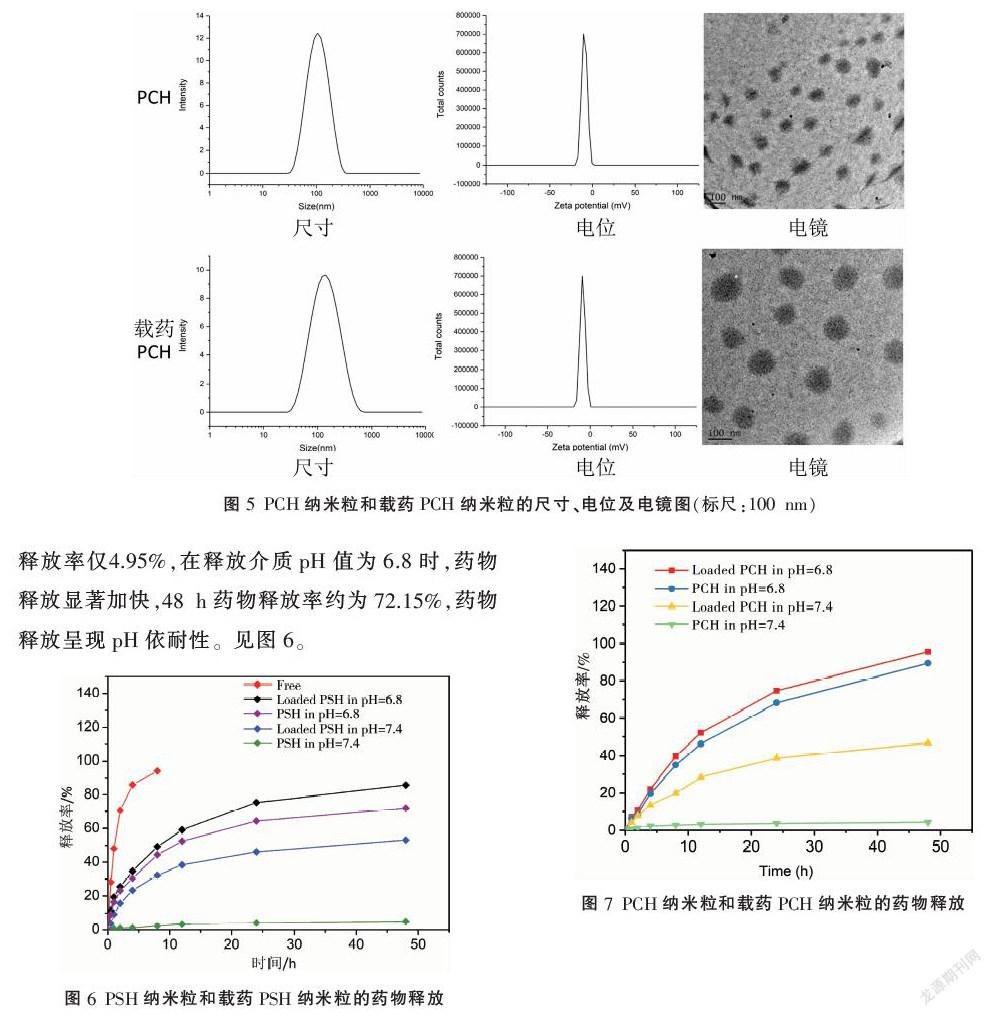
PCH纳米粒子的粒径大约84.27 nm,分散度系数(polydispersity index, PDI)值为0.286,纳米粒表面电动电位(Zeta电位)为-0.131 mV,载药PCH纳米粒子的粒径大约90.67 nm,PDI值为0.222,Zeta电位为-0.301 mV,两种纳米粒子透视电镜下都呈圆形,分散度好。PSH纳米粒子的粒径大约94.42 nm,PDI值为0.219,Zeta电位为-9.37 mV,载药PSH纳米粒子的粒径大约110.8 nm,PDI值为0.267,Zeta电位为-8.75 mV,电镜下呈圆形。见图4-5。
2.3 不同性能的纳米粒药物负载的效率
PSH纳米粒的载药量约为15.3%,而载药后PSH纳米粒载药量约为22.1%。本实验设计的纳米粒既包含化学连接药物,也有通过物理包埋的方式,化学连接负载的载药量15.3%,物理包埋的载药量为6.8%,负载药物的总体量相对较高。PCH的载药量约为18.4%,而负载HCPT的羟基喜树碱的载药量约为25.8%,因此,通过物理包埋的药物载药量约为7.4%。PCH无论是物理包埋还是接枝的药物量均高于PSH纳米粒,可能是由于顺式乌头酸上更多的羧基所造成的,更多的羧基可以接更多的药物。
2.4 纳米粒的药物释放
游离药物在8 h内快速释放率达94.32%,载药PSH纳米粒的药物释放呈现逐步释放特性,开始12 h内释放较快,后一阶段释放速度减缓,48 h药物释放率达到53.26%。在释放介质pH值为6.8时,载药PSH纳米粒释放明显变快,48 h药物释放率达85.53%。PSH纳米粒在释放介质pH值为7.4时,释放非常缓慢,在前8 h药物释放率很少,48 h药物释放率仅4.95%,在释放介质pH值为6.8时,药物释放显著加快,48 h药物释放率约为72.15%,药物释放呈现pH依耐性。见图6。
在生理条件下,PCH纳米粒子的48 h释放率为4.32%,而载药PCH纳米粒子的48 h释放率46.73%。在pH=6.8的条件下,PCH纳米粒子的48 h释放率为89.52%,而载药PCH纳米粒子的48 h释放率为95.77%。在正常生理条件时,酸敏感性纳米粒子的释放相比非酸敏感的较低,可能是由于药物显碱性,而CA显酸性,二者静电作用力较强;而在低pH时,酸敏感键断裂使药物更快释放。见图7。
3 讨论
10-HCPT是疏水性药物,通过酸敏感连接臂将其与亲水性聚合物mPEG连接形成两亲性聚合物,在水溶液自组装过程中,可以通过疏水作用力、分子间作用力、氢键等弱作用力包埋10-HCPT,形成载药纳米粒。通过物理包埋和化学连接两种方式负载药物,具有比较高的药物负载效率。由于物理包埋是弱作用力,所以药物比较容易释放。其中,通过分子作用力吸附在纳米粒表面的药物释放最快,呈现一个快速的释放过程,后面呈现药物的缓慢释放,主要表现为通过疏水作用力包埋到纳米粒疏水中心的药物释放。本研究是通过酸敏感连接臂形成的聚合物纳米粒,在弱酸性环境中药物的释放呈现控制释放,药物释放除了表现为弱作用力包埋的药物的释放外,还表现为化学共价键连接的药物释放。对于聚合物纳米粒而言,化学共价鍵连接的药物释放,会导致纳米粒解聚,进而会促进物理包埋的药物爆发性释放,释放加快,释放量增加。
表面含有mPEG的聚合物纳米粒可以避免肝的网状内皮系统的吞噬,减少在肝的沉积,从而降低药物对肝的毒性[19]。由于EPR效应,纳米粒可以高效地通过被动靶向肿瘤组织。纳米粒在肿瘤组织发挥治疗作用主要可能通过两个方式:(1)纳米粒在肿瘤细胞外释放,药物以游离方式扩散进入癌细胞发挥作用;(2)纳米粒被肿瘤细胞吞噬,药物在溶酶体内释放发挥药理作用[20]。由于肿瘤组织外呈现弱酸性环境,本研究设计的聚合物纳米粒,具有酸敏感的药物释放,推测药物在体内发挥抗肿癌疗效主要是细胞外药物的定位释放。
本项目通过化学连接和物理包埋两种方式提高药物的负载效率,采用的载体材料mPEG是体内可以应用的生物医用材料。通过mPEG修饰旨在使纳米粒在肝组织沉积减少,通过EPR效应增强肿瘤组织的被动靶向作用[21]。通过酸敏感的连接臂形成的聚合物纳米粒,具有酸调控的缓慢释放,从而发挥肿瘤组织的定位释放,提高纳米药物的抗癌效力[22]。本研究通过一种简单方法制备了一种新型的纳米粒,初步考察了其体外性质及载药功能,为进一步进行体内功能研究提供了基础。
参考文献
[1] 宋 琳,张 利,蒋益兰.健脾消癌方对缺氧微环境诱导的结肠癌细胞生物学行为影响及抑癌机制研究[J].湖南中医药大学学报,2021,41(2):211-217.
[2] 彭 俊,吕慧婕,丁星星,等.MicroRNA在结肠癌诊断及中医药防治的研究进展[J].医学理论与实践,2021,34(21):3713-3714,3718.
[3] 范子琪,徐 勤,秦金保,等.羟基喜树碱药物递送系统抗肿瘤研究进展[J].医学综述,2021,27(9):1796-1801.
[4] 杨若澜,郭 惠,靳如意,等.喜树碱结构修饰及抗肿瘤靶向性研究进展[J].中国药物化学杂志,2020,30(11):696-704.
[5] KANAPATHIPILLAI M, BROCK A, INGBER D E. Nanoparticle targeting of anti-cancer drugs that alter intracellular signaling or influence the tumor microenvironment[J]. Advanced Drug Delivery Reviews, 2014, 79/80: 107-118.
[6] AKHTER S, AHMAD Z, SINGH A, et al. Cancer targetedmetallic nanoparticle: Targeting overview, recent advancement and toxicity concern[J]. Current Pharmaceutical Design, 2011, 17(18): 1834-1850.
[7] 高春晓,魏训东,黄 卫,等.纳米药物对肿瘤免疫微环境的影响[J]. 中国药学杂志,2021,56(19):1546-1550.
[8] 潘 超,王晓峰.壳聚糖纳米粒子在药物递送系统中的应用进展[J]. 实用临床医药杂志,2021,25(4):116-120.
[9] 周世月,邵莹莹,李 媛,等.中药有效成分纳米制剂抗肿瘤的研究进展[J].天津中医药大学学报,2020,39(4):374-380.
[10] 韩文钊.内源性环境响应型自组装肽聚合物纳米载药系统的构建及抗肿瘤活性研究[D].长春:吉林大学,2021.
[11] 孙冰冰,赵红玲,李莹莹,等.叶酸与端醛基聚乙二醇双重修饰的壳聚糖-硬脂酸纳米胶束的制备[J].中国药房,2019,30(21):2926-2931.
[12] 刘 源,周建平,王 伟.聚乙二醇修饰靶向纳米制剂的研究进展[J].中国药科大学学报,2017,48(3):268-275.
[13] 秦 欢,张 兵,马 喆,等.PEG修饰的紫草素纳米结构脂质载体的制备和体外评价[J].天津中医药大学学报,2021,40(5):647-652.
[14] MASOOD N, AHMED R, TARIQ M, et al. Silver nanoparticle impregnated chitosan-PEG hydrogel enhances wound healing in diabetes induced rabbits[J]. International Journal of Pharmaceutics, 2019, 559: 23-36.
[15] 郝若祎,耿 雪,徐世一,等.As2O3-PLA-NPs、As2O3-mPEG-PLA-NPs对肿瘤细胞MCF-7/ADR增殖和凋亡的影响[J].中医药信息,2021,38(3):8-15.
[16] 林舒婷,朱丹丹,韩丽丽,等.基于聚酰胺-胺型树形分子的肿瘤微环境刺激响应性递药系统的研究进展[J].中国医药工业杂志,2021,52(6):757-770.
[17] LAPLANE L, DULUC D, BIKFALVI A, et al. Beyond the tumour microenvironment[J]. International Journal of Cancer, 2019, 145(10): 2611-2618.
[18] 孙瑞阳.人参皂苷Rg3和顺式乌头酸酐-阿霉素共载药胶束的制备与评价[D].大连:辽宁师范大学,2019.
[19] SMOLAR M, MIKOLAJCIK A, DEDINSKA I, et al. Liver abscess as a rare complication of PEG[J]. Perspectives in Surgery, 2019, 98(5): 219-222.
[20] 杨惠卿,王 喻,骆红飞,等.载紫杉醇的pH敏感型热休克蛋白纳米载体的肿瘤细胞摄取特性及药理学评估[J].厦门大学学报(自然科学版),2019,58(6):811-816.
[21] 李 昕,朱丹丹,陈 裕,等.纳米药物递送系统在促进肿瘤深层渗透方面的研究进展[J].中南药学,2020,18(12):2009-2018.
[22] 陈 曦,祝星宇,马博乐,等.基于肿瘤微环境的纳米靶向载体研究进展[J].中国药房,2017,28(13):1864-1869.
