黄芩苷抑制乳腺癌细胞侵袭、迁移与凋亡的机制研究
2022-02-19罗勇吴双华康永清唐新桥王泽强王婷
罗勇 吴双华 康永清 唐新桥 王泽强 王婷





〔摘要〕 目的 用黄芩苷干预人乳腺癌细胞株MCF-7,观察黄芩苷对乳腺癌细胞侵袭、迁移与凋亡的影响及其作用机制。方法实验分为正常组、模型组、黄芩苷组、miR-126组、LNA 组、LNA-126 组和LNA-126+黄芩苷组。采用RT-PCR检测miR-126、miR-145、miR-100和let-7c的表达水平,MTT法检测细胞增殖情况,Transwell实验检测细胞侵袭与迁移情况,Western blot法检测p53、Caspase-3、Caspase-9、Bcl-2、Bax和p-p38蛋白的表达水平,流式细胞术检测细胞凋亡情况。结果 RT-PCR结果显示,与模型组相比,黄芩苷作用于MCF-7细胞后miR-126、miR-145、miR-100和let-7c表达明显上调(P<0.05,P<0.01,P<0.001),其中以miR-126最為显著(P<0.001);与正常组相比,4种miRNA在模型组中的表达均下调,其中以miR-126下调最为明显(P<0.05);MTT结果显示,MCF-7细胞的增殖受到miR-126和黄芩苷的抑制(P<0.05),而MCF-7细胞的增殖受到LNA-126的促进(P<0.05);Transwell实验结果显示,MCF-7细胞的侵袭和迁移受到miR-126和黄芩苷的抑制(P<0.05),而黄芩苷对MCF-7细胞侵袭和迁移的抑制受到LNA-126的拮抗(P>0.05);Western blot结果显示,黄芩苷及miR-126作用于MCF-7细胞后Bcl-2表达水平下降(P<0.05),p53、Caspase-3、Caspase-9、Bax及p-p38表达水平上升(P<0.05);流式细胞术结果显示,黄芩苷及miR-126促进MCF-7细胞凋亡(P<0.05)。结论 黄芩苷可以抑制乳腺癌细胞的增殖、侵袭与迁移,并促进其凋亡,其机制可能与通过上调miR-126有关。
〔关键词〕 乳腺癌;黄芩苷;miR-126;侵袭与迁移;细胞凋亡
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2022.01.006
〔Abstract〕 Objective Human breast cancer cell line MCF-7 was treated with baicalin to observe the effect and mechanism of baicalin on invasion, migration and apoptosis of breast cancer cells. Methods The experiment was divided into control group,model group, baicalin group, miR-126 group, LNA group, LNA-126 group and LNA-126+baicalin group. The expression levels of miR-126, miR-145, miR-100, let-7c were detected by RT-PCR, and the cell proliferation was determined by using MTT method. The invasion and migration of cells were detected by Transwell test, and the expression levels of p53, Caspase-3, Caspase-9, Bcl-2, Bax and p-p38 were determined by Western blot. Cell apoptosis was detected by flow cytometry. Results The results of RT-PCR showed that compared with model group, the expression levels of miR-126, miR-145, miR-100, and let-7c were significantly up-regulated after baicalin was treated on MCF-7 cells (P<0.05,P<0.01,P<0.001), especially miR-126 (P<0.001); compared with control group, the expression levels of four miRNAs in model group were down regulated, especially miR-126 (P<0.05); MTT results showed that miR-126 and baicalin can inhibit the growth of MCF-7 cells (P<0.05), while LNA-126 may promote the growth MCF-7 cells (P<0.05). Transwell test results showed that miR-126 and baicalin can inhibit the invasion and migration of MCF-7 cells (P<0.05), while LNA-126 can antagonize the inhibitory effect of baicalin (P>0.05). Western blot results showed that the expression level of Bcl-2 decreased after baicalin and miR-126 acted on MCF-7 cells (P<0.05), and the expression levels of p53, Caspase-3, Caspase-9, Bax, and p-p38 increased (P<0.05). The results of flow cytometry showed that baicalin and miR-126 promoted the apoptosis of MCF-7 cells (P<0.05). Conclusion Baicalin can inhibit the proliferation, invasion and migration of breast cancer cells, and promote their apoptosis. The mechanism may be related to the up-regulation of miR-126.
〔Keywords〕 breast cancer; baicalin; miR-126; invasion and migration; apoptosis
乳腺癌是最常见的妇女恶性肿瘤疾病之一,近年来其发病率逐年增加,尤其年轻患者的发病率显著增加,影响着女性的身心健康[1]。乳腺癌患者最终的结局是出现全身多器官广泛的转移,其最常见的转移部位是骨、肺、肝和脑,转移是导致乳腺癌患者死亡的主要原因之一,也是临床上目前治疗亟待攻破的难点[2]。因此,当前乳腺癌研究的热点为抑制乳腺癌细胞的增殖[3]、侵袭与迁移[4]。目前,对乳腺癌的早期治疗多为根治术,同时结合放化疗、内分泌治疗、生物治疗及中药等综合治疗手段。尽管如此,乳腺癌的复发率依旧很高,有30%~40%的患者乳腺癌细胞发生局部复发和远处转移,极大地降低了患者的生活质量,增加了死亡率[5]。
研究表明,miRNA在肿瘤的侵袭和迁移中发挥着重要作用,为诊断和治疗提供了新的思路。黄芩苷是我国传统中药黄芩的主要有效成分之一,现代药理学研究表明,黄芩苷具有抗病毒、抗血小板凝集、抗氧化、抗炎症反应、抗过敏反应、影响钙离子通道开放和调节免疫等药理作用[6]。近年来,黄芩苷的研究逐渐成为热点,研究表明,黄芩苷具有不良反应少、来源广泛、抗菌谱广等特性,对大肠癌、肝癌及前列腺癌等多种癌症具有显著的疗效[7-9]。
本课题组前期采用miRNA芯片筛选发现黄芩苷能上调乳腺癌细胞的4种miRNA:miR-126、
miR-145、miR-100和let-7c。本研究拟在前期基础上,通过转染miR-126 mimics和miR-126抑制剂,在离体水平观察黄芩苷对miR-126的调节作用,并探讨其促进乳腺癌细胞侵袭、迁移和凋亡的机制,为乳腺癌的临床提供理论基础和依据,同时为中药黄芩新型制剂的开发提供新的视野和思路。
1 材料与方法
1.1 细胞株
人乳腺癌细胞株MCF-7(中南大学湘雅医学院中心实验室细胞库,批号:180234);正常乳腺细胞株Hs 578Bst(上海拜力生物科技有限公司,批号:180192)。1.2 主要试剂
黄芩苷(纯度98.5%)(中国药品生物制品检定所,批号:120608-201113);RT-PCR定量检测试剂盒(大连宝生物工程有限公司,批号:RR820A);p53(批号:ABP51955)、 Caspase-3(批号:ABP52935)、Caspase-9(批号:ABP52437)、Bcl-2(批号:PAB19877)、Bax(批号:22160002)、p-p38(批号:20140016)、GADPH(批号:XFC1655)均购自上海研晶生化试剂有限公司;锁核酸(locked nucleic acid, LNA)[生工生物工程(上海)股份有限公司,货号:A104053]。
1.3 主要仪器
二氧化碳培养箱(美国NAPCO公司,型号:JC-150-GSI-T);凝胶成像分析系统(杭州朗基科学仪器有限公司,型号:ZF-388);转膜仪(美国GE公司,型号:L00686C);流式细胞仪(美国BD公司,型号:FACSMelody);蛋白印迹成像和定量分析系统(英国SYGENE公司,型号:FluorChem Q)。
1.4 细胞培养
MCF-7细胞及Hs 578Bst细胞采用含10%小牛血清DMEM培养基置于37 ℃含5% CO2细胞培养箱中培养。
1.5 药物制备
采用二甲基亚砜(dimethyl sulfoxide, DMSO)充分溶解黄芩苷干粉,稀释至浓度为50 μmol/L,避光,4 ℃保存备用。使用时采用细胞培养液稀释成所需的浓度。
1.6 实验分组
正常组(Hs 578Bst细胞)、模型组(MCF-7细胞)、黄芩苷组(50 μmol/L)、miR-126组(miR-126 mimics转染MCF-7细胞)、LNA组(LNA修饰MCF-7细胞)、LNA-126组(LNA修饰miR-126抑制剂,用于转染后干扰MCF-7细胞内miR-126的表达)、LNA-126+黄芩苷组(LNA-126+黄芩苷共同接种培养)。其中RT-PCR法分别考察模型组与黄芩苷组、正常组与模型组;MTT法考察模型组、黄芩苷组、miR-126组、LNA组与LNA-126组;Transwell法考察模型组、黄芩苷组、miR-126组与LNA-126+黄芩苷组;Western blot法与Annexin V-FITC/PI双染色法考察模型组、黄芩苷组与miR-126组。
1.7 miR-126转染细胞
取1 μg(质粒∶miR-126 mimics和LNA-126按1∶1混合)混合物,用50 μL不含血清和抗生素的DMEM培养基稀释质粒,混匀,常温孵育15 min;用50 μL不含血清和抗生素的DMEM培养基稀释3 μL Lipofectamine 2000TM试剂,混匀;将稀释的
Lipofectamine 2000TM试剂加入到RNA/DMEM混合液中,上下颠倒混匀,室温孵育15 min;用1 mL不含血清和抗生素的DMEM洗细胞一次,然后加入0.9 mL含2%血清不含抗生素的DMEM培養基;将RNA/Lipofectamine 2000TM试剂混合物加入上述处理过的DMEM培养皿中,混匀,CO2培养箱中37 ℃培养过夜;用含2%血清和抗生素的DMEM培养基替换含有转染混合物的培养基,然后CO2培养箱中培养48 h。
1.8 指标检测
1.8.1 RT-PCR法 转染60 h后,采用Trizol法提取各组细胞的总RNA;上机95 ℃,3 min;95 ℃,
12 s;62 ℃,35 s,共35个循环。引物序列见表1。
1.8.2 MTT法 MCF-7细胞以1×104个密度接种于96孔培养板过夜培养,50 μmol/L黄芩苷作用于细胞72 h,加入20 μL MTT液,37 ℃培养箱中孵育4 h,离心,弃去培养液,每孔加入150 μL DMSO,低速振荡10 min,酶标仪检测490 nm处吸光度。
1.8.3 Transwell法 50 g基质胶包裹Transwell小室底部膜的内表面,置于细胞培养箱中成胶,调整细胞密度至5×108个/L,取200 μL细胞悬液加入到24孔Transwell小室的上室,下室加入600 μL含0.2% BSA和10% FCS的DMEM培养基,将200 μL细胞悬液加入Transwell小室上层,下室则加入只含0.2% BSA的培养基,每组3孔,PBS液清洗2次,甲醇固定15 min,PBS清洗2次,0.1%结晶紫染色10 min,PBS液再清洗2次,显微镜下拍照观察。
1.8.4 Western blot法 RIPA裂解液提取细胞总蛋白,BCA法测定蛋白浓度;SDS-PAGE电泳,用湿转法将目的蛋白迁移到PVDF膜上,100 V 90 min后置于4 ℃冰箱,封闭,一抗孵育,于4 ℃冷藏室摇床过夜(p53 1∶200稀释,其余均1∶1000稀释);二抗37 ℃孵育2 h;凝胶图像分析。
1.8.5 Annexin V-FITC/PI双染色法 MCF-7细胞培养在6孔板,收集悬浮细胞,收集细胞并用PBS洗。配制1×Annexin V结合缓冲液。配制100 μg/mL的PI工作液,取5 μL 1 mg/mL PI储存液加至45 μL 1×Annexin V结合缓冲液中。再次用PBS洗细胞,弃上清,将细胞重悬于1×Annexin V 结合缓冲液中,调整细胞密度至1×106个/mL。每100 μL细胞悬液加入5 μL Annexin V和1 μL 100 μg/mL的PI工作液。室温避光孵育15 min。加入400 μL 1×Annexin V结合缓冲液,轻轻混匀。过滤后用流式细胞仪检测。
1.9 统计学分析
采用SPSS 16.0统计软件进行分析,计量资料以“x±s”表示,先进行正态性检验和方差齐性检验,取α=0.05,以P<0.05为差异有统计学意义。方差齐者,完全随机设计的两均数比较采用t检验,多组间均数的比较采用单因素方差分析检验,不同组比较采用Dunnett-t法。方差不齐时,采用Mann-Whitney U秩和检验。
2 结果
2.1 黄芩苷上调miRNA在乳腺癌细胞中的表达
与模型组相比,黄芩苷作用于MCF-7细胞后,miR-126(P<0.001)、miR-145(P<0.05)、miR-100(P<0.01)、let-7c(P<0.05)表达水平均明显上调,其中以miR-126上调最为显著(P<0.001)。见图1。
2.2 miRNA在正常乳腺和乳腺癌细胞中表达的比较
与正常组比较,模型组miR-126、miR-145、miR-100、let-7c的表达均下调,其中以miR-126下调最为明显(P<0.05)。见表2。
2.3 各组细胞增殖率的比较
与模型组比较,黄芩苷组、miR-126组、LNA组细胞增殖率均显著下降(P<0.05);而LNA-126组细胞增殖率较LNA组显著增加(P<0.05),与模型组相 比,差异无统计学意义(P>0.05)。见表3。
2.4 各组细胞迁移率的比较
与模型组比较,黄芩苷组和miR-126组MCF-7细胞迁移率均下降(P<0.05),而LNA-126+黄芩苷组MCF-7细胞迁移率无明显下降(P>0.05)。见表4。
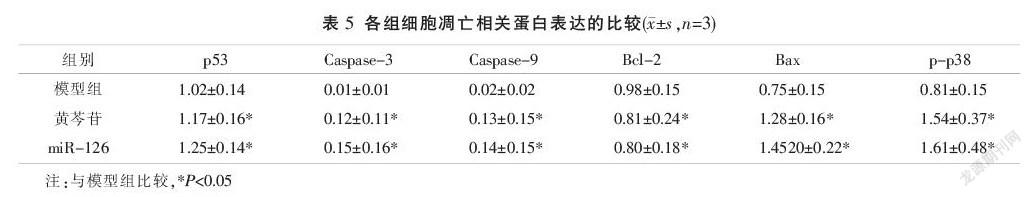
2.5 各组细胞凋亡相关蛋白表达的比较
与模型组比较,黄芩苷组及miR-126组细胞凋亡相关蛋白p53、Caspase-3、Caspase-9、Bax和p-p38蛋白表达水平明显增高(P<0.05),而Bcl-2表达水平明显下降(P<0.05);黄芩苷组与miR-126组比较,差异无统计学意义(P>0.05)。见图2、表5。
2.6 各组细胞凋亡率的比较
与模型组相比,黄芩苷组与miR-126组的凋亡率均显著增加(P<0.05),miR-126组相较于黄芩苷组凋亡率显著增加(P<0.05)。见表6。
3 讨论
据不完全统计,2012 年全球新发女性乳腺癌的人数约166万,占女性癌症发病率的26%,其死亡率占女性癌症死亡率的13%[10]。严重危害广大女性健康。尽管临床上对于乳腺癌的治疗取得了较大的进展,但是术后局部复发率依旧很高,为30%~40%,这为乳腺癌治疗带来极大的挑战。因此,如何防止乳腺癌的侵袭与迁移已成为当前迫切需要解决的问题。
miRNA是一类重要的细胞调节因子,具有多种生物学功能,影响细胞生长和分化,参与细胞增殖和凋亡过程[11-13]。miRNA的异常表达常常诱发多种疾病,包括肿瘤、白血病与自身免疫性疾病等[14]。经研究证实,多种miRNA的异常表达参与人类恶性疾病的进程,影响着多种疾病的病理生理变化[15]。
中医药是我国的文化瑰宝,中医药在乳腺癌治疗方面取得了一定成就。大量研究表明,中药或其单体成分具有显著的抑制腫瘤细胞增殖和增强机体免疫力的作用,可能提高癌症患者的生存率[16-20]。同时,联合其他治疗手段还可明显减少不良反应的发生率,提高疗效,降低毒副作用,为癌症临床治疗开辟了视野,提供了新的思路。中医治疗主要是从整体上进行功能调节,恢复阴阳的动态平衡。已有研究表明,中药对肿瘤中异常表达的基因具有调控作用,从而纠正其病理状态。miRNA的异常表达参与了癌症的发生发展,为治疗癌症理想而有效的靶点。因此,在miRNA水平探究中医药的抗癌机制具有重要意义,并可为肿瘤临床治疗提供依据和研究思路。
本研究采用黃芩苷对MCF-7细胞进行预处理,然后进行miRNA芯片分析,进而筛选出受黄芩苷调控最为明显的miRNA,进一步探讨黄芩苷对乳腺癌细胞增殖、分化、侵袭与迁移的作用及潜在分子机制。筛选出来的miRNA经RT-PCR确认,发现miR-126在乳腺癌细胞中表达明显下调,而黄芩苷却能显著上调其表达;MTT结果表明,miR-126和黄芩苷均可抑制MCF-7细胞的增殖;Transwell结果表明,miR-126和黄芩苷均可抑制MCF-7细胞的侵袭与迁移;Western blot结果表明,miR-126和黄芩苷作用于MCF-7细胞后引起凋亡相关蛋白表达水平发生改变:降低Bcl-2蛋白的表达,提高p53、Caspase-3、Caspase-9、Bax及p-p38蛋白的表达,提示它们可以促进MCF-7细胞的凋亡;流式细胞术结果提示,黄芩苷和miR-126均可促进MCF-7细胞的凋亡;而采用LNA-126进行处理后可提高黄芩苷降低的MCF-7细胞的增殖率与侵袭率,提示黄芩苷可能通过miR-126发挥抗癌作用。
本研究中黄芩苷属于黄酮类化合物,为我国传统中药黄芩的主要有效成分之一,通过对miR-126的调控,抑制乳腺癌细胞的增殖、侵袭与迁移,促进其凋亡,可能有助于抑制乳腺癌的发生和发展,为乳腺癌的基因诊断、基因治疗及预后的早期预测提供了新的思路,也为黄芩苷治疗乳腺癌提供了实验依据,为中医药治疗乳腺癌提供了新靶点和新思路。
参考文献
[1] XU S B, LIU Y Y, ZHANG T F, et al. The global, regional, and national burden and trends of breast cancer from 1990 to 2019: Results from the global burden of disease study 2019[J]. Frontiers in Oncology, 2021, 11: 689562.
[2] MENON S, AMBEKAR A, RAO V, et al. Grossing and reporting of testicular tumor specimens: An evidence-based approach[J]. Indian Journal of Cancer, 2020, 57(2): 144-157.
[3] WANG T Y, HA M W. Silencing ARHGAP9 correlates with the risk of breast cancer and inhibits the proliferation, migration, and invasion of breast cancer[J]. Journal of Cellular Biochemistry, 2018, 119(9): 7747-7756.
[4] SA-NGUANRAKSA D, O-CHAROENRAT E, KULPROM A, et al. Nomogram to predict non-sentinel lymph node status using total tumor load determined by one-step nucleic acid amplification: First report from Thailand[J]. Breast Cancer, 2019, 26(4): 471-477.
[5] GREGORY R I, YAN K P, AMUTHAN G, et al. The Microprocessor complex mediates the Genesis of microRNAs[J]. Nature, 2004, 432(7014): 235-240.
[6] LEE I K, KANG K A, ZHANG R, et al. Mitochondria protection of baicalein against oxidative damage via induction of manganese superoxide dismutase[J]. Environmental Toxicology and Pharmacology, 2011, 31(1): 233-241.
[7] YAN W J, MA X C, GAO X Y, et al. Latest research progress in the correlation between baicalein and breast cancer invasion and metastasis[J]. Molecular and Clinical Oncology, 2016, 4(4): 472-476.
[8] JURADO-ESCOBAR R, DOA I, TRIANO-CORNEJO J, et al. Genetic variants in cytosolic phospholipase A2 associated with nonsteroidal anti-inflammatory drug-induced acute urticaria/angioedema[J]. Frontiers in Pharmacology, 2021, 12: 667824.
[9] MA C Y, XU T, SUN X G, et al. Network pharmacology and bioinformatics approach reveals the therapeutic mechanism of action of baicalein in hepatocellular carcinoma[J]. Evidence-Based Complementary and Alternative Medicine, 2019, 2019: 7518374.
[10] AHMAD A. Breast cancer statistics: Recent trends[J]. Advances in Experimental Medicine and Biology, 2019, 1152: 1-7.
[11] TAVAZOIE S F, ALARCN C, OSKARSSON T, et al. Endogenous human microRNAs that suppress breast cancer metastasis[J]. Nature, 2008, 451(7175): 147-152.
[12] ZHANG J W, KONG X, SHI Q Z, et al. MicroRNA-383-5p Acts as a potential prognostic biomarker and an inhibitor of tumor cell proliferation, migration, and invasion in breast cancer[J]. Cancer Biomarkers, 2020, 27(4): 423-432.
[13] HUANG G H, DU M Y, ZHU H M, et al. MiRNA-34a reversed TGF-β-induced epithelial-mesenchymal transition via suppression of SMAD4 in NPC cells[J]. Biomedicine & Pharmacotherapy, 2018, 106: 217-224.
[14] XIAO, HUMPHRIES, YANG, et al. MiR-205 dysregulations in breast cancer: The complexity and opportunities[J]. Non-coding RNA, 2019, 5(4): 53.
[15] HUMPHRIES B, WANG Z S, YANG C F. Micro RNA regulation of breast cancer stemness[J]. International Journal of Molecular Sciences, 2021, 22(7): 3756.
[16] 劉 洁,史红健,熊 雨,等.黄芩苷通过TGF-β1/ERK1/2信号通路抑制鼻咽癌细胞增殖[J].湖南中医药大学学报,2021,41(8): 1154-1159.
[17] 宋 琳,张 利,蒋益兰.健脾消癌方对缺氧微环境诱导的结肠癌细胞生物学行为影响及抑癌机制研究[J].湖南中医药大学学报, 2021,41(2):211-217.
[18] 许 志,谢梦洲,许必祥,等.鹜芪口服液联合化疗对Lewis肺癌小鼠增效减毒作用研究[J].湖南中医药大学学报,2021,41(5): 696-700.
[19] 刘豪杰,陈雪蕾.芦荟大黄素对胃癌SGC-7901细胞Cav-1/PTEN/PI3K/PKB信号通路及侵袭、转移的影响[J].湖南中医药大学学报,2021,41(6):827-831.
[20] 吴源陶,邹译娴,张春虎,等.菝葜皂苷元对结直肠癌细胞HT-29凋亡和自噬的影响[J].湖南中医药大学学报,2021,41(11):1645-1649.
