复合益生菌对眼斑双锯鱼(Amphiprionocellaris)肠道消化酶、菌群结构以及形态的影响
2022-02-19汪磊武琳曾范双任雪崔舒畅李木子任同军
汪磊 武琳 曾范双 任雪 崔舒畅 李木子 任同军



摘要:为探讨饲料中添加复合益生菌对眼斑双锯鱼(Amphiprionocellaris)肠道消化酶、菌群结构及形态的影响,将135尾初始体重(0.79±0.01)g的眼斑双锯鱼随机分为3组,每组3个重复,分别投喂复合益生菌有效活菌添加量为0%(对照组)、3%(L3组)和6%(L6组)的饲料,进行为期28d的养殖试验。结果显示,复合益生菌能提升试验鱼肠道蛋白酶的活性,其中L3组肠道蛋白酶显著提升(P<0.05);能显著降低试验鱼肠道淀粉酶活性(P<0.05);能降低脂肪酶活性(P>0.05)。随着饲料中益生菌添加量的增加,试验鱼肠道中变形菌门丰度开始增多,拟杆菌门丰度降低。饲料中益生菌添加量的增加显著降低试验鱼肠道肌层厚度并显著增加试验鱼肠道绒毛高度(P<0.05)。可见,饲料中添加3%复合益生菌可改善眼斑双锯鱼肠道消化酶活性,提高肠道微生物群落多样性,改善肠道组织形态和功能。
关键词:眼斑双锯鱼(Amphiprionocellaris);益生菌;消化;营养代谢
眼斑双锯鱼(Amphiprionocellaris)属鲈形目(Perciformes),雀鲷科(Pomacentridae),双锯鱼属(Amphiprion),俗称公子小丑鱼。眼斑双锯鱼因其色彩艳丽、小巧可爱而深受人们的喜爱,近年来已成为观赏鱼养殖的热门品种之一。观赏鱼产业常选用活体饵料进行饲喂,但是由于活体饲料本身不方便存储以及携带等缺点,因此使用人工配合饲料已经是大势所趋[1]。与经济鱼类不同的是,观赏鱼的饲料应注重提高观赏鱼的观赏性和品质[2]。目前观赏鱼产业迅速发展,人工饲养小丑鱼已经成为研究热点。
益生菌可以通过改善宿主动物肠道微生物平衡进而对其产生有益影响。目前市面上益生菌的主要种类有:芽孢杆菌类、乳酸菌类、酵母菌类和光合细菌类等[3]。研究表明,饲料中添加益生菌可以提高军曹鱼幼鱼肠道蛋白酶活力[4],改善杂交鲟肠道微生物环境[5]。本试验拟通过在饲料中添加不同水平的益生菌,探究其对眼斑双锯鱼肠道消化酶、菌群结构、组织形态的影响。
1材料与方法
1.1试验菌液
试验菌液为复合益生菌菌液,主要成分为植物乳杆菌、丁羧酸菌和枯草芽孢杆菌,有效活菌数4.0×108CFU/mL。
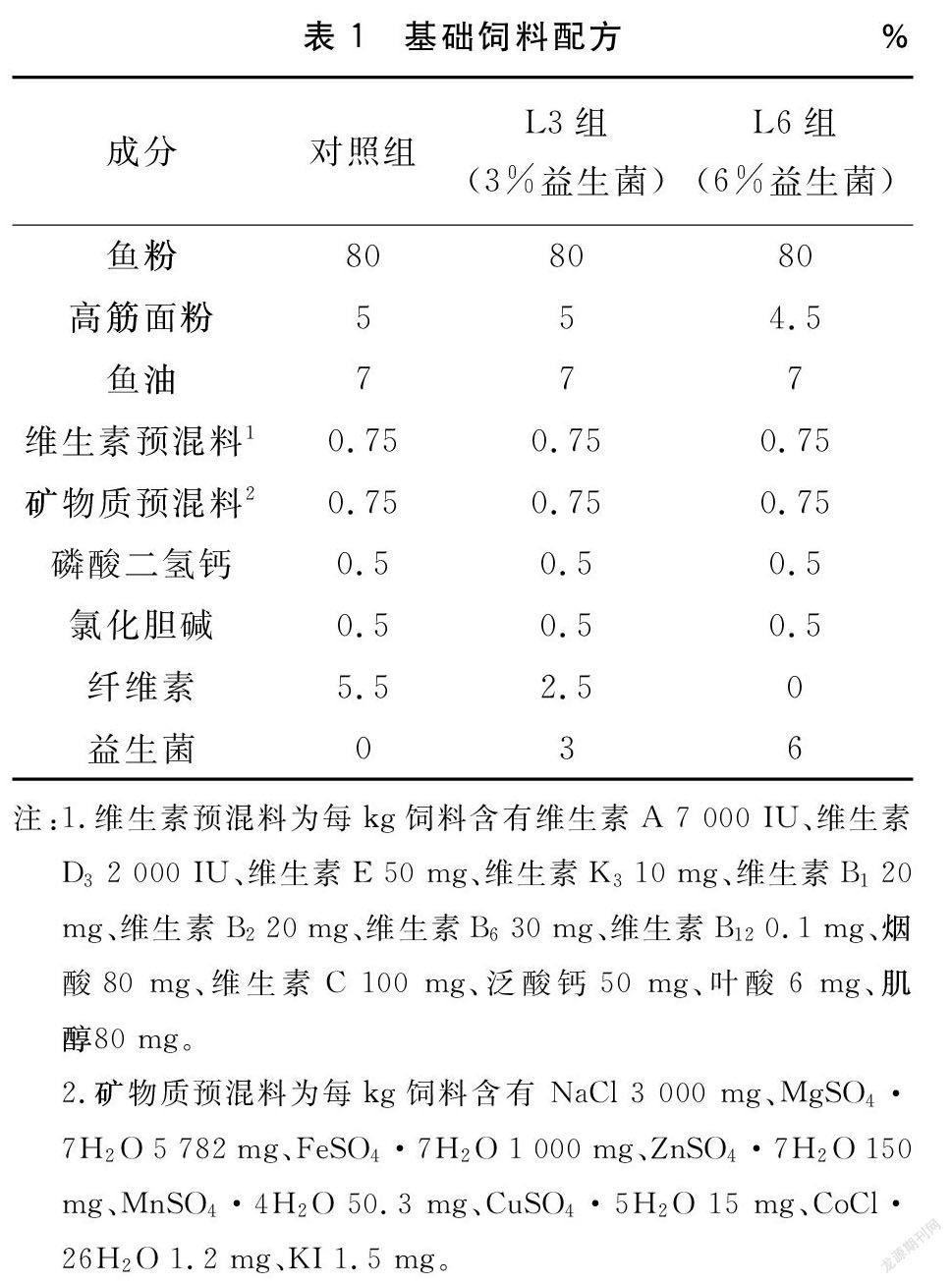
1.2试验饲料设计
将鱼粉、豆粕作为蛋白源,鱼油、豆油作为脂肪源,制成粗蛋白质含量约为51%,粗脂肪含量约为6%的基础饲料。在基础饲料中添加不同浓度的菌液,制成有效活菌含量分别为3%、6%的饲料。饲料制作前,先将全部饲料原料粉碎后过60目筛网,按照配方比例称重后加入,均匀混合。最后加入预先混匀的魚油和大豆油。将油脂颗粒搓开后,在基础饲料的基础上按照配方表取适量的菌液,加入到饲料中搅拌,直至均匀混合后加入适量的水,最后放入制粒机压制成粒。直接放入-20℃冰箱中冷冻保存。每10d重新制作一次饲料,以保证饲料中益生菌活性。饲料组成详见表1。
1.3试验动物及饲养方法
试验所用眼斑双锯鱼购自大连老虎滩珊瑚馆。投喂基础饲料驯养两周后,选取平均初始体重为(0.79±0.01)g的眼斑双锯鱼135尾。将试验鱼随机分为三组,每组设置三个重复,即每个水族箱(长40cm、宽25cm、高40cm)中15尾眼斑双锯鱼,饲养周期为28d。养殖周期内,每天8:00和17:00进行饱食投喂。投喂结束后用虹吸法吸取底部残饵和粪便。驯养及正式试验均采用静水养殖。定期补充因吸底和蒸发损失的海水,将缸中水位保持约为30cm。水温保持在(25±0.5)℃,盐度保持在(32.00±2.00)‰,pH值为8.0~8.2。保持每天24h不间断充氧。
1.4眼斑双锯鱼肠道相关指标的测定
1.4.1眼斑双锯鱼取样养殖试验结束后,将试验鱼(停食24h)用丁香酚(1∶10000)麻醉后放置在冰盘上解剖。取试验鱼肠道放入无菌离心管后迅速放置于液氮中冻存,后转移至-80℃冰箱中保存,用于后续相关指标的测定。用于做切片的肠道放到Bouin's液中进行固定。
1.4.2消化酶的测定试验鱼肠道蛋白酶、脂肪酶、淀粉酶均采用南京建成生物工程研究所购买的试剂盒测定。样品前处理、试剂配制和测定步骤严格按照操作说明书执行。
1.4.3肠道菌群测定将冷冻保存的试验鱼肠道样本进行肠道菌群测定。根据试剂盒说明书OMEGA试剂盒进行DNA提取。之后利用Qubit3.0DNA检测试剂盒对基因组DNA精确定量后,以确定PCR反应应加入的DNA量。最后使用Qubit3.0荧光定量仪进行文库浓度测定。
稀释曲线是从样本中随机抽取一定数量的序列,以抽取的数据量为横轴,以可操作分类单元数值为纵轴绘制曲线,根据曲线是否达到平缓来判断本次测序数据量是否足够。利用Mothur做分析,利用GraphPadPrism8软件制作曲线图得到稀释曲线。使用统计学的分析方法,观测样本在门分类水平上的群落结构,利用GraphPadPrism8软件制作堆积柱形图。
眼斑双锯鱼肠道微生物多样性指数计算公式如下:
香农指数=-∑S obs i=1n iNlnn iN;
丰富度指数=S obs+n 1(n 1-1)2[n 2+1]
辛普森指数=∑S obs i=1n i(n i-1)N(N-1);
覆盖率=1-n iN。
式中:S obs为实际观测到的可操作分类单元数;n i为第i个可操作分类单元数包含的序列数;n 1为只含有一条序列的可操作分类单元数目;n 2为只含有两条序列的可操作分类单元数目;N为所有个体数目,此处为序列总数。
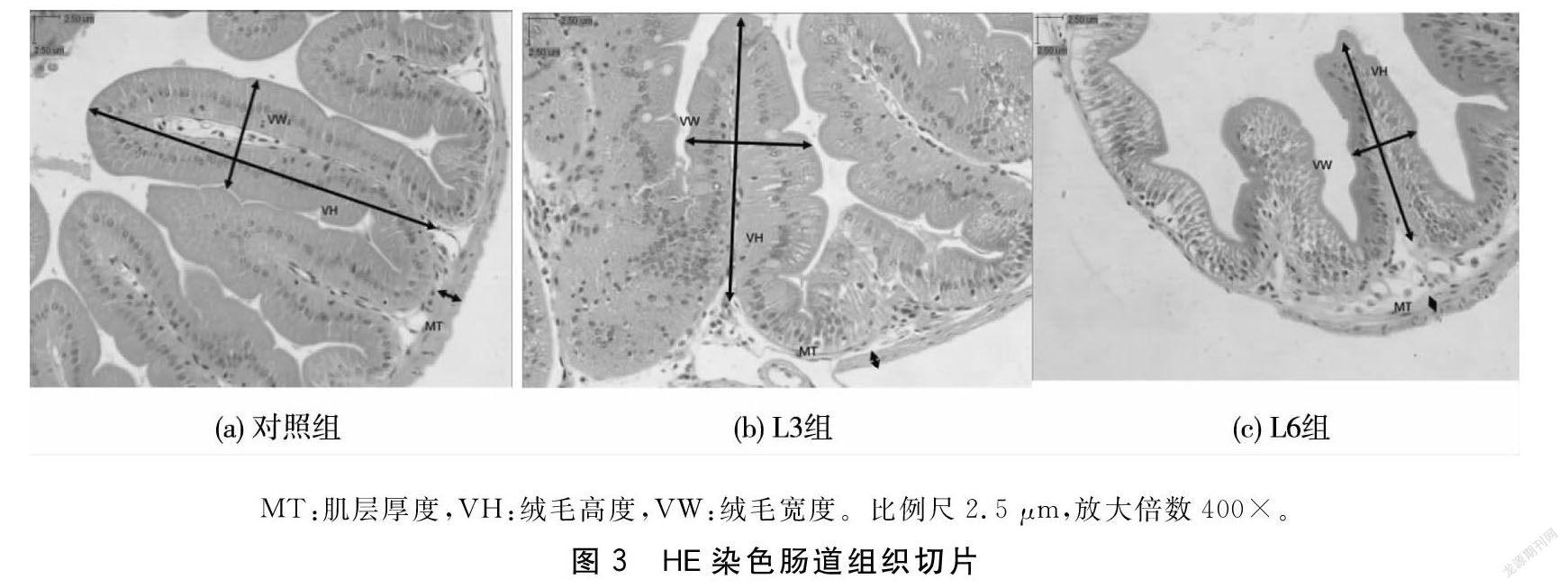
1.4.4肠道切片制作将保存于Bouin’s固定液中的肠道样本24h后转入75%酒精中脱水。后委托武汉赛维尔生物科技有限公司制作HE染色切片。使用光学显微镜(Olympuxcx23)观察,用显微测微尺测量绒毛高度、宽度和肌层厚度。
1.5数据分析
使用SPSS19.0软件对所有数据进行单因素方差分析(One—wayANOVA)。当有差异性时,用Duncan’s多重比较,设置P<0.05为差异显著。所有数据均采用平均值±标准误差表示。
2结果
2.1眼斑双锯鱼肠道消化酶结果
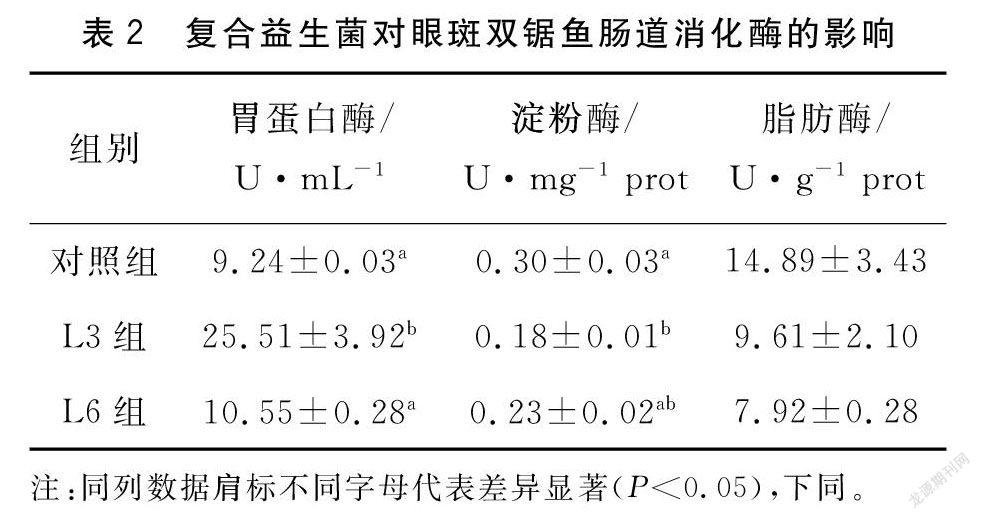
饲喂复合益生菌能提升试验鱼肠道蛋白酶活性,与对照组相比,L3组蛋白酶活性达到最高(P<0.05)。饲料中复合益生菌的补充能降低试验鱼肠道淀粉酶活性,与对照组相比,L3组试验鱼肠道淀粉酶活性显著下降(P<0.05)。随着饲料中益生菌添加量的增加,试验鱼肠道脂肪酶活性开始下降。见表2。
2.2饲喂复合益生菌对眼斑双锯鱼肠道菌群影响
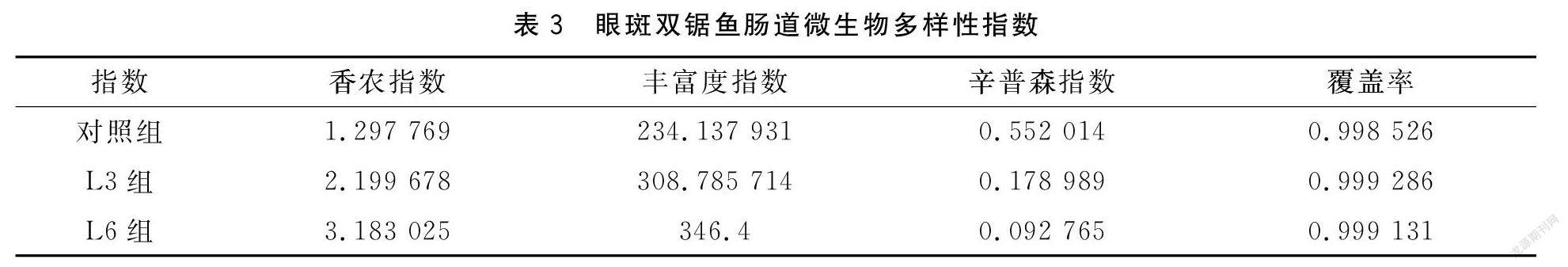
2.2.1饲料中添加不同浓度益生菌对眼斑双锯鱼肠道微生物多样性分析根据稀释曲线(图1)可以看到,逐渐趋于平缓,表明数据样本够大,测试深度足够大,测量结果合理可信。
L3、L6组的香农指数、丰富度指数比对照组高。各组覆盖深度接近1,说明测序深度足够,基本可以覆盖所有样品中所有的物种,数据可信。见表3。
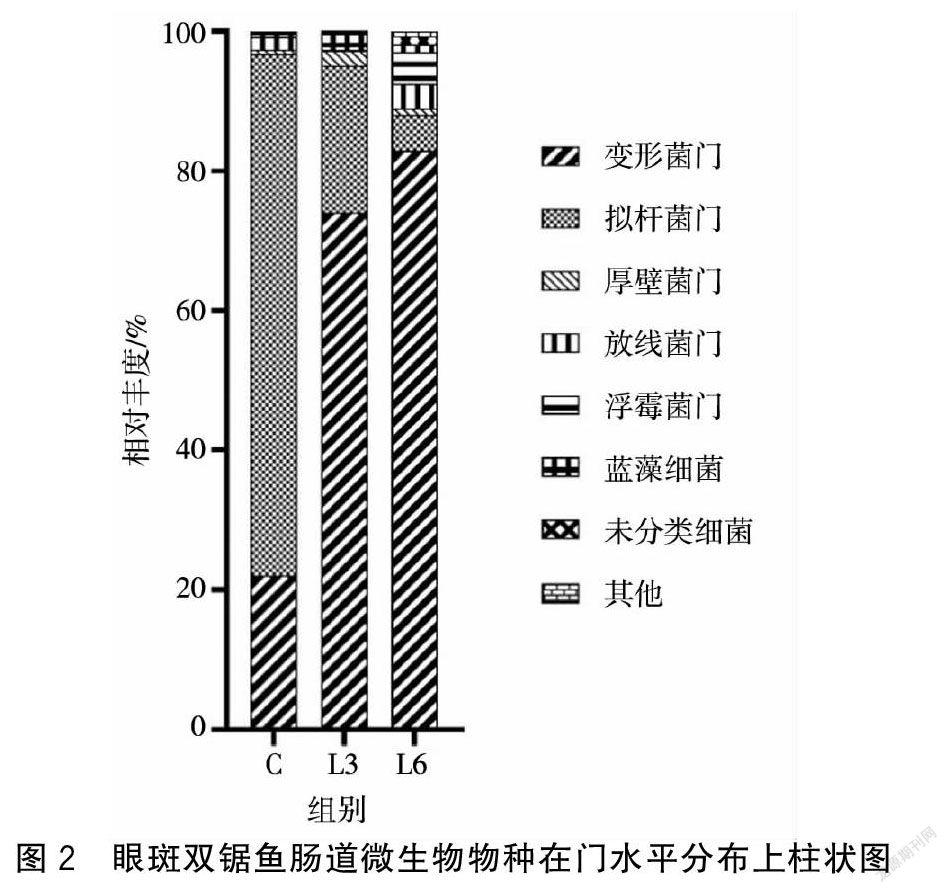
2.2.2饲料中添加不同浓度益生菌对眼斑双锯鱼肠道菌群在门水平上的组成差异由眼斑双锯鱼肠道微生物物种在门水平分布上柱状图(图2)可知,各组试验鱼肠道优势菌群主要以变形菌门、拟杆菌门为主。随着饲料中复合益生菌添加量的增加,试验鱼肠道中变形菌门相对丰度开始增多,拟杆菌门相对丰度降低。L3组试验鱼肠道厚壁菌门相对丰度相比对照组增多;拟杆菌门相对丰度在L6组试验鱼肠道降至最低,同时放线菌门相对丰度增加。2.3饲料中添加不同浓度复合益生菌对眼斑双锯鱼肠道形态结构的影响
各组试验鱼肠道肌层厚度低于对照组,L6组试验鱼肠道肌层厚度与对照组相比显著下降(P<0.05);随着饲料中益生菌添加量的增加,L3组试验鱼肠道绒毛高度与对照组相比显著上升(P<0.05),相反的是,L6组试验鱼肠道绒毛高度显著下降(P<0.05);饲料中添加益生菌对试验鱼肠道绒毛宽度没有显著影响(P>0.05)。见表4。各组肠道切片见图3。
3讨论
3.1眼斑双锯鱼肠道消化酶结果
鱼类消化酶又容易被周围环境影响而发生改变。在本试验中,饲喂复合益生菌能提升试验鱼肠道蛋白酶的活性,这与重口裂腹鱼[6]、鲤鱼[7]中的研究结果类似。
通常认为,益生菌可以通过分泌胞外酶产物,促使肠道分泌更多的消化酶。在有关复合益生菌对大菱鲆的研究中进一步发现,肠道中的蛋白酶活力主要受肠道中pH值的影响,同时DeSchrijver等[8]認为,当肠道内环境处于适宜的pH值时,蛋白酶会大量地被分泌,促进了蛋白质的消化。因此初步推测本试验中眼斑双锯鱼肠道蛋白酶活性的提高是因为复合益生菌可以通过在肠道定植来改变肠道内环境pH值,同时促进蛋白酶分泌。
然而,随着饲料中益生菌添加量的增加,肠道淀粉酶活性、脂肪酶开始下降,这与何伟聪等[4]、江永明等[9]的试验结果类似。也有部分研究表明,饲料中添加益生菌能够增加暗纹东方鲀幼鱼[10]、凡纳滨对虾[11]肠道淀粉酶的活性。由于眼斑双锯鱼是偏肉食性鱼类,这可能解释了其肠道淀粉酶活力偏低的现象[10]。此外,脂肪酶活性的下降,推测是因为饲料中的复合益生菌可以促进肠道中乳酸杆菌的增殖。据报道,乳酸杆菌的增殖可以相应地降低脂肪酶的活性[12]。
3.2眼斑双锯鱼肠道菌群结果分析
在本试验中,通过高通测序法测定各组眼斑双锯鱼肠道菌群,结果表明在各组中变形菌门和拟杆菌门都是优势菌种,这与苏鹏[13]得到的结果类似。L3组试验鱼肠道厚壁菌门丰度相比对照组增多,有研究发现,厚壁菌门与碳水化合物消化酶的分泌有一定关联,因此推测其功能与消化密不可分[14]。芽孢杆菌则是厚壁菌门的常见菌属,有研究表明,芽孢杆菌可以改善水质,降低鱼体感染细菌的概率,因此通常可以被用作水产养殖益生菌补充到水生动物体内[15]。这一结果从侧面证实本试验中添加的枯草芽孢杆菌成分已经在眼斑双锯鱼肠道中定植。
3.3眼斑双锯鱼肠道切片分析
在本试验中,各组试验鱼肠道肌层厚度均低于对照组,肌层厚度下降说明试验鱼肠道的完整性在逐渐遭到破坏[16]。随着饲料中益生菌含量的增加,试验鱼肠道绒毛高度与绒毛宽度都是先增加后减少,这与邱燕等[17]试验结果类似,表明该复合益生菌可以对试验鱼肠道产生一定的促进生长作用。试验鱼肠道绒毛高度与宽度增加时,能加大绒毛与肠道中食物的接触面积,改善试验鱼肠道的消化功能。已有研究表明,益生菌能定植在生物的肠道中,通过对细胞免疫和体液免疫的调控,改善肠道黏膜屏障的完整性,同时益生菌还可以与肠道中的微生物群达到共生的关系[18],因此推测益生菌可以促进绒毛高度和宽度的增加。
4结论
在眼斑双锯鱼饲料中添加3%复合益生菌可以有效改善其肠道消化酶活性,提高肠道厚壁菌门相对丰度,增加肠道绒毛高度与宽度。
参考文献:
[1]VELASCO-SANTAMARAY,CORREDOR-SANTAMARAW.Nutritionalrequirementsoffreshwaterornamentalfish:areview[J].RevistaMVZCordoba,2011,16(2):2458-2469.
[2]曾广厅,毛华明.观赏鱼的营养与饲料配制[J].饲料广角,2004(15):40-42.
[3]俞勇,李会荣,李筠,等.益生菌制剂在水产养殖中的应用[J].中国水产科学,2001(2):92-96.
[4]何伟聪,董晓慧,谭北平,等.益生菌对军曹鱼幼鱼生长性能、消化酶和免疫酶活性的影响[J].动物营养学报,2015,27(12):3821-3830.
[5]張书环,吴金平,褚志鹏,等.饲喂枯草芽孢杆菌对杂交鲟生长和肠道菌群结构的影响[J].海洋渔业,2021,43(1):71-80.
[6]何敏,汪开毓,张宇,等.复合微生物制剂对重口裂腹鱼生长、消化酶活性、肠道菌群及水质指标的影响[J].动物营养学报,2008,20(5):534-539.
[7]张锦华,倪学勤,何后军,等.不同益生素对鲤鱼肠道蛋白酶,淀粉酶活力的影响[J].江西农业大学学报,2005,27(4):513-516.
[8]DESCHRIJVERR,OLLEVIERF.Proteindigestioninjuvenileturbot(Scophthalmusmaximus)andeffectsofdietaryadministrationofVibrioproteolyticus[J].Aquaculture,2000,186(1-2):107-116.
[9]江永明,付天玺,张丽,等.微生物制剂对奥尼罗非鱼生长及消化酶活性的影响[J].水生生物学报,2011,35(6):998-1004.
[10]华雪铭,周洪琪,张宇峰,等.饲料中添加壳聚糖和益生菌对暗纹东方鲀幼鱼生长及部分消化酶活性的影响[J].水生生物学报,2005,29(3):299-305.
[11]李桂英,孙艳,宋晓玲,等.饲料中添加潜在益生菌对凡纳滨对虾肠道消化酶活性和菌群组成的影响[J].渔业科学进展,2013,34(4):84-90.
[12]刘淑兰,陈娟,李杰,等.复合益生菌制剂对大西洋鲑(Salmosalar)生长、消化酶和非特异性免疫指标的影响[J].渔业科学进展,2017,38(5):100-106.
[13]苏鹏.壳寡糖对红鳍东方鲀(Takifugurubripes)生长、免疫酶及肠道菌群的影响[D].大连:大连海洋大学,2016.
[14]FANZ,WUD,ZHANGYY,etal.Carbonatealkalinityanddietaryproteinlevelsaffectedgrowthperformance,intestinalimmuneresponsesandintestinalmicromicroflorainSongpumirrorcarp(CyprinuscarpioSongpu)[J].Aquaculture,2021,545(3):737135.
[15]KUEBUTORNYEFKA,ABARIKEED,LUY.AreviewontheapplicationofBacillusasprobioticsinaquaculture[J].Fish&ShellfishImmunology,2019,87(2):820-828.
[16]王健.蛙源酵母菌ZR1发酵豆粕对牛蛙生长、消化和肠道健康的影响[D].厦门:集美大学,2018.
[17]邱燕,叶元土,蔡春芳,等.酵母培养物对草鱼(Ctenopharyngodonidellus)生长性能与肠道粘膜形态的影响[J].饲料工业,2010,31(18):15-17.
[18]ASHAOLUTJ,FERN NDEZ-TOM S.Gutmucosalandadiposetissuesashealthtargetsoftheimmunomodulatorymechanismsofprobiotics[J].TrendsinFoodScience&Technology,2021,112(4):764-779.
Effectofcompoundprobioticsondigestiveenzymes,microflorastructureandmorphologyofAmphiprionocellaris
WANGLei1,WULin1,ZENGFanshuang1,RENXue1,CUIShuchang1,LIMuzi1,RENTongjun1,2
(1.CollegeofFisheriesandLifeScience,DalianOceanUniversity,Dalian116023,China;2.KeyLaboratoryofAppliedBiologyandAquacultureofNorthernFishesinLiaoningProvince,DalianOceanUniversity,Dalian116023,China)
Abstract:Inordertoinvestigatetheeffectsofcompoundprobioticsaddedindietondigestiveenzymes,florastructureandmorphologyofintestinaltractofAmphiprionocellaris,135fishwithaninitialweightof(0.79±0.01)gwererandomlydividedinto3groupswith3replicatesineachgroup.Thecompoundprobioticswereaddedindietofthefishatdifferentlevels,i.e.,0%(controlgroup),3%(groupL3)and6%(groupL6)respectivelyfora28-dayexperiment.Theresultsshowedthatcompoundprobioticscouldimprovetheactivityofintestinalproteaseinthefish,amongwhichtheintestinalproteaseingroupL3wassignificantlyincreased(P<0.05).Theamylaseactivitywasreducedsignificantlyinintestinaltractofthefish(P<0.05);Thelipaseactivitywasreducedtoo(P>0.05).Withtheincreaseofprobioticsindiet,theabundanceofProteobacteriainintestines
ofthefishincreased,whilethatofBacteroidetesdecreased.Increasedsupplementofprobioticsindietsignificantlyreducedthethicknessofintestinalmusclelayerandincreasedtheheightofintestinalvillusofthefish(P<0.05).Tosumup,theadditionof3%compoundprobioticsindietimprovedthedigestiveenzymeactivity,increasedthediversityofintestinalmicrobialcommunity,andimprovedthemorphologyandfunctionofintestineofthefish.
Keywords:Amphiprionocellaris;probiotics;digestion;nutritionalmetabolism
(收稿日期:2021-08-19)
