肉苁蓉延缓衰老功能因子及作用机制研究△
2022-02-18宋紫腾李莹曼徐旭韩彦琪张铁军许浚
宋紫腾,李莹曼,徐旭,韩彦琪,张铁军*,许浚,4*
1.天津药物研究院 天津市中药质量标志物重点实验室,天津 300301;
2.天津药物研究院 释药技术与药代动力学国家重点实验室,天津 300301;
3.天津中医药大学,天津 301617;
4.中国中药协会 药食同源物质评价和利用专业委员会,北京 100061
肉苁蓉Cistanche deserticolaY.C.Ma 为我国传统名贵中药材,被誉为“沙漠人参”,始载于《神农本草经》,列属上品。其味甘、咸,性温,归肾、大肠经,中医认为其具有补肾阳、益精血、润肠通便之效[1]。2018 年,肉苁蓉(荒漠)被列入《按照传统既是食品又是中药材物质目录》中[2],将其开发为保健产品的价值得到了认可。据统计,肉苁蓉在抗衰老延年类方剂中的出现频率仅次于人参[3]。现代药理研究表明,肉苁蓉具有显著的抗氧化、延缓衰老、抗疲劳、改善记忆力等多方面作用[4],但其延缓衰老的功能因子及作用机制尚不明确。秀丽隐杆线虫(Caenorhabditis elegans,以下简称线虫)是一种多细胞生物,遗传背景清楚、寿命相对较短、繁殖快、易培养,且随寿命的增长表现出与人类相似的衰老表型。线虫基因、蛋白、信号通路都与人类高度保守,与人类基因的同源性达60%~80%。近年来,线虫在中药及天然药物抗衰老的研究中已得到广泛应用[5]。本研究采用网络药理学方法预测肉苁蓉延缓衰老的活性成分、靶点和信号通路;以线虫为模式生物,通过观察其寿命、生殖等整体指标,测定其氧化应激、运动能力的变化及与寿命相关基因的表达情况,探索肉苁蓉延缓衰老的作用机制,为相关健康产品的开发及应用提供参考。
1 材料
1.1 仪器
SMZ-168 型体视显微镜(Motic 公司);CKX41型倒置相差荧光显微镜(Olympus 公司);Multiskan FC型酶标仪(Thermo Fisher Scientific公司);Mycycler 型聚合酶链式反应(PCR)基因扩增仪、MJ Mini™型荧光定量PCR仪(Bio-Rad公司)。
1.2 试药
肉苁蓉采收自新疆于田县荒漠肉苁蓉良好农业规范(GAP)种植基地,经天津药物研究院有限公司张铁军研究员鉴定为肉苁蓉Cistanche deserticolaY.C.Ma;2′,7′-二氯二氢荧光素二乙酸酯(DCFHDA)、2% NaN3(Sigma 公司);Trizol 试剂、cDNA合成试剂盒、SYBR Green Kit(Takara 生物工程有限公司);超氧化物歧化酶(SOD)试剂盒、过氧化氢酶(CAT)试剂盒、谷胱甘肽过氧化酶(GSHPx)试剂盒、丙二醛(MDA)试剂盒(南京建成生物科技有限公司);荧光定量聚合酶链式反应(qRTPCR)所需引物由上海生工生物工程股份有限公司合成,引物序列见表1。
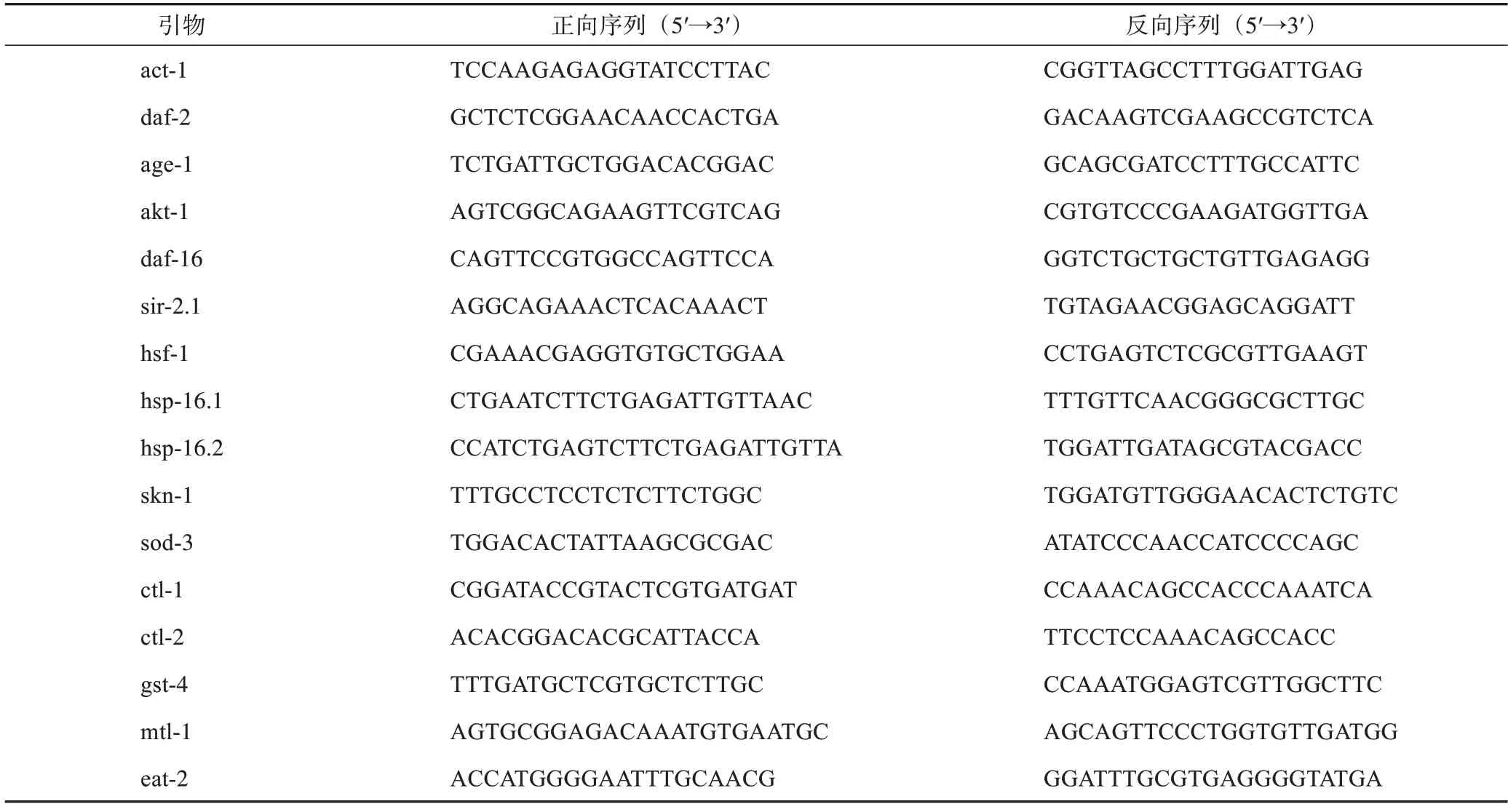
表1 qRT-PCR引物序列
1.3 线虫
实验所用10 种不同基因类型的线虫均来源于Caenorhabditis Genetics Center,具体信息见表2。

表2 线虫品系及基因型
2 方法
2.1 肉苁蓉功能因子和靶点的筛选
通过查阅文献并结合本课题组前期对肉苁蓉物质组的表征,从中筛选出主要化学成分及入血成分[6-9]。在ChemDraw 19.0 软件中绘制化合物结构,将其输入到SwissTargetPrediction 数据库(http://new.swisstargetprediction.ch/),采用反向药效团匹配方法得到虚拟筛选结果。同时利用中药系统药理数据库与分析平台(TCMSP,https://tcmsp-e.com/tcmsp.php)。使用UniProt数据库(http://www.uniprot.org/)中的UniProtKB 搜索功能及Reviewed Swiss-Prot对蛋白进行过滤,并限定物种为“human”,将化合物靶标蛋白矫正为基因名。整合2 个数据库靶点结果,得到化合物潜在作用靶点库。
2.2 衰老相关靶点的预测分析
使用GeneCards(https://www.genecards.org/)、OMⅠM(https://omim.org/)数据库,以“old、senile、decrepit、senescence、feeble、caducity”为关键词进行检索,其中GeneCards 筛选得分≥10%的基因,将2 个数据库的结果合并,剔除重复基因,最终得到衰老相关靶点。再将2.1项下功能因子作用靶点与上述衰老相关靶点合并,取交集,绘制韦恩图。
2.3 蛋白质-蛋白质相互作用(PPⅠ)网络的构建
将得到的交集靶点输入到STRⅠNG 11.5(http://string-db.org/)数据平台,将物种限定为“Homo sapiens”,交互得分最高置信度为0.900,获得PPⅠ网络。将数据保存为.TSV 格式,导入Cytoscope 3.8.0 软件,以度(degree)值调整节点大小和颜色深浅,获得肉苁蓉活性成分与疾病靶点的PPⅠ网络。选取度、介数(betweenness)、紧密度(closeness)3 个参数均大于中位数的点作为核心靶点,经筛选共得到8个核心靶点。
2.4 基因本体(GO)生物分析与京都基因与基因组百科全书(KEGG)通路富集分析
采用OmicsBean数据库(http://www.omicsbean.cn/login/),对交集靶点进行GO 功能分析和KEGG通路富集分析,依据P值进行排序,并对得到的通路进行分析。
2.5 药材-成分-靶点-通路网络构建
将药材、成分、靶点、通路导入Cytoscope 3.8.0软件,构建肉苁蓉药材-成分-靶点-通路网络。
2.6 线虫培养
线虫在20 ℃条件下,使用NGM 培养基(双蒸水250 mL 中含有NaCl 0.750 g、胰蛋白胨0.625 g和琼脂4.250 g)进行恒温培养。灭菌大肠埃希菌E.coliOP50(65 ℃,45 min)作为食物来源,均匀涂布于NGM 培养基表面。使用裂解液(5% NaClO,5 mol·L-1NaOH)进行线虫同期化处理,同期化后的线虫在20 ℃培养箱中培养至L4 期。随机挑取L4期线虫,分为对照组(NGM 培养基)、不同质量浓度肉苁蓉给药组进行实验。
2.7 药物制备
取肉苁蓉药材10 g,按照料液比1∶10 加入蒸馏水,回流提取2 次,每次2 h,合并水提液,滤过后减压浓缩至干。用灭菌蒸馏水配制成质量浓度为50 mg·mL-1(以生药量计)的母液。用NGM 培养基分别配制成终质量浓度为0、25、50、75、100、200、500 μg·mL-1的溶液,备用。
2.8 毒性实验
将N2线虫转移到含有不同质量浓度肉苁蓉(0、25、50、100、200、500 μg·mL-1)的培养皿中,每组100条。给药当天计为第0天,每天换新鲜含药培养基并记录线虫死亡情况,得到肉苁蓉的安全给药剂量范围。
2.9 应激实验
将N2线虫转移到含有不同质量浓度肉苁蓉(0、25、50、75 μg·mL-1)的培养皿中,每组100 条。给药当天计为第0 天,每天换新鲜含药培养基,给药第7 天进行应激实验。氧化应激实验中,将各组线虫转移至NGM 培养基(每10 mL NGM 培养基中添加30% H2O210 μL)中,每30 min 记录线虫存活情况。热应激实验中,将线虫持续暴露在35 ℃条件下培养,每2 h记录线虫存活情况。
2.10 身体弯曲实验
取N2 线虫,分组及给药处理同2.9项下。给药第3 天和第7 天进行身体弯曲实验,取每组20 条线虫,对30 s内线虫身体弯曲的次数进行检测记录。
2.11 咽泵实验
取N2 线虫,分组及给药处理同2.9项下,每个培养皿中各放1 条线虫,每个质量浓度设置5 个平行,给药第0、3、7 天在体式显微镜下观察线虫吞咽频率,每次跟踪观察60 s并记录其咽泵次数。
2.12 繁殖实验
取L1 期N2 线虫置于给药培养基中培养至L4 期后,每天转移至新的不同质量浓度含药培养基中,并对线虫的产卵量进行测定,将含卵的旧板置于20 ℃培养48 h 后进行子代数量的测定。每个培养皿中含有1条线虫,每个质量浓度设置5个平行。
2.13 脂褐素积累测定
取N2 线虫,分组及给药处理同2.9项下,每组100 条线虫。给药第7 天及第11 天进行脂褐素测定实验,随机选35 条线虫置于2%琼脂糖片上,用2%NaN3麻醉,使用荧光显微镜(激发光波长为360~370 nm,发射光波长为420~460 nm)观察线虫体内的蓝色自发荧光,并使用ⅠmageJ 1.51 软件量化荧光强度。
2.14 MDA、ROS含量及抗氧化酶活性测定
取N2 线虫,分组及给药处理同2.9项下,每组100条线虫。给药第7天,将每组培养基上的线虫用0.9%氯化钠溶液冲洗并收集于1.5 mL 离心管内,置于冰上匀浆,转速3000 r·min-1离心10 min(离心半径42.5 mm),离心后取上清液,用试剂盒分别测定SOD、CAT、GSH-Px的活性及MDA含量。
ROS 测定实验中,使用M9 缓冲液冲洗线虫3 次,置于终浓度为10 μmol·L-1的DCFH-DA 溶液中37 ℃黑暗孵育20 min,每5 min 摇匀1 次。随后用M9缓冲液清洗2次,将线虫置于载玻片上。使用荧光显微镜(激发光波长485 nm,发射光波长为520 nm)拍照,并使用ⅠmageJ 1.51 软件评估相对荧光强度。
2.15 衰变加速因子-16(DAF-16)、SKN-1 的核易位及SOD-3、谷胱甘肽S 转移酶-4(GST-4)、热休克蛋白-16.2(HSP-16.2)的可视化
分别采用TJ356、LG333 转基因线虫进行DAF-16、SKN-1 蛋白核易位实验。分别采用CF1553、CL2166、TJ375 转基因线虫确定SOD-3、GST-4 和HSP-16.2 蛋白的表达情况。分组与给药处理同2.9项下。给药第7 天使用荧光显微镜对各组线虫拍照,使用ⅠmageJ 1.51 软件对GFP 荧光强度进行量化。
2.16 突变体线虫寿命测定
分别采用CF1038、EU1、PS3551、DA1116 线虫进行实验,分为对照组和肉苁蓉75 μg·mL-1给药组。每天统计各组线虫的存活率。
2.17 qRT-PCR实验
将L4 期N2 线虫转移至含有不同质量浓度肉苁蓉(0、25、50、75 μg·mL-1)的NGM培养基(含150 μmol·L-1五氟尿嘧啶),20 ℃培养6 d。采用Trizol 法提取线虫总RNA,逆转录成cDNA 用于mRNA 定量。使用2-△△Ct法处理数据,act-1作为内参基因。
2.18 数据分析
3 结果
3.1 肉苁蓉潜在活性成分和作用靶点
通过查阅文献并结合本课题组前期研究,选取了包括苯乙醇苷类、环烯醚萜类和木脂素类等12 个化学成分作为网络药理学研究的目标化合物,具体信息见表3。从数据库中经去除重复后得到12 个潜在活性成分的作用靶点共86个。
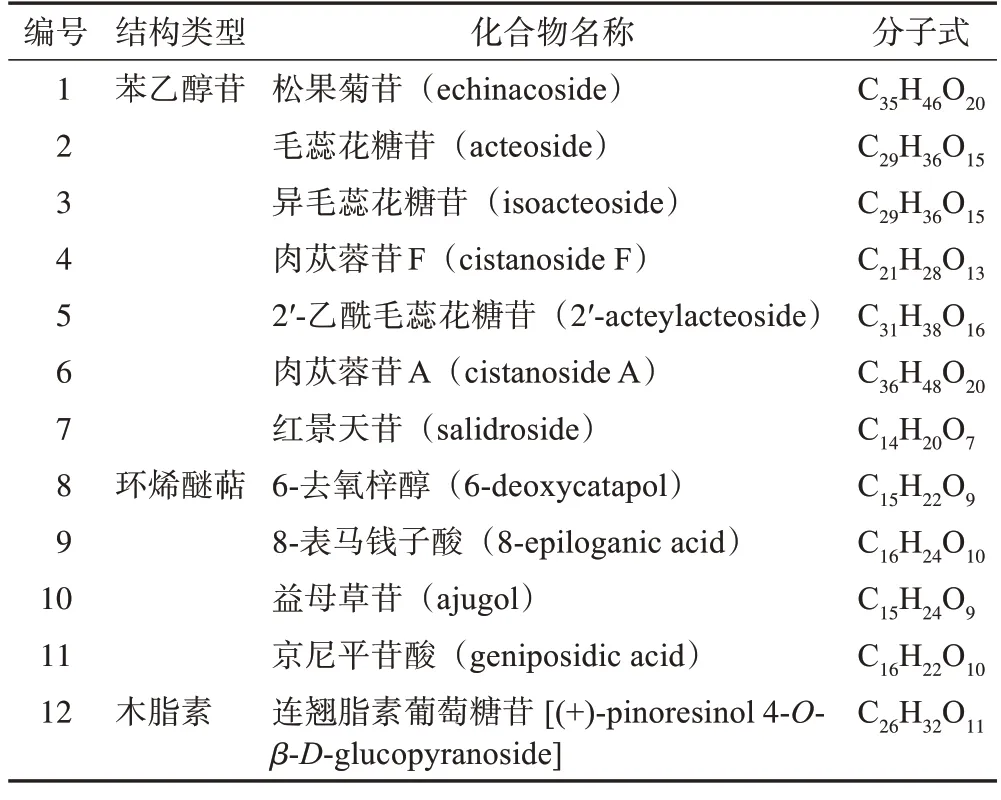
表3 肉苁蓉活性成分
3.2 衰老相关靶点
在GeneCards、OMⅠM 数据库分别收集到7753、295个与衰老相关的靶点。
3.3 药物与疾病共同靶点及PPⅠ网络构建
药物靶点与疾病靶点取交集得到75 个交集靶点,导入STRⅠNG 网络分析平台,隐去网络中未连接的节点,构建PPⅠ网络,见增强出版材料。该PPⅠ网络中共有45个节点、59条连线。经拓扑学分析筛选出8个核心靶点,见表4。

表4 肉苁蓉延缓衰老核心靶点
3.4 GO富集分析和KEGG富集分析
通过OmicsBean数据库,将核心靶点进行GO功能富集和KEGG 通路分析。GO 分析包含细胞组分(cellular component)、分子功能(molecular function)和生物过程(biological process)3个方面,P值最小的前10 个条目见增强出版材料。结果表明,生物过程主要涉及到调节活性氧代谢过程、免疫反应正调节、蛋白质定位到细胞器、多糖消化过程等;细胞组分主要包括内膜系统、胞外区、质膜、膜结合细胞器、细胞外分泌体、高尔基体等;分子功能主要与葡萄糖苷酶活性、一氧化氮合酶调节活性、碳水化合物结合、β-果糖呋喃糖苷酶活性等有关。KEGG 共富集筛选得到27条衰老相关通路,将前20条通路绘制通路气泡图(见增强出版材料),肉苁蓉延缓衰老主要涉及到癌症通路、神经分泌系统及信号传导通路。癌症通路主要包括前列腺癌(prostate cancer)、乳腺癌(breast cancer)等通路;神经内分泌系统涉及雌激素信号通路(estrogen signaling pathway)、促性腺激素释放素信号通路(GnRH signaling pathway)、胰岛素信号通路(insulin signaling pathway)等;信号传导通路有磷脂酰肌醇3-激酶-蛋白激酶B(PⅠ3KAkt)信号通路和磷脂酶D 信号通路(phospholipase D signaling pathway)。
3.5 药材-成分-靶点-通路网络构建
通过Cytoscape 3.8.0 软件将肉苁蓉延缓衰老的活性成分、靶点、通路映射到药材-成分-靶点-通路网络中。该网络中共有114 个节点、218 条线(见增强出版材料)。
3.6 肉苁蓉对线虫寿命的影响
毒性实验结果如图1 所示,与对照组比较,肉苁蓉25、50 μg·mL-1可延长线虫寿命,100 μg·mL-1无明显效果,200、500 μg·mL-1对线虫具有一定毒性,缩短了线虫的寿命。根据毒性实验结果,选择肉苁蓉给药质量浓度为25、50、75、100 μg·mL-1,测定N2 线虫寿命。结果如表5 所示,与对照组比较,肉苁蓉25、50、75 μg·mL-1组线虫寿命显著延长,因此以25、50、75 μg·mL-1进行后续实验。
表5 不同质量浓度肉苁蓉对线虫寿命的影响(,n=100)
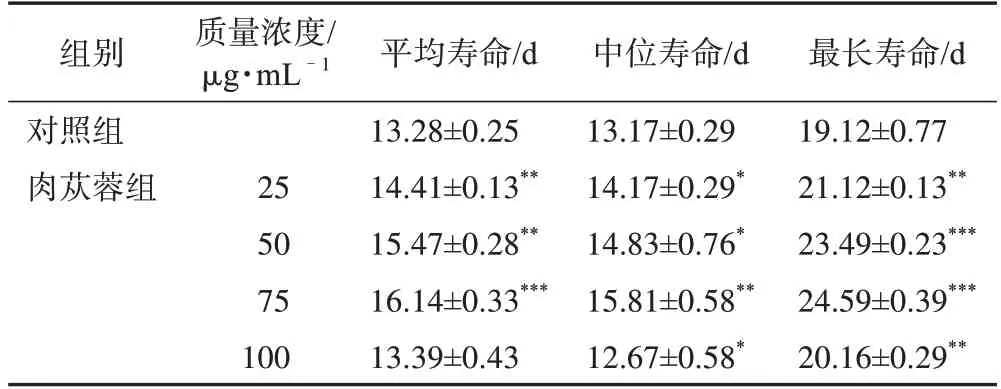
表5 不同质量浓度肉苁蓉对线虫寿命的影响(,n=100)
注:与对照组比较,*P<0.05,**P<0.01,***P<0.001。
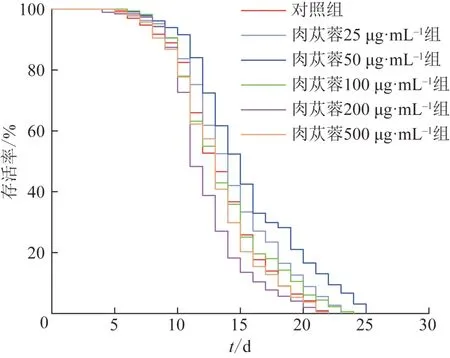
图1 不同质量浓度肉苁蓉给药后线虫的生存曲线
3.7 肉苁蓉对线虫应激能力的影响
在H2O2诱导的氧化应激条件下,与对照组比较,肉苁蓉处理组线虫寿命延长(图2A),其中对照组线虫平均寿命为(1.44±0.07)h,肉苁蓉75 μg·mL-1组线虫平均寿命为(2.02±0.05)h,寿命显著延长(P<0.001)。在热应激条件下,与对照组比较,肉苁蓉处理组线虫的抗热休克能力提升,寿命延长(图2B),其中对照组线虫平均寿命为(19.25±0.20)h,肉苁蓉75 μg·mL-1组线虫平均寿命为(22.80±0.08)h,与对照组比较寿命延长作用显著(P<0.001)。
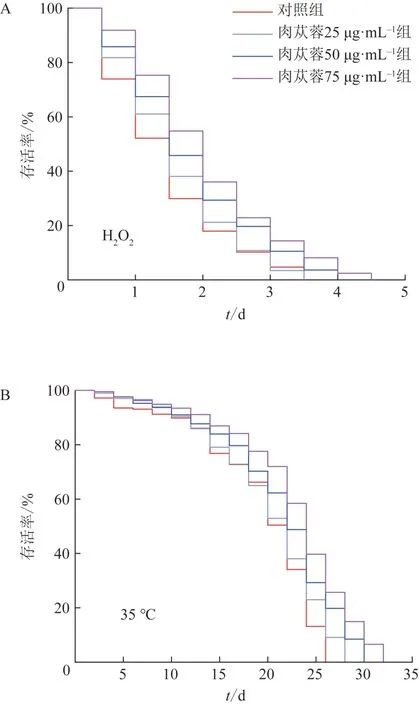
图2 应激条件下肉苁蓉对线虫寿命的影响
3.8 肉苁蓉对线虫脂褐素积累和身体弯曲能力的影响
脂褐素会随着年龄的增加而逐渐积累。与对照组比较,肉苁蓉25、50、75 μg·mL-1组线虫在第7天蓝色荧光水平分别降低了15.09%、28.67%、39.86%(图3A~B);在第11 天蓝色荧光水平则分别降低了8.55%、22.36%、36.84%,表明肉苁蓉抑制了脂褐素的积累。
肉苁蓉对线虫身体弯曲能力的影响如图3C 所示,与对照组比较,肉苁蓉75 μg·mL-1组线虫在第3 天和第7 天30 s 内身体弯曲次数分别增加了25%、36.17%,表明肉苁蓉可促进线虫身体弯曲。
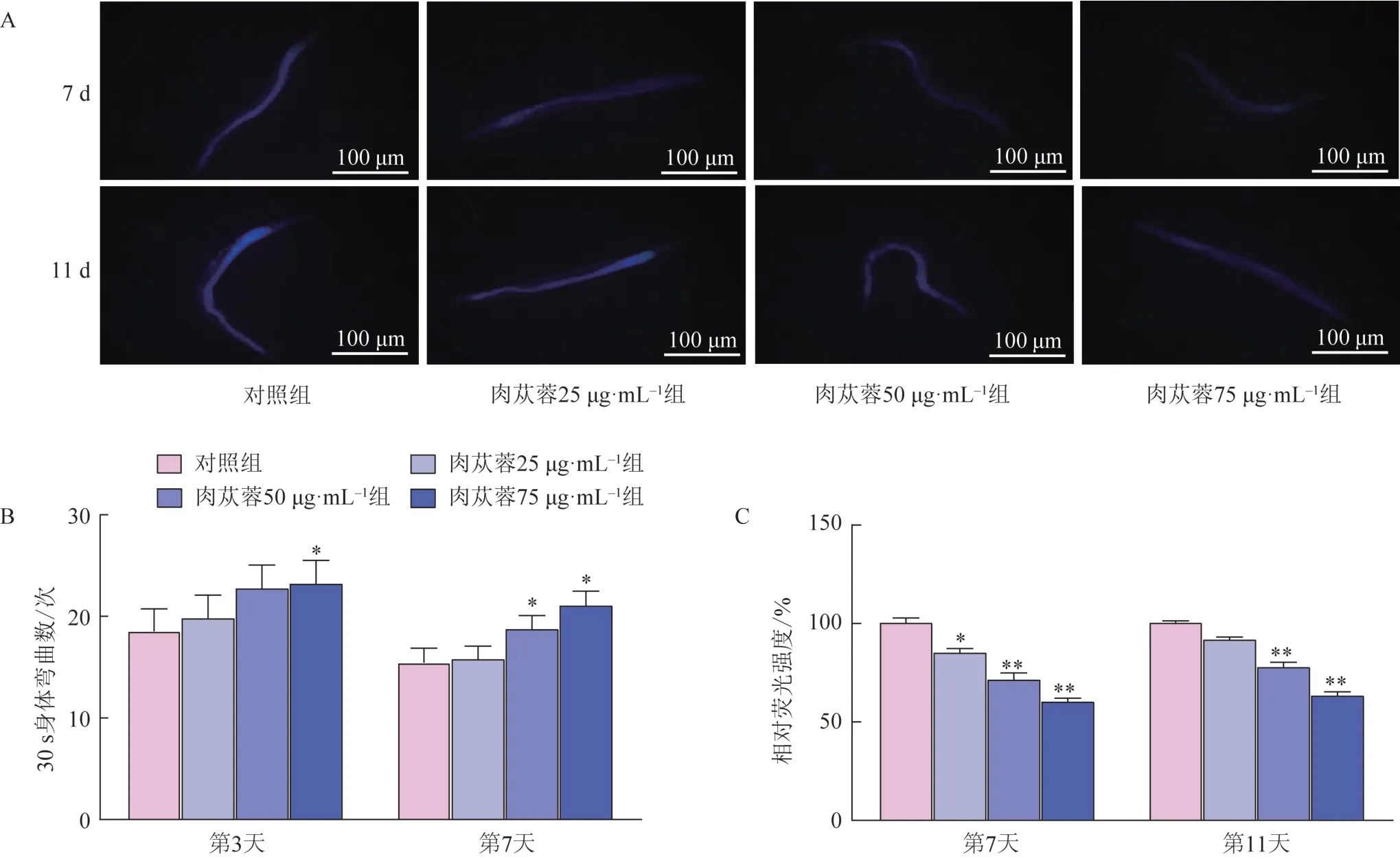
图3 肉苁蓉对线虫衰老色素积累及运动能力的影响
3.9 肉苁蓉对线虫吞咽能力及繁殖能力的影响
在第3天和第7天,与对照组比较,肉苁蓉给药组线虫咽部泵送率(60 s 内咽泵次数)差异无统计学意义(图4A),表明肉苁蓉并没有改变N2 线虫的食物摄入量,肉苁蓉介导的长寿作用并不依赖于饮食限制。给药处理线虫产卵量(图4B)和子代数(图4C)与对照组相比无明显变化,表明肉苁蓉并未对线虫的繁殖能力产生影响。
图4 肉苁蓉对线虫吞咽能力及繁殖能力的影响(,n=5)
3.10 肉苁蓉对ROS、MDA含量及抗氧化酶活性的影响
急性应激毒性会导致ROS 水平的升高。如图5A、5B 所示,与对照组比较,给药第7 天肉苁蓉组线虫ROS 积累水平显著降低(P<0.05,P<0.01,P<0.001)。为探究肉苁蓉对线虫内源性抗氧化防御能力的影响,测定了线虫体内抗氧化酶的活性。与对照组比较,肉苁蓉25、50、75 μg·mL-1组线虫SOD、CAT、GSH-Px 活性显著升高(图5C~E)。MDA 是脂质过氧化的重要生物标志物,与对照组比较,肉苁蓉75 μg·mL-1组线虫体内MDA 水平显著降低(P<0.05,图5F)。以上结果表明,肉苁蓉可以有效缓解线虫的氧化应激。
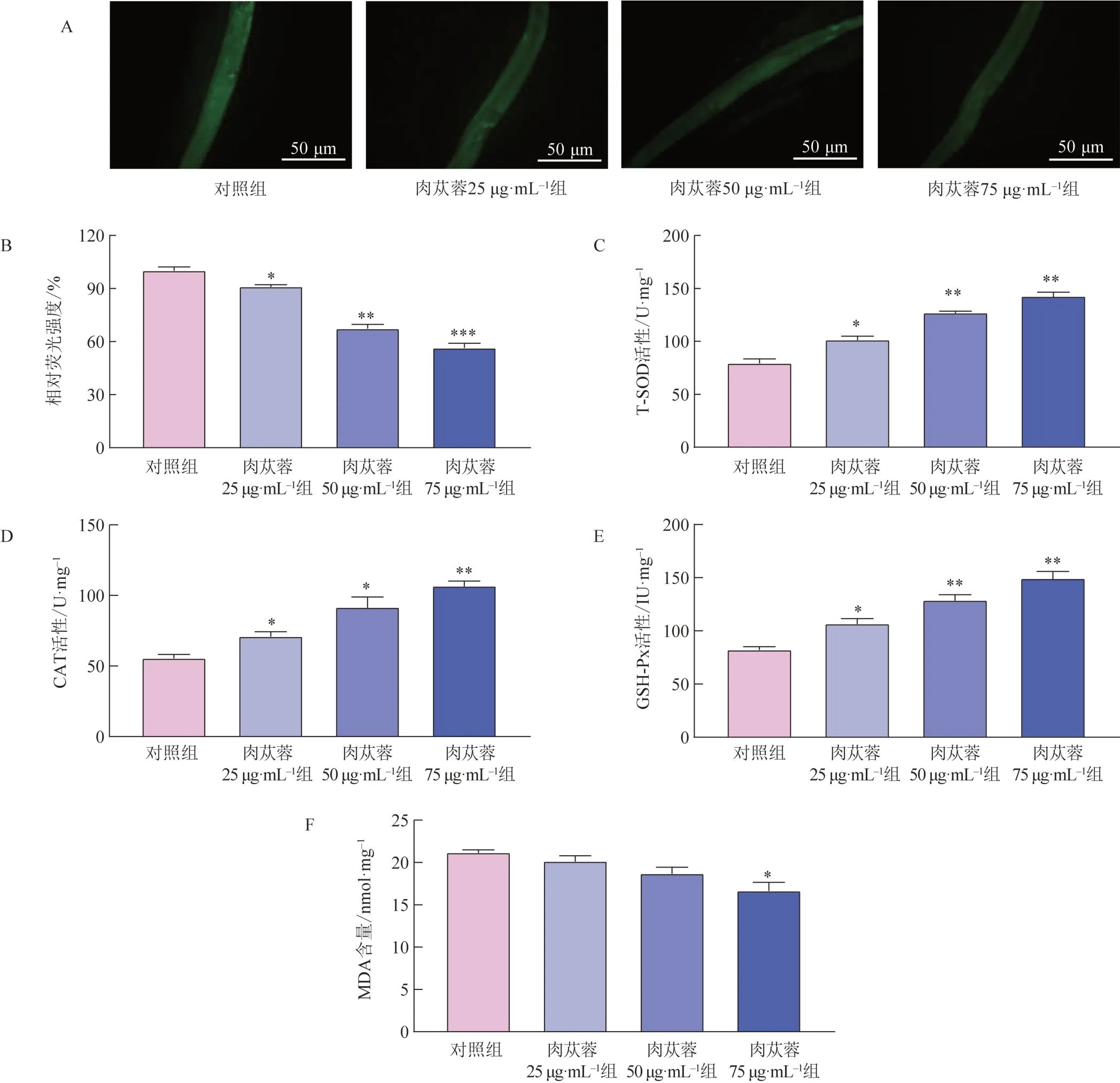
图5 肉苁蓉对线虫ROS、MDA含量及抗氧化酶活性的影响(,n=100)
3.11 肉苁蓉对衰老相关基因mRNA表达的影响
KEGG 分析前20 条通路中的胰岛素(ⅠⅠS)信号通路与线虫衰老密切相关,且机制研究相对较成熟[10],因此验证了胰岛素信号通路上与衰老相关基因的表达。线虫体内释放的胰岛素样肽(ⅠLPs)与其受体DAF-2 结合后激活晚期糖基化终末产物-1(AGE-1),进一步激活蛋白激酶B-1/2(Akt-1/2),使得转录因子DAF-16 磷酸化,导致DAF-16 活性及其向细胞核迁移的行为受到抑制[11]。如图6所示,与对照组 比 较,肉苁蓉75 μg·mL-1组 线 虫DAF-2、AGE-1、Akt-1 mRNA 表达水平显著降低(P<0.05,P<0.01),DAF-16 mRNA 表达水平显著升高(P<0.01)。表明肉苁蓉介导的延寿作用依赖于ⅠⅠS 信号通路。sir-2.1基因在线虫衰老、应激及凋亡等生理活动中均具有重要的作用,上调sir-2.1基因的表达会延长线虫的寿命[12],但给药处理后并未显著改变SⅠR-2.1 mRNA 的表达水平(图6)。HSF-1、SKN-1对线虫的氧化应激和衰老起重要调控作用[11]。结果表明,与对照组比较,肉苁蓉75 μg·mL-1组线虫HSF-1、HSP-16.1、HSP-16.2、SKN-1 mRNA 表达水平显著提高(图6)。
转录因子DAF-16/叉头盒蛋白(FOXO)和SKN-1/核转录因子E2相关因子2(Nrf2)被激活,可调节许多编码抗氧化相关蛋白的基因[13]。与对照组比较,肉苁蓉75 μg·mL-1组线虫SOD-3、GST-4、CTL-1、CTL-2、MTL-1 mRNA 的表达水平显著上调,表明肉苁蓉可能通过增强抗氧化能力来延长寿命。饮食限制法能够通过限制食物摄入来改善线粒体功能,延长寿命[14]。各组线虫EAT-2 mRNA 的表达差异无统计学意义,表明肉苁蓉介导的延寿作用并不通过饮食限制途径(图6)。
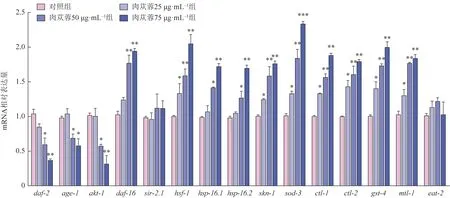
图6 肉苁蓉对衰老相关基因mRNA表达的影响(,n=100)
3.12 肉苁蓉对相关基因突变体线虫寿命的影响
与对照组比较,肉苁蓉75 μg·mL-1组daf-16、skn-1、hsf-1基因突变体线虫在给药处理后寿命曲线并未发生显著右移(图7A~C),而eat-2基因突变体线虫平均寿命增加了16.45%(P<0.001,图7D)。结果表明,肉苁蓉介导的延寿作用与daf-16、hsf-1和skn-1基因相关,但与eat-2基因无关。
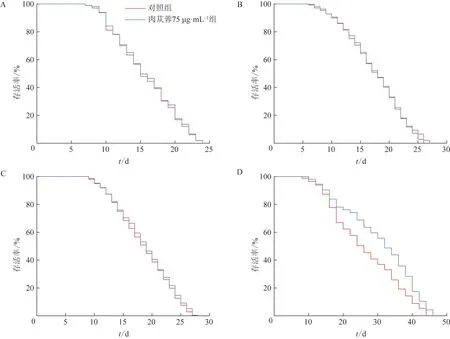
图7 肉苁蓉对衰老相关转基因突变体线虫寿命的影响
3.13 肉苁蓉对DAF-16、SKN-1蛋白核易位的影响
DAF-16蛋白分别在细胞质、细胞间和细胞核中表达的代表性图片见图8A。与对照组比较,肉苁蓉给药后线虫体内DAF-16蛋白在细胞核定位比例显著升高,细胞质定位比例显著降低(P<0.05,P<0.01,P<0.001,图8C)。SKN-1 蛋白分别在细胞质、细胞核表达的代表性图片见图8B。与对照组比较,肉苁蓉75 μg·mL-1组线虫体内SKN-1 蛋白在细胞质定位比例显著降低,细胞核定位比例显著升高(P<0.05,图8D)。
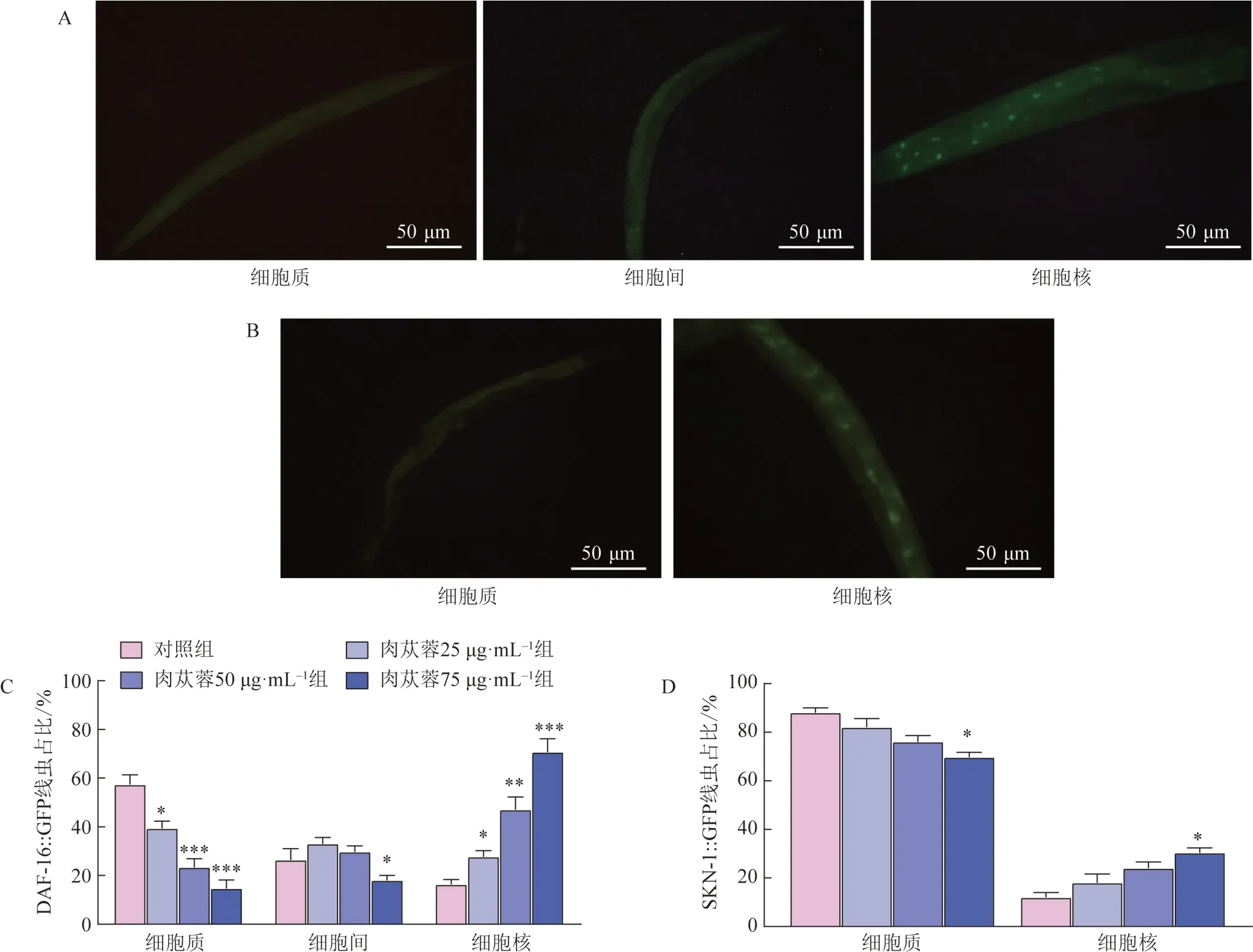
图8 肉苁蓉对DAF-16和SKN-1从细胞质向细胞核易位的影响
3.14 肉苁蓉对线虫SOD-3、GST-4、HSP-16.2 蛋白表达的影响
利用CF1553、CL2166 和TJ375 转基因线虫分别对SOD-3、GST-4 和HSP-16.2 蛋白表达水平进行可视化和定量(图9)。与对照组比较,肉苁蓉各质量浓度组线虫SOD-3、GST-4 蛋白表达水平均显著提高(P<0.05,P<0.01,P<0.001)。肉苁蓉50、75 μg·mL-1组线虫HSP-16.2 蛋白表达水平显著提高(P<0.01,P<0.001)。

图9 肉苁蓉对线虫SOD-3、GST-4和HSP-16.2蛋白表达的影响
4 讨论
随着我国人口老龄化程度加剧,探究抗衰老机制并开发延缓衰老的健康产品至关重要。中药具有不良反应小、整体均衡调节的优势,在抗衰老研究中发挥着独特的作用[15]。衰老属中医“虚劳”范畴,与五脏内伤密切相关,其根本原因是肾气亏虚、肾精不固,病位主要在肾,与脾胃虚衰关系密切。肾为先天之本,脾为后天之本,因此中医认为通过补脾益肾可以起到延年益寿、防病抗衰老的作用[16]。随着现代医学的发展,针对衰老机制的相关研究日益增多,出现了自由基学说、端粒学说、DNA 损伤修复学说、免疫衰老学说、内分泌学说等,其中自由基学说受到广泛认可[17]。中医指出,肾虚的本质涉及多个衰老学说。肾虚患者体内存在自由基损伤且身体免疫功能紊乱,同时还存在神经内分泌功能失调。可见,肾虚实质涉及自由基损伤学说、免疫功能下降学说和神经内分泌功能失调学说等关于衰老的机制。多项研究表明,抗衰老中药可通过提高体内抗氧化酶活性、清除过剩的ROS 抑制氧化应激反应,保护细胞免受氧化损伤,达到延缓衰老的目的[18-19]。
肉苁蓉归肾经,功效为补肾阳、益精血,《神农本草经疏》 记载:“肉苁蓉为滋肾补精血之要药”[20]。目前对肉苁蓉延缓衰老的研究多集中在糖类、苯乙醇苷类成分对D-半乳糖致衰老大鼠模型的保护作用。其中肉苁蓉多糖主要是通过抗氧化、改善学习记忆力、增强免疫功能和端粒酶活性等起到延缓衰老作用;肉苁蓉总苷主要通过抗氧化、减少脑损伤和调节机体免疫力等功能起作用;苯乙醇苷类物质中的松果菊苷可通过ROS 信号通路、饮食限制信号通路和胰岛素/胰岛素样生长因子信号通路延长线虫的寿命[21]。肉苁蓉延缓衰老的功能已经得到证实,但其作用机制研究尚不充分。
本研究中网络药理学结果表明,红景天苷和6-去氧梓醇可能通过作用于ⅠⅠS 通路上的HRAS、HK2和甲状腺激素通路上的HRAS、ESR1,共同调节线粒体功能、减少胰岛素抵抗,进而发挥延缓衰老作用[22];有报道称抑制Ras/Raf/MEK/ERK 和Ras/PⅠ3K/PTEN/Akt/mTOR 途径可以延缓细胞衰老[23],毛蕊花糖苷、肉苁蓉苷F、异毛蕊花糖苷、2′-乙酰毛蕊花糖苷、连翘脂素葡萄糖苷、红景天苷可能作用于HSP90AA1、ESR1 共 同 调 节PⅠ3K/Akt/mTOR[24-25],红景天苷可能通过作用于HRAS 调节PⅠ3K/Akt/mTOR、Ras/Raf/MEK/ERK 和Ras/PⅠ3K/PTEN/Akt/mTOR[23],2′-乙酰毛蕊花糖苷可作用于F2 调节MMP-2[26],松果菊苷、毛蕊花糖苷、肉苁蓉苷F、异毛蕊花糖苷、2′-乙酰毛蕊花糖苷、肉苁蓉苷A、红景天苷与MMP2 结合,从而调节c-Raf/MEK/ERK和ERK/MAPK 通路[27],以上化合物均可能通过抑制癌症信号通路从而延缓衰老;磷脂酶D(PLD)下调可刺激人体细胞中ROS 的积累从而加速细胞衰老,这被广泛认为在衰老中起重要作用,红景天苷和2′-乙酰毛蕊花糖苷可能分别作用于HRAS 和F2,通过激活RAS、cAMP 通路共同上调PLD,从而降低ROS 的堆积延缓衰老[28]。以上结果显示HRAS 基因在抗衰老相关信号通路中发挥了重要作用,且KEGG 通路分析显示,HRAS 是人类寿命相关信号通路ⅠGF-1/PⅠ3K/Akt/FoxO 中的一个关键基因,为后续利用线虫进行体内实验验证提供了依据。
衰老的自由基学说表明,氧化应激机制是导致人体衰老的重要机制,也是当前中药延缓衰老的研究重点[29-30]。正常情况下,机体体内自由基处于平衡状态,抗氧化防御系统一旦遭到破坏,产生的过量ROS 使氧化还原反应处于渐进氧化状态,导致脂质过氧化,攻击细胞膜、DNA 和蛋白质,导致其变性、损伤,加速衰老及相关疾病的发生[31]。本研究结果表明,肉苁蓉能明显提高线虫体内抗氧化酶SOD、CAT、GSH-Px 的活力并降低ROS 的水平和MDA 的积累,进而改善过氧化氢导致的氧化应激,此外还能有效缓解线虫的热应激,显著抑制脂褐素的积累并增强线虫的身体弯曲能力,延长其寿命。
线虫的ⅠⅠS信号通路与其生长、发育、寿命及代谢息息相关,是第一个被研究出与衰老相关的信号通路[32],且与人类寿命ⅠGF-1/PⅠ3K/Akt/FOXO 通路同源[33]。线虫体内的胰岛素信号受体为DAF-2,位于细胞膜上。当活性物质激活DAF-2 受体时,可以使PⅠ3K的同源物AGE-1活化,AGE-1产生的第二信使可以促使下游的Akt 被激活,进而磷酸化转录因子DAF-16。磷酸化的DAF-16 不能进入细胞核发挥转录调节功能。因此抑制DAF-2,其对DAF-16的负调控作用解除,DAF-16进入细胞核发挥转录调节功能,并与细胞核中的其他因子相互作用,包括SⅠR-2.1、HSF-1 和SKN-1,使得线虫寿命延长[34]。线虫Nrf家族转录因子SKN-1是机体对氧化应激反应的重要组成部分。ⅠⅠS 信号转导通路可直接抑制SKN-1,这一过程与DAF-16类似,ⅠⅠS通路上的Akt-1、Akt-2和SGK-1 都可以通过磷酸化SKN-1 进而抑制SKN-1的活性[35]。线虫体内实验研究结果表明,肉苁蓉可以通过下调ⅠⅠS 通路,即降低daf-2、age-1和akt-1基因的表达水平,从而降低DAF-16 及SKN-1 的磷酸化水平,并促进其核易位,进而上调下游抗氧化相关蛋白基因与热休克相关基因的表达水平,最终使线虫延长寿命,减缓衰老。
综上,本研究以肉苁蓉中潜在功能因子为研究对象,应用网络药理学解析药材-成分-靶点-通路的复杂网络关系,分析得到其延缓衰老可能的作用靶点和通路,根据预测结果进一步利用线虫体内实验验证肉苁蓉延缓衰老的作用机制,结果表明肉苁蓉能明显延长线虫寿命,抑制衰老色素积累并改善线虫因衰老引起的运动能力下降,通过增强线虫抗氧化系统有效抵抗热应激及氧化应激造成的自由基损伤。肉苁蓉介导的延寿作用机制可能是通过ⅠⅠS信号通路下调daf-2,age-1,上调daf-16及其下游靶基因(sod-3、mtl-1、gst-4、ctl-1和ctl-2),同时激活skn-1和热休克相关基因(hsf-1、hsp-16.1和hsp-16.2)的表达来实现的。
