赭曲霉毒素A降解酶Af-OTd的酶学性质分析
2022-02-18王文杰
宋 佳,范 寰,闫 雪,王文杰,赵 晨*
(1 国家粮食和物资储备局科学研究院 粮食储运国家工程研究中心 北京 100037 2 天津市畜牧兽医研究所 天津 300381 3 新希望六和股份有限公司 农业农村部饲料及畜禽产品质量安全控制重点实验室 成都 610023)
赭曲霉毒素包括7 种结构类似的化合物,其中分布最广,毒性最大,对农产及食品污染最严重,对人类健康影响最大的是赭曲霉毒素A(Ochratoxin A,OTA)[1]。OTA 主要由赭曲霉、青霉、炭黑曲霉等霉菌产生的次级代谢产物[2],常见于霉变谷物、饲料、咖啡豆、坚果、葡萄等食品中[3-6],物理和化学性质极其稳定,在产品中很难将其去除或降解[7]。OTA 具有强烈的肾毒性[8]、肝毒性[9]、免疫毒性[10]、致畸性[11]和致癌性[12],是继黄曲霉毒素后又一个引起世界广泛关注的真菌毒素。开发高效环保的脱毒方法,减少或脱除食品及其原料中的赭曲霉毒素A,对提高粮食及食品质量,保障国民食品安全具有重要意义。
生物脱毒主要是通过生物吸附或酶促反应降解毒素或修饰毒素分子结构而达到脱毒的目的,与物理、化学脱毒方法相比,具有特异性强、高效等优点[13],目前已成为脱毒领域的研究热点。据相关文献报道,许多微生物如细菌、酵母菌、丝状真菌以及一些蛋白酶能够吸附或降解OTA[14]。其中降解OTA 的过程中可能涉及两条途径:(1) 通过水解酰胺键生成L-β-苯丙氨酸和OTα 两种无毒水解产物;(2) 通过内酯环的水解而降解OTA,最终降解产物为开环的OTA 内酯(OP-OTA),与OTA 具有相似的毒性,前者通常被认为是真正的解毒途径[15]。羧肽酶是最早发现的能够降解OTA 为无毒产物的一种酶[16],除此之外,某些过氧化物酶、蛋白水解酶、脂酶都被发现可以降解OTA[17-18]。
本实验室前期从粪产碱菌中鉴定出一种酰胺水解酶(WP_123049291.1),可高效降解OTA,命名为Af-OTd。本研究将af-OTd 基因在大肠杆菌BL21(DE3)中克隆、表达和纯化,并探究温度、pH、酒精含量、金属离子等条件对重组表达后的Af-OTd 的酶活性的影响。
1 材料与方法
1.1 材料与试剂
粪产碱菌、蛋白表达菌株大肠杆菌(E.coli)BL21(DE3)、表达载体pET28a(+),由本实验室保存;OTA 标准品,青岛普瑞邦生物工程有限公司;LA Taq 酶,Takara 生物工程有限公司;Nco Ⅰ、Xho Ⅰ、T4 连接酶,NEB 生物工程有限公司;质粒提取试剂盒、胶回收试剂盒,天根生化科技有限公司。
1.2 仪器与设备
Gene Explorer PCR 仪,杭州博日科技有限公司;凝胶成像仪、AKTApurifier 蛋白快速纯化系统,美国GE 公司;LC-10Avp plus 高效液相色谱仪,日本岛津公司;低温冷冻离心机,美国Beckman 公司。
1.3 方法
1.3.1 重组质粒pET28a(+)-Af-OTd 的构建 根据NCBI 序列信息,设计引物Af-OTd-F:CAGTC CATGGATGGGCGCCAGTAATCCCATGATG,Af-OTd-R:CAGTCTCGAGCGGCTTTTTGTTCTCCATC。以粪产碱菌基因组为模板扩增目的基因,纯化后的DNA 片段和pET28a (+) 质粒分别进行NcoⅠ,Xho Ⅰ双酶切,胶回收正确片段进行T-4 ligase 连接及电转化,完成pET28a(+)-Af-OTd 重组载体的构建并转化至E.coli BL21(DE3)感受态细胞中,测序结果正确的阳性克隆子用于下一步的蛋白诱导表达。
1.3.2 Af-OTd 降解酶的诱导表达 将1.3.1 节测序结果正确的pET28a(+)-Af-OTd 阳性克隆子接种于5 mL LB 液体培养基(kan+质量浓度:50 μg/mL) 中,37 ℃,180 r/min 培养16 h 进行活化。以1%的比例转种于200 mL 含有相同抗性的LB 液体培养基中,37 ℃,180 r/min 培养至OD600nm=0.6~0.8。将菌液分装为4 等份于300 mL 摇瓶中,每份40 mL,并 按终浓度0,0.1,0.4,1 mmol/L 添加IPTG,置于25 ℃,180 r/min 过夜诱导表达Af-OTd蛋白。离心收集菌体并用Binding Buffer(20 mmol/L NaH2PO4,0.5 mol/L NaCl,40 mmol/L 咪唑;pH=7.4) 洗涤菌体2 次,10 mL Binding Buffer缓冲液重新悬浮菌体后于冰上超声破碎。将充分破碎后的菌液4 ℃,12 000 r/min 离心30 min 去除细胞碎片,取上清离心,再次取上清经0.22 μm 滤膜过滤,得Af-OTd 粗酶液。
通过AKTA 蛋白纯化系统纯化胞内蛋白:用Binding Buffer 平衡Ni+层析柱后,Elution Buffer(20 mmol/L NaH2PO4,0.5 mol/L NaCl,500 mmol/L Imidazole;pH=7.4)洗脱目标蛋白,根据洗脱峰收集纯化后的蛋白液。将所收集的蛋白液倒入超滤离心管 (3 ku,Millipore) 中,4 ℃,5 000×g 离心3 h,截留的上清液用保存缓冲液(20 mmol/L Tris-HCl,50%甘油;pH=7.4)重悬,-80 ℃保存,用于后续酶活测定。
1.3.3 Af-OTd 降解酶降解OTA 活性测定 取上述酶液990 μL 加入10 μL OTA 储备溶液(甲醇∶乙腈=1∶1 溶解OTA 标准品,配成1 mg/mL 的标准储备液),37 ℃分别反应15 min 和30 min 时取样,HPLC-FLD 检测OTA 浓度。色谱柱:C18 柱,柱长150 mm×4.6 mm;流动相:乙腈∶水∶冰乙酸= 96∶102∶2;流速:1.0 mL/min;进样量:20 μL;检测波长:激发波长333 nm,发射波长460 nm。

1.3.4 温度对降解酶Af-OTd 酶活性的影响 以OTA 降解率测定的方法为基础,设定反应温度为30,40,50,60,70 ℃。反应体系1 000 μL:990 μL酶液+10 μL OTA 储备液。将反应体系混匀后于不同温度下反应15 min 后加入等体积的流动相终止反应。检测OTA 的残留量,计算OTA 的降解率,确定最佳反应温度。
1.3.5 pH 对降解酶Af-OTd 酶活性的影响 以OTA 降解率测定的方法为基础,设定反应pH 值为6.0,6.5,7.0,7.5,8.0。反应体系1 000 μL:990 μL 酶液+10 μL OTA 储备液。将反应体系混匀后于最适温度下反应15 min 后加入等体积的流动相终止反应。检测OTA 的残留量,计算OTA 的降解率,确定最佳反应pH 值。
1.3.6 酒精含量对降解酶Af-OTd 酶活性的影响 以OTA 降解率测定的方法为基础,设定反应酒精含量为0%,2%,4%,6%,8%。反应体系1 000 μL:910 μL 酶液+80 μL 不同浓度酒精+10 μL OTA 储备液。将反应体系混匀后于最适温度和最适pH 条件下反应15 min 后加入等体积的流动相终止反应。检测OTA 的残留量,计算OTA 的降解率,确定酒精含量对酶活的影响。
1.3.7 金属离子及EDTA 对降解酶Af-OTd 酶活性的影响 选取对蛋白酶具有影响作用的常见金属阳离子Ca2+,Co2+,Cu2+,Mg2+,Mn2+,Zn2+,K+及金属螯合剂EDTA,加入下述反应体系中,使其终浓度为1 mmol/L。反应体系1:980 μL 酶液+10 μL 100 mmol/L 金属离子/EDTA 溶液+10 μL OTA 储备液。反应体系2:980 μL 酶液+5 μL 200 mmol/L金属离子溶液+5 μL 200 mmol/L EDTA 溶液+10 μL OTA 储备液。将反应体系混匀后于最适温度和最适pH 条件下反应15 min 后加入等体积的流动相以终止反应。检测OTA 的残留量,计算OTA的降解率,初步确定金属离子对酶活的影响。
2 结果与分析
2.1 Af-OTd 降解酶的表达与纯化
通 过signalP 5.0(http://www.cbs.dtu.dk/services/SignalP/)分析,Af-OTd 具有信号肽。为获得胞内表达Af-OTd,设计引物扩增除信号肽外序列,并将信号肽后第一位氨基酸谷氨酰胺(CAA)替换为甘氨酸 (GGC),C 端与6xHis 标签融合表达。通过PCR 扩增后得到的特异性目的基因条带与pET28a(+)连接,成功构建pET28a(+)-Af-OTd重组质粒,将质粒转入E.coli BL21(DE3)中,对阳性克隆测序验证,测序正确的重组菌株用于后续蛋白的表达纯化。
重组菌株菌液分别以0,0.1,0.4,1 mmol/L 的IPTG 诱导,胞内蛋白进行SDS-PAGE 凝胶检测,结果如图1a 所示,1~6 泳道均在45 ku 附近出大小与预期相符的蛋白条带,其中1、3、5 泳道(经IPTG 诱导)条带比2、4、6 泳道(未经IPTG 诱导)条带颜色更深,说明Af-OTd 基因在E.coli BL21(DE3)中成功表达,且IPTG 终浓度0.4 mmol/L 为蛋白最适诱导浓度。

图1 Af-OTd 蛋白SDS-PAGE 凝胶电泳图Fig.1 SDS-PAGE gel electrophoresis of Af-OTd protein
2.2 Af-OTd 降解酶酶活性的分析
按1.3.3 节反应体系加入Af-OTd 纯化后酶液和10 μL OTA 储备液,OTA 终质量浓度达到10 μg/mL。反应时间2 min 时,HPLC 测定结果如图2b 所示,与图2a 相比,保留时间在8 min 左右的OTA 峰明显缩小,经计算,OTA 降解率超过60%。同时,在保留时间4.5 min 左右出现新峰,根据文献[19]所述,该峰为降解产物OTα。当反应时间延长至15 min 时,OTA 被Af-OTd 完全降解,该结果说明,纯化的Af-OTd 具有高效的OTA 降解活性。

图2 HPLC 检测不同反应时间OTA 的色谱图Fig2 HPLC Chromatograms of OTA for different reaction times
为利于后续酶学特性试验结果分析,将Af-OTd 酶液用保存缓冲液按照200,400,600,800,1 000 的倍数对酶液进行稀释,置于相同反应体系中,在反应时间为15 min 和30 min 时,分别加等体积的流动相终止反应。OTA 降解率结果如图3所示,当Af-OTd 稀释600 倍,反应时间15 min时,OTA 降解率未到95%,此时,在HLPC 色谱图中便于观察OTA 含量;反应时间30 min 时,OTA降解率接近100%,该稀释度利于对酶活在一定反应时间内进行检测,故后续试验使用稀释600 倍的Af-OTd,取样时间定为15 min。
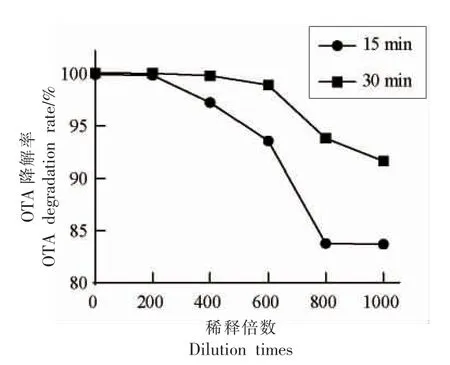
图3 不同稀释倍数对Af-OTd 酶活性的影响Fig.3 Effects of different dilution times on Af-OTd enzyme activity
2.3 温度对降解酶Af-OTd 酶活性的影响
Af-OTd 产生菌生存环境在30 ℃,本研究通过检测Af-OTd 在不同温度下的降解活性,确定其最适酶活温度。由图4可知,随着温度的升高,降解酶Af-OTd 对OTA 降解率逐渐升高,当反应温度为50 ℃时,OTA 降解率达99%,温度继续升高,OTA 降解率则呈下降趋势,故50 ℃为Af-OTd降解OTA 的最适温度。当高于50 ℃时,Af-OTd活力开始下降,在70 ℃时,OTA 降解率依然可以保持在60%左右,说明高温可能使酶分子表面构象发生变化,而Af-OTd 已具有较好的耐高温能力。
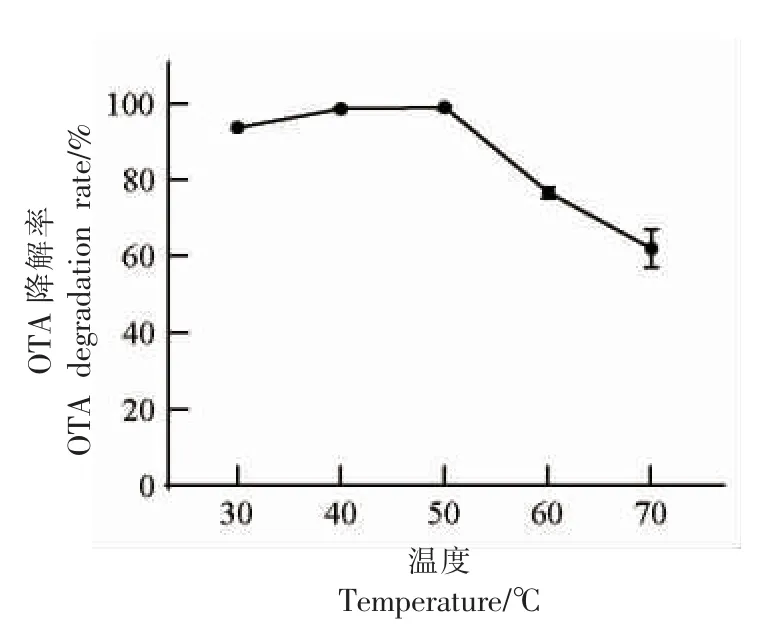
图4 不同温度对Af-OTd 酶活性的影响Fig.4 Effects of different temperature on Af-OTd enzyme activity
2.4 pH 对降解酶Af-OTd 酶活性的影响
pH 对酶活具有较大影响[20],因此探究Af-OTd在不同pH 条件下的活性是十分必要的。按1.3.5节反应体系在最适温度50 ℃条件下反应15 min后终止,计算OTA 降解率。图5中可知,pH=7.5 是降解酶Af-OTd 的最适pH 值,OTA 降解率最高,碱性增强,OTA 降解率呈下降趋势,当在pH<7的酸性条件下,降解效率大幅降低,该结果说明Af-OTd 的耐酸性较弱。
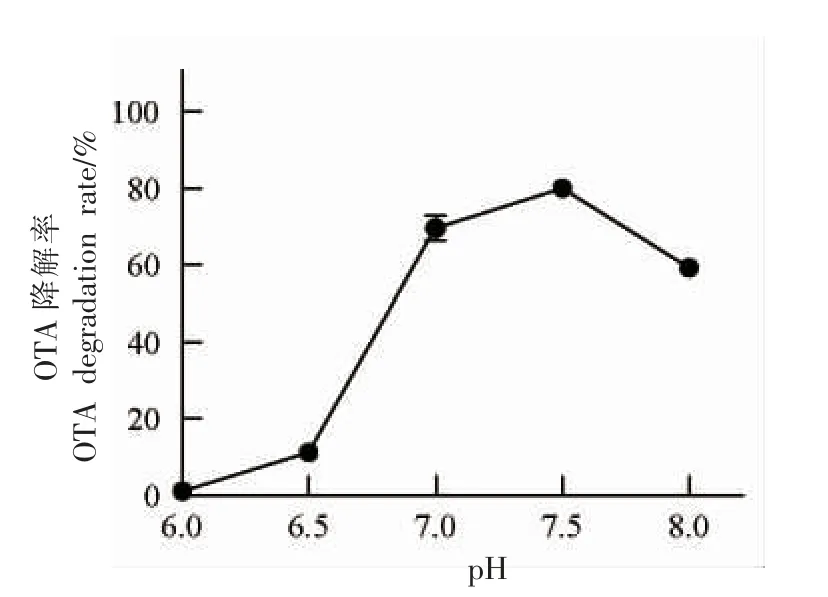
图5 不同pH 值对Af-OTd 酶活性的影响Fig.5 Effects of different pH values on Af-OTd enzyme activity
2.5 酒精含量对降解酶Af-OTd 酶活性的影响
OTA 常见于葡萄酒中[21],因此本小节通过检测Af-OTd 在不同酒精浓度条件下对OTA 的降解活性,探究其酒精耐受情况,为后续在葡萄酒生物脱毒领域的应用提供理论基础。不同酒精浓度的反应体系在pH=7.5,温度为50 ℃条件下孵育15 min,OTA 降解率结果如图6所示,酒精会降低降解酶Af-OTd 的酶活力,且随着反应体系内酒精浓度的不断加大,OTA 降解率大幅度降低,当反应体系内酒精含量加至8%时,降解酶Af-OTd 的酶活力几乎降至0,此时为其最大酒精耐受度。

图6 酒精含量对Af-OTd 酶活性的影响Fig.6 Effect of alcohol content on Af-OTd enzyme activity
2.6 金属离子及EDTA 对降解酶Af-OTd 酶活性的影响
水解酶类蛋白一般为金属蛋白,具有金属中心结构[22-23]。为探究Af-OTd 活性与金属离子的关系,本试验使用金属螯合剂EDTA 及部分金属离子:Ca2+,Co2+,Cu2+,Mg2+,Mn2+,Zn2+,K+探究其对Af-OTd 酶活性的影响。1 mmol/L 的EDTA 可完全抑制Af-OTd 降解活性,初步判断该酶为金属蛋白结构。以未加金属离子的反应体系为对照,7 种金属离子对Af-OTd 的酶活都具有抑制效果,其中Co2+,Cu2+,Mn2+,Zn2+抑制效果最为明显,均超过90%(图7)。为进一步验证是否为金属离子对Af-OTd 酶活产生的影响,在各反应体系中同时加入1 mmol/L 金属离子和1 mmol/L EDTA,7 种金属离子对Af-OTd 酶活性的抑制效果均得到缓解(图7)。

图7 金属离子及化学试剂对Af-OTd 酶活性的影响Fig.7 Effects of metal ions and chemical reagents on Af-OTd enzyme activity
添加等摩尔Co2+与EDTA、Zn2+与EDTA 的两组反应,Af-OTd 酶活性不仅抑制效果被缓解,还呈现出促进效果,初步分析,在调节1 mmol/L EDTA 溶液的pH 值时,EDTA 溶液有微量稀释,导致反应体系中微量金属离子剩余促进了Af-OTd 酶活性。为了进一步验证,分别在反应体系中添加1,10,100,1 000 μmol/L 的Co2+、Zn2+,探究微量金属离子对Af-OTd 酶活的影响,结果见图8。Co2+,Zn2+在1,10 μmol/L 条件下,均促进Af-OTd降解活性,当继续增大浓度到100 μmol/L 时,Co2+,Zn2+再次表现出抑制Af-OTd 酶活。

图8 Co2+和Zn2+对Af-OTd 酶活性的影响Fig.8 Effects of Co2+ and Zn2+ on Af-OTd enzyme activity
综上所述,金属离子对降解酶Af-OTd 的酶活性具有显著影响,其影响机制将在接下来对Af-OTd 的三维结构解析工作中进行深入分析。
3 结论
将实验室已获得的OTA 降解酶Af-OTd 在大肠杆菌中进行重组表达及蛋白纯化,并对部分酶学特性进行初步探索。试验结果表明:Af-OTd 的酶活性受温度、pH 值、酒精含量和金属离子的影响。该酶表现出较宽的温度范围(30~70 ℃),50℃为其最适反应温度;该酶在弱碱性条件下的酶活更好,最适pH 值为7.5,酸性条件下酶活受影响较明显;该酶对酒精呈现一定的耐受能力,当酒精含量为4%时,OTA 降解率仍可维持在60%左右,然而当酒精含量大于8%,OTA 降解率几乎降为0。而常见赭曲霉毒素A 的葡萄酒酒精含量在8%~15%之间[24],食品、饲料、包括葡萄酒的pH 值都为中性偏酸性[25],因此后续试验应着重通过易错PCR 或定点突变等手段降低降解酶Af-OTd 的最适pH 值,提高其酒精耐受度,从而提升酶的品质。同时,试验还发现,Af-OTd 酶活与金属离子有着密切的关系。一方面,在金属螯合剂EDTA 及7种金属离子单独存在的反应体系中,Af-OTd 的相对酶活力都出现不同程度的下降;另一方面,当EDTA 分别与7 种金属离子同时在反应体系中时,相对酶活力较前一试验都有明显提升。该现象可能与多种作用机制有关,如引起酶蛋白表面电荷的变化,从而影响酶的活性[26];在此过程中还发现,微摩级的Co2+和Zn2+离子对Af-OTd 酶活性有明显的促进作用,这可能是Co2+和Zn2+离子作为辅因子与酶形成复合物,成为活性中心的组成部分[27],也可能是作为酶的激活剂或辅基激活提高酶活力[28],具体机制还需通过后续试验进一步分析。
本文实现Af-OTd 异源高效表达并完成该酶的酶学性质的初步探究,为Af-OTd 性能的进一步优化积累了数据,将为促进毒素脱毒酶在相关行业的应用奠定基础。
