LR12 肽通过调控TLR-4/ NF-κB 信号通路对坏死性小肠结肠炎新生小鼠肠道损伤的影响
2022-02-18占彩霞廖镇宇黄瑞文刘银芝
占彩霞 廖镇宇 黄瑞文 刘银芝 杨 慧
湖南省儿童医院新生儿科,湖南长沙 410007
坏死性小肠结肠炎(necrotic enterocolitis,NEC)是以肠道炎症为特点的消化系统疾病,常发生于早产儿,由于复杂的发病因素,临床上缺乏有效治疗手段,死亡率约为30%[1]。NEC 病情进展较快,目前尚未完全阐明其发病机制,但认为肠黏膜屏障结构和功能的改变及肠道炎性损伤是其发病基础[2]。髓细胞触发受体1(triggering receptor expressed on myeloid cells-1,TREM-1)是一种炎症激发受体,能通过激活TLR-4/NF-κB 信号通路放大炎症级联反应,其在脓毒症、结肠炎等炎症疾病中发挥重要作用[3-5]。作为一种TREM1特异性抑制肽,LR12 肽能够捕获TREM1 配体,阻断TREM1 介导的炎症反应,具有显著的抗炎作用[6],目前已被美国食品药品监督管理局批准为治疗脓毒性休克的药物。但目前还未知晓LR12 肽对NEC 是否有治疗效果,为此,本研究通过构建幼鼠NEC 模型,并进行LR12 肽干预,探讨LR12 肽对NEC 的影响及作用机制。
1 材料与方法
1.1 实验动物
SPF 级C57BL/6 小鼠18 只(雌性6 只,雄性12 只),8 周龄,体重16~23 g,由成都达硕实验动物有限公司提供,动物生产许可证号:SCXK(川)2019-031,动物合格证号:No.1103241911007575。实验遵循国家实验动物伦理规范。
1.2 主要试剂
LR12 肽(LQEEDTGEYGCV)及其无效肽LR12 scramble(YQMGELCAGEED)由北京赛百盛基因技术有限公司合成并提供;脂多糖(lipopolysaccharide,LPS,货号:SMB00704)、异硫氰酸荧光素-葡聚糖(FITCDextran,货号:46944)购自美国Sigma-Aldrich 公司;鼠白细胞介素(interleukin,IL)-1β(货号:CSB-E08054m)、IL-6(货号:CSB-E04639m)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α,货号:CSB-E04741m)酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)试剂盒购自武汉华美生物有限公司;TREM1(11791-1-AP)购自武汉三鹰生物技术有限公司;TLR-4(货号:14358S)、MyD88(货号:4283S)、NF-κB p65(货号:6956S)、IκBα(货号:4814S)、GAPDH(货号:51332S)抗体购自美国CST 公司;ECL 显影试剂盒购自美国密理博公司。
1.3 方法
1.3.1 分组、造模及给药 将雌鼠和雄鼠按照1∶2 合笼受孕,孕鼠共计产仔60 只。采用随机数字表法将幼鼠分为四组(n=15):对照组、模型组、LR12-scr 组(作为阴性对照)和LR12 组。将2 日龄幼鼠置于保育箱,喂养方式采用人工喂养,代乳品及喂养剂量参考文献[7]配制。对照组不做任何操作,其余三组采用缺氧冷刺激+LPS 干预法[8]构建NEC 模型:将幼鼠放入90%氮气中缺氧90 s,然后置于4℃冰箱进行冷刺激10 min,再腹腔注射7 mg/kg LPS,连续操作3 d。造模结束后,若幼鼠NEC 临床症状评分≥8 分视为模型成功[9]。模型成功且无死亡。LR12-scr 组腹腔注射5 mg/kg LR12 scramble,LR12 组腹腔注射等剂量LR12 肽,对照组和模型组给予等量溶剂,1 次/d,连续3 d。
1.3.2 幼鼠临床症状评分 记录所有幼鼠实验前后的体重,并于实验结束时参考文献[10]进行临床症状评分。见表1。

表1 NEC 临床症状评分标准
1.3.3 检测肠黏膜通透性 所有幼鼠灌胃40 mg/g 的FTTC-Dextran 溶液,4 h 后眼眶取血,3500 r/min 离心10 min,离心半径为15 cm。采用酶标仪测定血浆荧光强度,制作标准曲线并计算其浓度。
1.3.4 苏木精-伊红(hematoxylineosin,HE)染色所有幼鼠取回盲部肠组织固定24 h 后取出,石蜡包埋后切片5 μm,行HE 染色。参考Nadler 标准[9]进行双盲评分,评分≥3 分者视为NEC 样肠损伤。见表2。

表2 Nadler 评分标准
1.3.5 检测肠组织中炎症因子水平 取所有幼鼠肠组织制备组织匀浆,在4℃,3000 r/min 离心15 min,离心半径为15 cm,取上清,按照试剂盒说明书的步骤检测TNF-α、IL-1β 和IL-6 的表达水平。
1.3.6 检测相关蛋白表达 取所有幼鼠肠组织裂解成组织匀浆,12 000 r/min 离心20 min,离心半径为15 cm,取上清,按照BCA 法进行蛋白定量。取25 μg 蛋白,经SDS 凝胶电泳,转膜,加入TREM(1∶1000)、TLR-4(1∶1000)、MyD88(1∶1000)、NF-κB p65(1∶500)、IκBα(1∶500)和GAPDH(1∶1000)孵育,TBST 清洗,加入相应属性二抗(1∶10 000),膜滴加ECL 试剂后,采用全自动化学发光分析仪进行显影。
1.4 统计学方法
采用SPSS 19.0 软件进行数据分析,计量资料用均数±标准差()表示,多组间比较采用单因素方差分析,两两比较采用LSD-t 检验。以P <0.05 为差异有统计学意义。
2 结果
2.1 各组幼鼠实验前后体重变化、临床症状积分比较
各组实验前体重比较,差异无统计学意义(P >0.05),实验后模型组体重低于对照组,而LR12 组体重高于模型组,差异均有统计学意义(P <0.05);模型组临床症状积分高于对照组,LR12 组积分低于模型组,差异均有统计学意义(P <0.05),而LR12-scr 组积分与模型组比较,差异无统计学意义(P >0.05)。见表3。
表3 各组幼鼠实验前后体重变化、临床症状积分比较()

表3 各组幼鼠实验前后体重变化、临床症状积分比较()
注 与对照组比较,aP <0.05;与模型组比较,bP <0.05
2.2 各组幼鼠肠组织病理学及肠黏膜通透性比较
对照组肠组织病理结构正常。模型组和LR12-scr 组肠组织绒毛杂乱,部分绒毛脱落甚至缺失,肌层变薄。LR12 组肠组织结构较清晰,绒毛坏死或脱落现象减少。见图1。模型组肠组织病理学评分和血清FITC-Dextran 含量高于对照组,LR12 组病理评分和血清FITC-Dextran 含量低于模型组,差异均有统计学意义(P <0.05),而LR12-scr 组以上数据与模型组比较,差异无统计学意义(P >0.05)。见表4。
表4 各组幼鼠肠组织病理学评分及血清FITC-Dextran 含量比较()

表4 各组幼鼠肠组织病理学评分及血清FITC-Dextran 含量比较()
注 与对照组比较,aP <0.05;与模型组比较,bP <0.05

图1 HE 染色观察肠组织病理学变化
2.3 各组幼鼠肠组织炎症因子水平比较
模型组TNF-α、IL-1β 和IL-6 水平高于对照组,LR12 组TNF-α、IL-1β 和IL-6 水平低于模型组,差异均有统计学意义(P <0.05),而LR12-scr 组以上指标与模型组比较,差异无统计学意义(P >0.05)。见表5。
表5 各组幼鼠肠组织中TNF-α、IL-1β 和IL-6 水平比较(ng/L,)
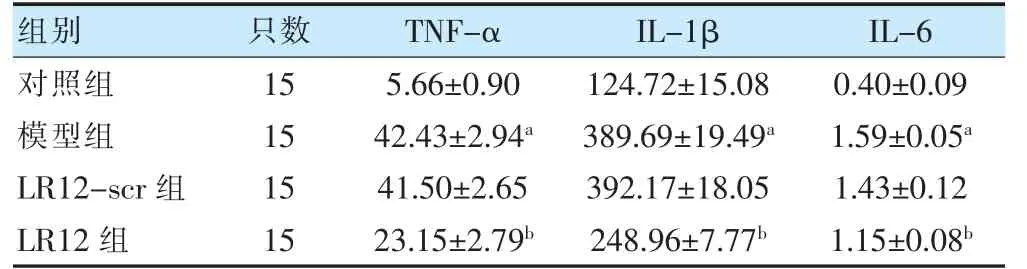
表5 各组幼鼠肠组织中TNF-α、IL-1β 和IL-6 水平比较(ng/L,)
注 与对照组比较,aP <0.05;与模型组比较,bP <0.05。TNF-α:肿瘤坏死因子-α;IL-6:白细胞介素-6
2.4 各组幼鼠肠组织中TREM1 蛋白及TLR-4/NF-κB信号通路相关蛋白表达变化
与对照组比较,模型组肠组织中TREM1、TLR-4、MyD88 和NF-κB p65 蛋白水平升高,IκBα 蛋白水平降低,差异有统计学意义(P <0.05);与模型组比较,LR12 组TREM1、TLR-4、MyD88 和NF-κB p65 蛋白水平降低,IκBα 蛋白水平增加,差异有统计学意义(P <0.05);而LR12-scr 组以上指标与模型组比较,差异无统计学意义(P >0.05)。见图2。

图2 各组幼鼠肠组织中相关蛋白表达水平(n=15)
3 讨论
LPS+低氧刺激是反应人类NEC 最成功的建模方法[11]。本研究结果显示,模型组幼鼠表现出明显的NEC症状,并出现严重的肠损伤、肠黏膜屏障受损,炎症加重等变化,说明NEC 模型成功。然而,本研究采用LR12 肽干预后,幼鼠NEC 症状有所缓解,肠道损伤减轻,肠黏膜通透性改善,炎症水平降低,并且显著抑制TREM1 表达和TLR-4/NF-κB 信号通路的活化。提示,LR12 肽对NEC 具有改善作用。
TREM1 是一种新型炎症激发受体,其可激活并放大TLR-4/NF-κB 信号通路,促进促炎因子的释放[12-14]。Shen 等[15]研究显示,溃疡性结肠炎疾病的严重程度和活动度与TREM1 显著相关。相关研究[16-17]报道,下调TREM1 表达可抑制小鼠结肠炎炎症反应及相关肿瘤的发生。作为TREM1 特异性抑制肽,LR12 肽常应用于TREM1 介导的炎症反应的相关研究中,并已成为一种治疗脓毒症休克的临床用药[18]。然而,LR12 肽对NEC 的影响尚不清楚。本研究结果显示,采用LR12肽干预后,NEC 幼鼠临床症状有所改善,并且肠组织损伤减轻,肠黏膜通透性及肠组织中TNF-α、IL-1β 和IL-6 水平均降低,提示LR12 肽对NEC 具有一定的改善作用。本研究进一步显示,NEC 幼鼠肠组织中TREM1蛋白表达水平显著增加,而LR12 肽干预可抑制NEC幼鼠肠组织中TREM1 蛋白表达,提示LR12 肽对NEC的改善作用可能与抑制TREM1 表达有关。
TLR-4/NF-κB 信号通路是调控炎症反应的主要通路之一,且TREM1 介导的炎症反应均由该信号通路发挥作用。TLR-4 激活后会通过MyD88 触发信号,降解IκBα 和释放NF-κB p65,从而激活NF-κB[19-20]。而NF-κB 作为核转录因子,可诱导TNF-α、IL-1β、IL-6等炎症因子的表达[21]。肠道免疫系统异常激活导致的炎症“瀑布”效应是NEC 发病的关键因素[22-23]。众多研究[24-25]显示,抑制TLR-4/NF-κB 信号通路活化可改善NEC 肠损伤,降低炎症反应。Shi 等[26]研究显示,LR12肽通过降低TREM 1 的表达,抑制NF-κB 信号通路的激活来缓解LPS 诱导的急性肺损伤。本研究结果显示,NEC 幼鼠肠组织中TLR-4/NF-κB 炎症信号通路异常活化。采用LR12 肽干预后,NEC 幼鼠肠组织中TLR-4/NF-κB 炎症信号通路受到抑制。因此,LR12肽可能通过下调TREM1,进而抑制TLR-4/NF-κB 炎症信号通路活化,最终降低炎症反应及肠黏膜通透性,改善NEC 肠道损伤。
综上所述,LR12 肽能够改善肠黏膜通透性,抑制肠组织炎症反应,从而减轻肠组织损伤,其机制可能与抑制TLR-4/NF-κB 信号通路活化有关,本研究可为NEC 疾病的预治疗提供了新的方向。
