椎管内硬膜外孤立性浆细胞瘤MRI特征分析
2022-02-18程敬亮李淑健
刘 洁,程敬亮,李淑健,张 勇
郑州大学第一附属医院磁共振科 郑州 450052
浆细胞瘤包括多发性骨髓瘤(multiple myeloma,MM)、骨孤立性浆细胞瘤、髓外浆细胞瘤(extramedullary plasmacytoma,EMP)等,其中,EMP是一种罕见的发生于骨髓造血组织之外的浆细胞肿瘤[1],好发于中老年男性,以富含淋巴组织的头颈部居多,其次为鼻腔、鼻窦及鼻咽部等上呼吸道,而发生于椎管内者相对较少。本研究回顾性分析经病理证实的4例椎管内硬膜外EMP患者的MRI表现特征,旨在探讨EMP的诊断及鉴别诊断,提高对该病的认识。
1 临床资料
1.1 一般资料收集郑州大学第一附属医院2012年8月至2020年8月收治的经病理证实并有完整临床资料的椎管内硬膜外EMP患者4例,男3例,女1例,年龄54~76岁,中位年龄65岁;临床表现为肢体感觉运动障碍(2例)、胸背部疼痛(2例)、伴大小便失禁(1例)。
1.2 MRI检查方法采用Siemens Skyra 3.0T MRI扫描仪,根据扫描部位采用标准头颈联合线圈或脊柱线圈,患者取仰卧位。常规行矢状位T1WI(TR 640 ms,TE 8.3 ms,层厚3 mm,层间距0.4 mm,FOV 320×320)、矢状位T2WI水-脂分离成像(TR 4 900 ms,TE 112 ms,层厚3 mm,层间距0.4 mm,FOV 256×256)、轴位T2WI(TR 6 000 ms,TE 100 ms,层厚6 mm,层间距2.1 mm,FOV 320×320)、轴位DWI(TR 4 300 ms,TE 56 ms,层厚3 mm,层间距0.3 mm,FOV 160×132)。行脂肪抑制T1WI动态增强(TR 4.06 ms,TE 1.89 ms,层厚2 mm,层间距0.6 mm,FOV 320×320)、延迟矢状位脂肪抑制T1WI(TR 650 ms,TE 10 ms,层厚3 mm,层间距0.4 mm,FOV 320×320)、延迟冠状位脂肪抑制T1WI(TR 650 ms,TE 10 ms,层厚3 mm,层间距0.9 mm,FOV 320×320)、延迟轴位脂肪抑制T1WI(TR 4.9 ms,TE 2.1 ms,层厚2 mm,层间距0.4 mm,FOV 320×320)。使用高压注射器经外周静脉团注Gd-DTPA,剂量0.2 mmol/kg,流速为2.5 mL/s,团注后立即用生理盐水冲洗,保持等速等量原则。
1.3 MRI图像评价MRI检查结果由2名有经验的医师共同阅片,协商并达成一致,主要评价病灶部位、形态、大小、范围、边界、周围组织结构及T1WI、T2WI信号强度、强化方式等。
1.4 病理检查手术标本首先进行大体病理学检查,观察肿瘤形态、大小及包膜等,再经体积分数4%中性甲醛缓冲溶液固定后常规石蜡包埋,4 μm厚切片,行HE染色,光镜下观察。采用En Vision两步法进行免疫组化染色,检测指标包括Ⅱ型穿膜糖蛋白CD38、B淋巴细胞抗原受体复合物CD79a、CAR-T靶点蛋白CD138、细胞增殖相关抗原Ki-67、上皮膜抗原EMA等,所用试剂盒均购于北京中杉金桥生物技术有限公司。首先将石蜡切片脱蜡和水化,用pH 7.4的PBS冲洗3次,每次3 min,必要时再对相应抗体进行微波修复;加1滴体积分数3% H2O2,室温孵育10 min后去除PBS液,加1滴稀释至相应倍数的抗体(CD38稀释度1∶50,CD79a稀释度1∶500,CD138稀释度1∶500,Ki-67稀释度1∶200,EMA稀释度1∶200),室温孵育2 h,PBS冲洗后去除,加1滴聚合物增强剂,室温孵育20 min,PBS冲洗,再加1滴酶标抗鼠/兔聚合物,室温孵育30 min,PBS冲洗,进行氨基联苯胺显色;最后进行苏木精复染,切片经梯度乙醇脱水干燥,中性树胶封固,晾干即可。所有病理切片由1名高年资病理科医师复查阅片。
1.5 MRI表现见表1。①发生部位:4例椎管内硬膜外EMP,3例位于胸段(图1、2),1例位于颈段(图3);2例位于椎管内硬膜外右缘,1例位于硬膜外左后缘,1例环绕硬膜外前后缘,局部沿椎间隙向外生长累及椎旁软组织。②病灶范围:肿瘤多局限于2~3个椎体平面之间,最大径53~67 mm。③形态、边界:4例边界均较清楚;3例形态规则,呈类椭圆形、长椭圆形或哑铃状;1例形态不规则。④信号及强化特点:MRI平扫显示2例信号均匀,与同层面肌肉组织相比,T1WI上呈低信号,T2WI上呈稍高信号;2例信号不均,T1WI上呈低信号,T2WI上呈稍高信号,内另见低信号分隔影;4例病灶均无坏死、囊变及出血。T1WI增强后,2例呈中等均匀强化,2例呈不均匀中等强化,可见条状明显强化分隔。DWI高b值上4例均扩散受限呈高信号,相应ADC图呈低信号。⑤邻近骨质破坏:2例侵犯相邻椎间孔及椎体附件,其中1例沿椎间隙向外生长,形成椎旁软组织肿块;2例局限于椎管内,其中1例扩张至两侧椎间孔但未累及邻近骨质。
1.6 病理结果4例均手术切除。大体上可见边界清晰的实性肿物,切面呈灰白灰红色,质脆。镜下4例均可见形态大小较一致、胞质较丰富(图1D),呈嗜碱性或嗜双色性,核圆或呈车轮状并核周空晕等具浆细胞形态特征的瘤细胞弥漫浸润,细胞黏附性较差,无明显排列方式,未见细胞间连接。4例均接受免疫组化染色检查,4例CD38阳性,3例CD79a阳性,2例EMA阳性,1例CD138阳性,见表1。

表1 4例椎管内硬膜外EMP的影像学表现及免疫组化染色结果

A、B:病灶呈均匀长T1WI稍长T2WI信号,累及胸3、4椎体水平(A,箭头处),相应硬膜囊完整,呈受压改变(B,箭头处);C:增强扫描病灶呈中等均匀强化;D:病理检查示瘤细胞形态大小基本一致、排列紧密(HE,×100)

A:病灶呈不均匀稍长T2WI信号,内见高信号分隔影(箭头处);B:增强扫描病灶呈中等不均匀强化,分隔呈明显强化(箭头处);C:DWI上病灶扩散受限呈显著高信号;D:ADC图上病灶信号减低呈低信号
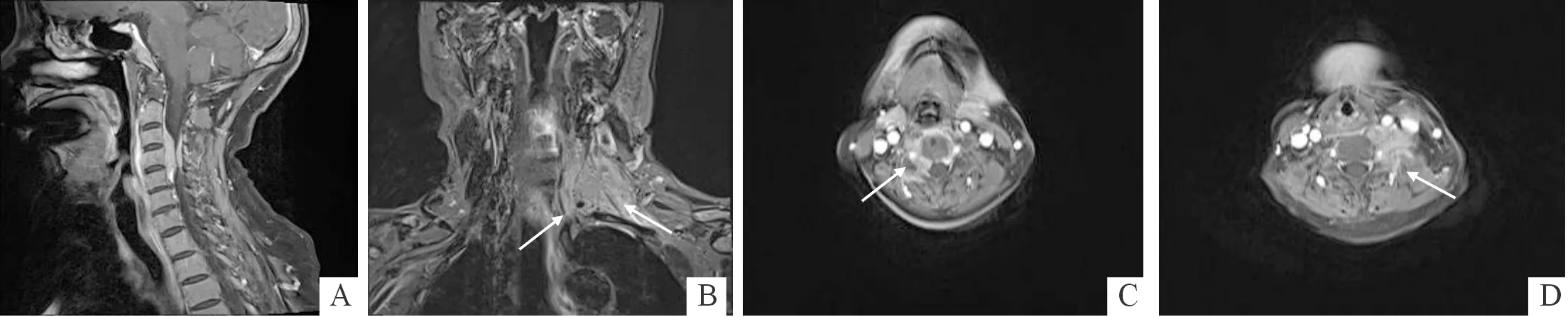
A:病灶累及椎管前后缘;B:形成椎旁肿块并包绕相邻血管(箭头处);C、D:增强扫描病灶沿两侧椎间孔向外延伸(箭头处)
2 讨论
2.1 临床与病理EMP是一种临床较少见的低度恶性肿瘤,约占所有浆细胞肿瘤的4%[2]。有学者[3]报道,EMP好发于中老年人(50~60岁),男女之比约1.82∶1,本研究与之相符。文献[4-5]报道,本病好发于含淋巴组织丰富的头颈部及上呼吸道,其次为胃肠道、泌尿生殖道、皮肤、肺或乳房,而椎管内者较为罕见,仅见数例个案报道,可位于硬膜外[6]、硬膜下[7]及脊髓内[8]。椎管内EMP多伴有MM,而本研究4例为椎管内硬膜外EMP,不伴有MM,其中3例位于胸段,1例位于颈段。EMP临床表现多样化,多因发现局限性肿块或产生局部压迫症状等就诊。椎管内EMP最常见的症状为肢体无力、感觉异常、反射异常等,多由脊髓或神经根受压所致,呈进行性或间断性发作,而这些临床表现多无明显特异性,均可由其他椎管内的占位性病变引起。本组1例表现为双下肢感觉、运动障碍伴大小便失禁,1例表现为间断左上肢麻木疼痛,2例表现为背部疼痛,与文献[3]报道基本一致。
EMP大体标本多表现为边界清晰的结节状实性肿物,切面呈灰黄至暗红色,部分呈鱼肉样,质软或韧,亦可呈息肉样或有蒂病变[9]。病理组织学上,病灶表现为具有浆细胞特征的瘤细胞构成的孤立性病灶,瘤细胞形态单一,成熟者胞核呈圆形或卵圆形,未成熟者胞核大而圆,间变性者胞核大小不一;瘤细胞胞质丰富,胞浆呈嗜碱性或双色性,核周可有淡染的月牙形空晕;其中,未成熟者异型性显著,核分裂象多见[8]。瘤细胞核内可见Ig包涵体(即Dutcher小体)或胞浆内结晶状小体。免疫组化检查是确诊EMP的金标准,据报道[10]EMP瘤细胞可表达CD38、CD138、CD79a、EMA、Ki-67等,其中CD38和CD138是最常用的标志物,后者具有较高特异性[11]。本研究中CD138的阳性率仅为25%,远低于其他学者[9]报道的100%,不如CD38灵敏度高。本研究中Ki-67的检测结果在15%~60%之间,差异性较大,这与之前文献[9]报道一致。
2.2 MRI表现及鉴别诊断与传统的成像方法相比,MRI具有许多优点,例如无电离辐射、软组织分辨率高及多平面成像[12]。MRI对EMP的诊断具有重要价值,可清晰显示病变部位、大小、范围及与周围组织关系等,尤其是对于椎管内病变,可辨别髓内外病变,并显示椎管内及椎旁侵犯的情况[13]。与肌肉组织相比,EMP在T1WI上通常表现为等/低信号,在T2WI上则表现为等/稍高信号,相对于其他常见椎管内肿瘤,EMP T2WI信号偏低可能与细胞排列致密、核大且深染有关[14];静脉注射对比剂后肿块呈中等强化,肿块边界清晰,均匀强化,极少发生肿瘤坏死或囊变,这与镜下所见瘤细胞形态大小单一、排列紧密的特点相符[14];当肿瘤体积较大时可能伴有坏死。目前,尚未有EMP伴有出血、钙化或脂肪成分的报道[15]。本研究4例MRI表现与文献[16]报道的浆细胞瘤信号强度、强化方式基本一致。值得注意的是,本研究2例病灶内信号不均,可见数量不一、形状各异、显著强化的间隔,作者认为可能与组织学上血管丰富的疏松间质结构相对应,此亦被总结为本病较具特征的影像学表现[17]。另外,EMP对周围骨质破坏的程度亦有所不同,这可能与病变部位及程度不同有关,本研究4例病灶均边界清晰,与邻近硬脊膜分界清楚,硬脊膜显示清晰完整,同水平硬膜囊受压向健侧偏移;2例向外破坏椎管壁及椎间孔骨质,其中1例向椎旁组织间隙生长并包绕相邻血管,形成“夹心饼”征,与之前文献[5]报道一致;1例延伸至两侧椎间孔但未累及相邻骨质;1例局限于椎管内。
EMP的临床治疗方式与其他肿瘤不同,因此鉴别诊断十分重要,首先需要排除MM髓外浸润的可能。MM好发于胸、腰段,病程中晚期可出现髓外浸润,此时阳性椎弓征(椎体破坏、椎弓保留)、穿凿样骨质缺损和膨胀性溶骨性骨质破坏多见,而椎旁软组织肿块相对较轻。此外,椎管内硬膜外EMP还需与该部位常见的其他病变相鉴别。①转移瘤:硬膜外转移瘤多源于肺癌、乳腺癌等远处肿瘤,好发于胸、腰段,病灶多发,累及多个椎体,多伴有原发肿瘤的相应症状,MRI显示T1WI呈等或稍低信号,T2WI呈不均匀高信号,增强扫描呈不均匀强化。②淋巴瘤:常位于硬膜外前缘,MRI显示T1WI呈等或稍低信号,T2WI呈等信号,增强扫描后轻到中等均匀强化,肿瘤环绕硬膜生长,无包膜,多无明确椎体骨质破坏。③脂肪瘤:呈纵向生长,MRI显示T1WI呈高信号,T2WI呈高信号,脂肪抑制序列上呈明显低信号,具有特征性。④神经源性肿瘤:以颈、胸段多见,常位于脊髓背外侧,病变部位椎间孔扩大,典型者呈“哑铃状”,常与1~2支神经根相连,与脊髓多分界清晰,相应部位上下方蛛网膜下隙扩大,MRI显示T1WI呈等或稍高信号,T2WI呈高信号,增强扫描明显均匀或不均匀强化;此外神经鞘瘤易囊变、T2WI呈明显高信号、增强扫描呈“靶征样”强化等典型特征亦可帮助鉴别。当然,EMP发病率低,缺乏大宗病例的研究报道[16],影像学表现缺乏特异性,最终确诊仍需依赖组织病理学检查。
目前,EMP的治疗手段包括手术切除、放疗,且对后者具有较高敏感性[18]。EMP属于低度恶性肿瘤,其预后相对较好,10 a生存率50%~80%[6];文献报道约16.1%[4]的EMP可转化为MM,一旦转化则预后较差,因此,早期发现和确诊有助于指导临床治疗方案,提高患者生存率,从而改善预后。
综上所述,椎管内硬脊膜外EMP发病率较低,临床症状及影像学表现缺乏特异性;作者认为,对于边界清晰、均匀中等信号(与常见的椎管内肿瘤相比,T2WI信号偏低)、中等均匀强化,或形态不规则、信号欠均匀(内可见T2WI高信号分隔影)、中等不均匀强化(分隔明显强化)、可沿椎间孔向椎旁生长、易包绕邻近血管形成“夹心饼”征的椎管内硬脊膜外肿块,结合患者年龄、性别等综合因素分析,应想到本病的可能,但最终确诊需依赖组织病理学及免疫组化结果。
