过表达miR-302b对食管鳞状细胞癌TE-10细胞生物学行为的影响
2022-02-18蒋庆锋程纪伟程金华申思宁马晓超邢文群
蒋庆锋,程纪伟,程金华,申思宁,钱 鑫,马晓超,邢文群
郑州大学附属肿瘤医院胸外科 郑州 450008
食管癌是全球常见的一种恶性肿瘤,近年来发病率、病死率不断上升,成为全球第5大恶性肿瘤死亡原因,其中食管鳞状细胞癌(食管鳞癌)多见于东亚地区,来自中国的病例超过50%[1]。在食管鳞癌的病理过程中,恶性肿瘤相关性炎症基因(CXCR4、ERBB4、IRF2)表达异常[2],但其调控机制仍不明确。微小RNA是长约22 nt的内源性非编码RNA分子,由21~25个核苷酸组成,它能够与mRNA结合,通过翻译水平的抑制或断裂靶标mRNA而调节靶基因的表达。微小RNA在不同类型肿瘤中可能靶向不同的基因,从而发挥不同的生物学功能[3]。微小RNA-302b(miR-302b)可能通过靶向作用于部分恶性肿瘤相关性炎症基因和相关信号通路,进而在食管鳞癌病理过程中扮演着重要角色,其在食管鳞癌患者癌组织中的表达下调往往预示着患者预后较差,但关于此方面的报道不多[4-5]。本研究观察了过表达miR-302b对食管鳞癌TE-10细胞株增殖和凋亡的影响,从而为食管鳞癌的临床防治提供新的方向和策略。
1 材料与方法
1.1 组织标本、细胞及主要试剂
1.1.1标本的获取 收集2018年6月至2020年6月在郑州大学附属肿瘤医院胸外科行食管癌根治术的患者47例,其中男32例,女15例;年龄26~57(41.0±6.9)岁;病程4~7(5.7±1.1)个月;癌灶处于食管胸上段4例,胸中段25例,胸下段18例;TNM分期:T1期5例,T2期22例,T3期12例,T4期8例。术后经病理检查证实均为食管鳞癌;取癌组织及距离肿瘤组织边缘超过5 cm的切除标本组织(癌旁组织)。
1.1.2细胞和主要试剂 食管鳞癌TE-10细胞购自上海中科院细胞库。miR-302b模拟物(mimics)、miR-302b-siRNA序列均由上海达为科生物科技有限公司设计并合成。Trizol试剂购自美国Thermo Fisher Scientific公司,RNeasy Plus Mini试剂盒购自德国Qiagen公司,体积分数10%胎牛血清购自美国Gibco公司,Lipofectamine 2000购自美国Invitrogen公司,CCK-8试剂购自北京赛因百奥生物技术公司,DMEM培养基购自美国HyClone公司,Transwell小室购自美国BD公司,CXCR4、ERBB4、IRF2一抗购自英国Abcam公司,二抗购自北京博奥龙公司。磷酸盐缓冲液及多聚甲醛均为市售分析纯。
1.2 癌组织与癌旁组织中miR-302b表达的qRT-PCR检测按照Trizol试剂盒说明书步骤提取癌组织和癌旁组织总RNA,反转录合成cDNA,然后以cDNA为模板行qPCR。qPCR反应体系20 μL。反应条件:95 ℃ 15 min;95 ℃ 10 s,55 ℃ 20 s,72 ℃ 25 s,40个循环。miR-302b上游引物序列5’-CAGTGCGTGTCGTGGAGT-3’,下游引物序列5’-GATAAGTGCTTCCATGT-3’;内参(U6)上游引物序列5’-AACGCTTCACGAATTTGCGT-3’,下游引物序列5’-CTCGCTTCGGCAGCACA-3’(引物由上海达为科生物科技有限公司设计、合成)。计算2-ΔΔCt对miR-302b表达量进行定量分析。
1.3 细胞分组和转染TE-10细胞接种于6孔板中,每孔约接种3×105个/细胞。待细胞融合度达65%时,分别将阴性对照(转染无义siRNA)、miR-302b-mimics、miR-302b-siRNA各5 μL,以1∶20的稀释度加入培养基中。充分混匀,室温孵育15 min。培养基更换为含体积分数10%胎牛血清的培养基,转染1 d,收集生长状况良好的细胞。
1.4 TE-10细胞增殖的CCK-8法检测将1.3中各组细胞进行消化处理,接种至96孔板中,每孔2.0×103个,置于培养箱(体积分数5%CO2、37 ℃)中培养过夜。加入体积分数10% CCK-8试剂(100 μL/孔)。另设置空白对照组(正常的TE-10细胞,未经特殊处理)。均置于37 ℃孵育1 h。采用全自动酶标仪检测波长为450 nm时的吸光度值。实验重复3次。
1.5 细胞侵袭的Transwell检测于4 ℃下用无血清DMEM培养基对基质胶进行稀释,取100 μL铺于Transwell小室的上室中,置于37 ℃培养箱1 h。采集对数生长期的各组TE-10细胞,用无血清DMEM培养基重悬,1×105个/小室。下室中加入DMEM完全培养基(含体积分数10%胎牛血清),置于培养箱(体积分数5%CO2、37 ℃)培养24 h后取出Transwell小室,吸去上室中的培养基,磷酸盐缓冲液漂洗3次。40 g/L多聚甲醛固定30 min,染色处理,置于荧光倒置显微镜下对所选视野进行观察,计数穿膜细胞。实验重复3次。
1.6 恶性肿瘤相关炎症基因表达的蛋白免疫印迹法检测将1.3中各组细胞分别接种于细胞培养瓶中,每瓶1.0×105个,培养24 h。待细胞融合度达90%时,去除培养基,弃细胞培养液,磷酸盐缓冲液漂洗2次。提取细胞总蛋白,变性5 min,行蛋白定量,行电泳分离,转膜,室温封闭2 h。加入一抗(CXCR4按1∶200稀释,ERBB4、IRF2均按1∶500稀释),孵育过夜,洗膜2次,5 min/次。加入二抗(按1∶1 000稀释),室温孵育1 h,洗膜2次,5 min/次。加入化学发光试剂行曝光拍照,以β-actin为内参照,用Image J软件对条带灰度进行定量分析。实验重复3次。
1.7 统计学处理采用SPSS 23.0分析实验数据。应用配对t检验比较食管鳞癌组织与癌旁组织中miR-302b表达量。应用单因素方差分析和LSD-t检验分析抑制或过表达miR-302b对TE-10细胞增殖、侵袭及TE-10细胞中CXCR4、ERBB4、IRF2蛋白表达的影响,检验水准α=0.05。
2 结果
2.1 食管鳞癌组织与癌旁组织中miR-302b表达量的比较与癌旁组织(1.00±0.05)相比,食管鳞癌组织中miR-302b的表达量(0.76±0.08)下降(t配对=17.419,P<0.001)。
2.2 抑制或过表达miR-302b对TE-10细胞增殖、侵袭能力的影响见表1。由表1可知,miR-302b-siRNA组TE-10细胞增殖、侵袭能力高于空白对照组和阴性对照组,而miR-302b-mimics组TE-10细胞增殖、侵袭能力低于空白对照组和阴性对照组(P<0.05)。
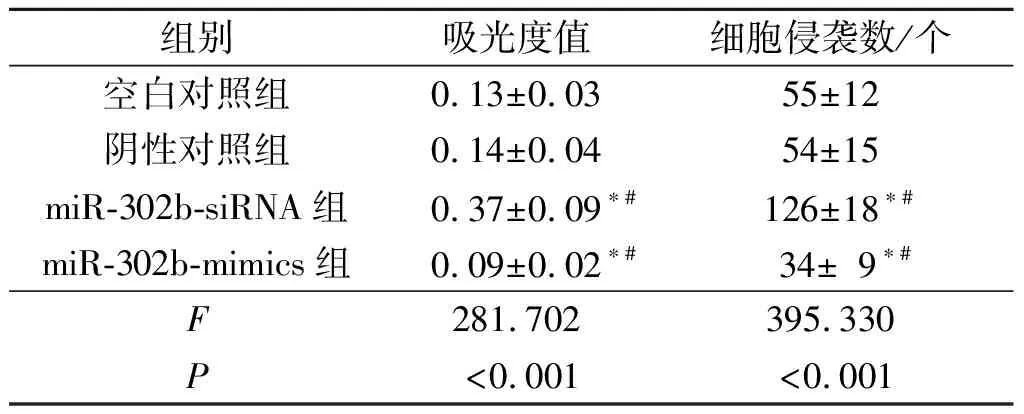
表1 各组TE-10细胞增殖、侵袭能力的比较(n=3)
2.3 抑制或过表达miR-302b对TE-10细胞中CXCR4、ERBB4、IRF2蛋白表达的影响见表2。由表2可知,与空白对照组、阴性对照组比较,miR-302b-siRNA组CXCR4、ERBB4、IRF2蛋白相对表达量均上调,而miR-302b-mimics组上述蛋白相对表达量均下调(P<0.05)。

表2 各组TE-10细胞中CXCR4、ERBB4、IRF2蛋白表达量的比较(n=3)
3 讨论
在人体生理和病理过程中,miRNA在基因转录后修饰中扮演着重要的角色,单个miRNA可调节多个复杂的信号通路,其中包括恶性肿瘤相关性炎症基因通路[6-7]。有学者[8]研究发现,miR-302可通过阻滞PI3K/Akt信号通路的激活而抑制食管癌TE-10细胞的增殖、侵袭、迁移等生物学行为;部分miRNAs在食管癌发生和发展过程中出现表达缺失或表达量异常改变的情况,可具有与抑癌基因、原癌基因类似的功能[9-10];研究[11]还发现,miR-1299在食管癌组织中的表达较其在癌旁组织中的表达明显下降,且与肿瘤分化程度、TNM分期、浸润程度、淋巴结转移等有关,提示miR-1299可能是特异性诊断和治疗食管癌的潜在标志物。
Ibuki等[12]报道了多个miRNAs在恶性肿瘤中发挥着重要作用,其中miR-302b被视为食管鳞癌的潜在生物学标志物,可阻滞肿瘤细胞增殖和侵袭,促进细胞凋亡。另有研究[13-14]指出,miR-302b-3p可通过靶向调控ECT2蛋白表达而阻滞食管癌EC-109细胞增殖,并促进细胞凋亡;miR-302b的表达经芬太尼诱导后可阻滞食管鳞癌细胞侵袭,并促使ERBB4表达下降,提示芬太尼可能通过miR-302b/ERBB4通路而阻滞食管鳞癌细胞侵袭。本研究中,与癌旁组织相比,食管鳞癌组织中miR-302b的表达量明显下降,提示miR-302b可能是食管鳞癌发生和发展的预测因子。
恶性肿瘤相关性炎症是多种炎性细胞、炎性因子长时间的刺激而使得处于细胞内的信号通路出现异常,进而发挥诱导肿瘤发生的作用,如诱导肿瘤细胞存活、增殖,抑制获得性免疫反应,加快肿瘤组织内新生血管的产生,减弱机体对激素类药物和化疗药物的反应等,提示恶性肿瘤相关性炎症在肿瘤的病理过程中起重要作用[15-16]。目前已知miR-302b可诱导多种恶性肿瘤相关性炎症基因表达升高,并利用多种信号通路而诱发肿瘤的发病。例如,有研究[17-18]发现miR-302b可抑制HIF-1、STAT3、NF-κB等恶性肿瘤相关性炎症的重要转录因子和TNF-α、IL-23、IL-6等下游细胞因子的表达,并通过靶向调控CXCR4、ERBB4、IRF2等关键基因的表达而抑制肿瘤的生长。
本实验通过CCK-8法分别探讨抑制miR-302b的表达或使之过表达后,食管鳞癌细胞的生长情况,从而分析其对食管鳞癌细胞生物学行为的影响。细胞增殖实验发现,miR-302b-siRNA组TE-10细胞增殖能力高于阴性对照组,而miR-302b-mimics组TE-10细胞增殖能力低于阴性对照组;细胞侵袭实验发现,miR-302b-siRNA组TE-10细胞侵袭行为较阴性对照组明显活跃,而miR-302b-mimics组细胞侵袭行为较阴性对照组明显减弱。另外,本实验通过蛋白免疫印迹法分别探讨抑制miR-302b的表达或使之过表达对恶性肿瘤相关性炎症基因(CXCR4、ERBB4、IRF2)的影响,结果显示,与阴性对照组比较,miR-302b-siRNA组恶性肿瘤相关性炎症基因相对表达量均上调,而miR-302b-mimics组上述基因相对表达量均下调。上述研究结果提示,miR-302b可通过抑制信号通路中的关键恶性肿瘤相关性炎症基因,从而影响食管鳞癌细胞增殖、侵袭,进而影响肿瘤的进展。
综上所述,miR-302b可阻滞TE-10细胞增殖、侵袭,进而阻滞食管鳞癌的进展,其作用机制可能与抑制CXCR4、ERBB4、IRF2基因表达密切相关。但miR-302b对食管鳞癌发病过程中参与调控的具体靶基因和信号通路的作用目前并未明确,需今后进一步深入分析。
