男性乳腺癌特异性生存率预测模型的构建
2022-02-18周倩梅张莹莹张健华张亚娜李嘉昊张庆雪李靖若
周倩梅,张莹莹,张健华,张亚娜,李嘉昊,张庆雪,赵 硕,李靖若
郑州大学第一附属医院乳腺外科 郑州 450052
针对SEER数据库(http://seer.cancer.gov/)数据的分析结果显示,经年龄调整的男性乳腺癌发病率已从1975年的0.85/10万上升到2011年的1.43/10万[1],但乳腺癌患者中男性占比仍不足1%[2]。目前针对男性乳腺癌的分期使用的是第8版美国癌症联合委员会(the American Joint Committee on Cancer,AJCC)的TNM分期,男性乳腺癌的治疗也是参照女性乳腺癌治疗指南[3]进行的。然而男性乳腺癌有其独特的病理和预后特征[4]。由于男性乳房组织较少,患者往往于早期胸壁即受累,所以仅依赖临床分期判断男性乳腺癌的预后可能并不适合[5]。许多临床研究[6-7]显示年龄、组织学分级、肿瘤分型等对乳腺癌预后也有很大影响。与单独使用临床分期相比,综合多变量的模型可以给出特定临床事件发生概率的数值估计,可为癌症患者提供更准确地预后预测[8]。本研究使用SEER数据库数据进行分析,旨在找出与乳腺癌特异性生存(breast cancer-specific survival,BCSS)相关的因素并绘制列线图,用以预测男性乳腺癌BCSS生存率。
1 资料与方法
1.1 数据来源选取SEER数据库中诊断时间为2010年1月1日至2015年12月31日的2 226例男性乳腺癌病例的数据,随访时间中位数(P25,P75)为36(21,56)个月。同时收集2012年1月1日至2016年5月31日于郑州大学第一附属医院确诊的53例男性乳腺癌患者的资料,随访终点为2021年5月31日。病例纳入标准:临床资料与人口学资料完整;原发部位为乳腺(肿瘤学国际分类ICD-O-3,C50.0~50.9)。排除标准:①SEER数据库来源病例的雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、人表皮生长因子受体-2(human epidermal growth factor receptor-2,HER2)表达为交界性或未知。②生存时间小于1个月。本研究已签署SEER数据协议,被允许访问SEER数据库并获取数据。本研究同时获得郑州大学第一附属医院伦理审查委员会审查并被批准免于获得患者知情同意。
1.2 数据的收集采集的病例基本信息包括:性别、年龄、婚姻、种族、有无医疗保险、病理类型、组织学分级、ER/PR/HER2是否阳性、临床分期(基于第7版AJCC分期)、治疗信息(手术、放疗、化疗等)、死亡原因。乳腺癌特异性死亡指因乳腺癌疾病本身或乳腺癌治疗相关而发生的死亡,不包括其他原因导致的死亡。BCSS生存期定义为从确诊到发生乳腺癌特异性死亡的时间间隔。
1.3 男性乳腺癌BCSS生存率预测模型的建立与验证使用sample函数将SEER数据库中男性乳腺癌病例按7∶3的比例以无放回随机抽样的方式分为训练集(n=1 558)和验证集(n=668)。在训练集中,先使用Cox比例风险回归模型筛选与BCSS相关的变量,再分别以筛选出的多变量、单独临床分期构建BCSS生存率预测模型并绘制列线图。使用验证集数据对模型进行内部验证,使用郑州大学第一附属医院的病例数据进行外部验证。
1.4 统计学处理采用R4.0.4进行统计分析及绘图。采用一致性指数(C指数)评价多因素和临床分期模型列线图预测的准确性。绘制两个模型预测的ROC曲线,用以评价两个模型的预测效能;绘制校准曲线用以评估列线图预测结果与实际生存状况的一致性;应用决策曲线分析(decision curve analysis,DCA)评价预测模型的临床实用性。检验水准α=0.05。
2 结果
2.1 病例基本信息见表1。

表1 男性乳腺癌病例基本信息 例
2.2 男性乳腺癌BCSS生存率预测模型的建立基于单纯临床分期的预测模型的列线图见图1。在训练集中,通过Cox回归分析筛选多因素预测模型的建模变量,结果见表2,最终的列线图(图2)纳入8个变量:婚姻、医疗保险、组织学分级、ER表达、PR表达、临床分期、手术方式、化疗情况。

图1 临床分期预测模型列线图
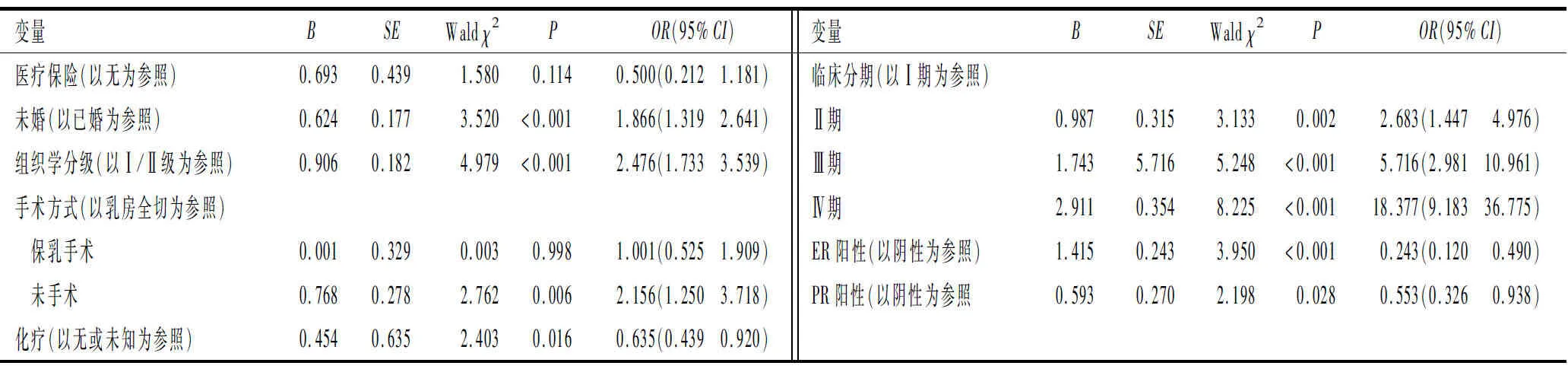
表2 男性乳腺癌BCSS影响因素筛选的Cox回归结果
2.3 模型预测效能的评价在训练集中,男性乳腺癌BCSS生存率多因素、临床分期预测模型列线图预测结果的C指数(95%CI)分别为0.830(0.790~0.870)和0.764(0.718~0.810),多因素预测模型高于临床分期。验证结果见表3、4,可以看出,多因素预测模型列线图对男性乳腺癌BCSS生存率的预测效能优于临床分期。

表3 两个模型预测男性乳腺癌BCSS生存率的外部验证结果
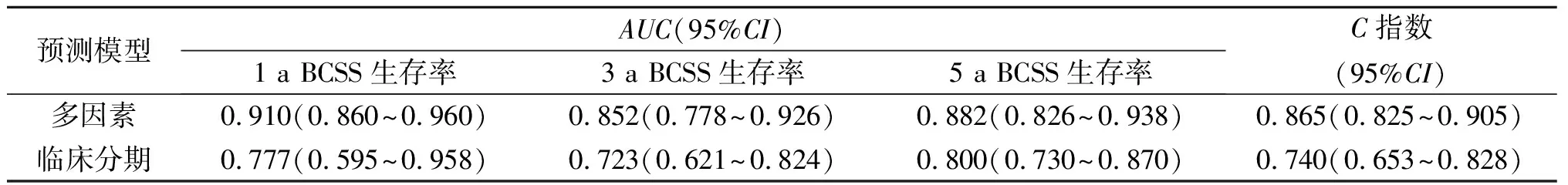
表4 两个模型预测男性乳腺癌BCSS生存率的内部验证结果
校正曲线及DCA评估结果见图3。在验证集中,1、3和5 a BCSS生存率预测的校正曲线均接近45°参考线;DCA评估结果显示,与临床分期相比,多因素预测模型列线图具有更好的临床应用价值。

A、B、C:内部验证集中多因素预测模型列线图预测结果的校正曲线;D、E:模型分别在训练集和验证集中的决策分析曲线
3 讨论
在本次大型队列研究中,我们建立了一个用以预测男性乳腺癌1、3、5 a BCSS生存率的列线图,纳入的预测因子有婚姻、医疗保险、组织学分级、ER表达、PR表达、临床分期、手术方式、化疗情况。
乳腺癌的组织学分级、临床分期、手术方式、化疗情况与预后有关。癌症患者能在婚姻中得到生存获益,这在肺癌[9]、卵巢癌[10]、神经内分泌肿瘤[11]等肿瘤中都得到了证实。本研究发现,相较于单身患者,已婚的男性乳腺癌患者拥有更长的BCSS生存期。这可能是因为已婚患者能获得更好的照顾,家人的健康督促能使患者更好地坚持治疗与定期复查,从幸福的婚姻中获得的社会情感支持也能使患者摆脱消极的心态[12]。有研究[13-14]发现,购买了医疗保险的女性乳腺癌患者较没有医疗保险的女性患者拥有更好的预后,这得益于医疗保险的支持可以使患者更积极主动地接受治疗,选择更合适的药物。因此,尽管本研究Cox回归结果中医疗保险未显示出统计学意义,但仍然将其纳入了最终的预测模型中。雌激素水平与乳腺癌有很大的关系,雌激素水平及一些与雌激素水平升高相关疾病(包括男性乳房发育症、肝功能不全、睾丸异常和肥胖等)已被证实与乳腺癌的发病有很强的关联性[15-16]。本研究结果显示,男性乳腺癌患者主要是中老年(>40岁)人。随着年龄的增长,男性可利用的睾丸激素水平降低,从而导致雌激素与睾丸激素的生物利用度比率发生变化[17]。雌激素潜在的对细胞的诱变和刺激增殖作用,可能会增加肿瘤转化和(或)肿瘤进展的风险[16-17]。本研究预测模型中纳入了ER、PR表达状况。
Wang等[18]将放疗纳入构建的列线图中,用以预测早期男性乳腺癌5或10 a的总生存率。但本研究中,Cox回归分析结果未显示放疗对男性乳腺癌BCSS有影响,未将其纳入列线图。一些研究[19-20]也证实乳房切除术后放疗有利于肿瘤局部控制,但不影响患者的生存时间。虽然HER2表达会增加乳腺癌细胞的侵袭性,但同时也为治疗提供了靶点,抗HER2靶向药物可降低早期病例复发的风险,且约有70%的病例获得了超过10 a的无病生存期[21]。但本研究中,Cox回归分析结果未提示HER2表达状况与男性乳腺癌的BCSS有关。HER2阳性表达病例经过靶向治疗后可以获得与HER2阴性表达病例同样的生存状况,而我们未能在SEER数据库中获得靶向治疗的信息,故HER2表达状态与男性乳腺癌BCSS的关系还有待证实,我们也未将HER2表达状态纳入列线图。
与现有的基于单机构的小样本研究相比,本研究是基于大样本的人群研究,所建立的男性乳腺癌BCSS生存率预测列线图中纳入的变量在临床实践中均容易获得,这确保了列线图使用的便利性;内部和外部验证结果表明,该列线图较临床分期能更准确地预测男性乳腺癌患者的预后;DCA分析结果表明我们所构建的列线图具有广泛适用性。
由于男性乳腺癌发病率低,本研究用于外部验证的数据较少,故未绘制预测外部验证数据1 a BCSS的ROC曲线。男性乳腺癌绝大部分为激素受体依赖型,内分泌治疗是其治疗的重要组成部分。SEER数据库中未提供关于内分泌治疗方面的信息,故本研究无法分析内分泌治疗与男性乳腺癌预后的关系。由于SEER数据库病例来自多家医院,病理结果可能存在差异,故本研究排除了ER、PR、HER2表达为交界性或未知的病例,可能会对分析结果带来一定的影响。
综上所述,本研究确定了男性乳腺癌BCSS的预测因素,并绘制了预测其1、3、5 a BCSS生存率的列线图,使临床医生可以根据风险评分,定量地预测男性乳腺癌患者的预后,为男性乳腺癌预后评估提供了一个有效工具,并且可能有助于高危患者的个体化治疗决策。
