鸡蛋中泰妙菌素化学发光酶免疫分析方法研究
2022-02-18杨金易苑婷婷肖毅美徐振林沈玉栋
李 露,杨金易,王 宇,张 政,苑婷婷,肖毅美,徐振林,沈玉栋*
(1.华南农业大学 食品学院 广东省食品质量安全重点实验室,广东 广州 510642;2.广州市食品检验所,广东 广州 510410;3.深圳凯吉星农产品检测认证有限公司,广东 深圳 518000)
泰妙菌素(Tiamulin,TML,图1)又名泰妙灵,是一种截短侧耳素类抗生素[1-2],具有和大环内酯类相似的抗菌能力,对细菌、支原体、螺旋体和霉形体等均有良好的抑菌效果[3-4],常用于治疗鸡的慢性呼吸道疾病、猪的疟疾和支原体引起的各种畜禽疾病[5]。然而,泰妙菌素通过食物链富集于人体内可能会增加患癌风险,导致胚胎畸性或突变的情况发生,对人类健康造成潜在危害[6-7]。我国2019 年发布的GB 31650-2019《食品安全国家标准食品中兽药最大残留限量》中明确规定泰妙菌素在鸡蛋中的残留限量为1 mg/kg[8]。蛋类是非常优质的、人们日常大量消费的高营养食品,不少商家为提高养殖收益,过量、频繁或不遵守休药期违规使用泰妙菌素进行养殖,造成残留超标问题突出[9],威胁着人们的身体健康。因此,开发灵敏、准确且快速的筛查方法对监管鸡蛋中泰妙菌素的残留至关重要。

图1 泰妙菌素及其半抗原泰妙菌素肟(TMLO)结构Fig.1 The structures of tiamulin and hapten TMLO
目前,针对泰妙菌素残留的检测方法以色谱-质谱联用等大型仪器确证技术为主[10-12],这些方法可准确地对药物进行定量检测,灵敏度高、检测结果可靠,但是前处理复杂,耗时耗力,操作专业性强,难以实现高通量现场筛查。免疫分析方法相比于仪器法具有前处理过程简单、检测时间短、成本低、样品通量高等优点,与大型仪器确证方法优势互补,可显著提高畜禽产品及饲料兽药残留的检测效率[13-15]。化学发光酶免疫分析方法(Chemiluminescence enzyme immunoassay,CLEIA),是以鲁米诺等化学发光底物为信号探针模式发展起来的超灵敏免疫分析技术[16],其原理主要是通过辣根过氧化物酶(Horseradish peroxidase,HRP)催化H2O2释放出活性氧,氧化诱导底物鲁米诺为激发态,当其电子从激发态跃迁回基态时,释放出光子信号进行检测。该法具有灵敏度高、无背景化学发光信号干扰等突出优势[17],已在医疗诊断、环境与食品安全检测领域得到广泛应用与发展[18-19]。目前,针对食品中泰妙菌素残留的CLEIA 方法未见报道。因此,本研究拟通过半抗原设计合成、动物免疫与细胞融合技术制备高质量抗泰妙菌素单克隆抗体,并结合鲁米诺底物化学发光信号探针建立快速检测泰妙菌素的CLEIA方法,旨在为食品安全监管提供技术支持。
1 实验部分
1.1 仪器与试剂
SpectraMax I3x连续波长多功能微孔板检测仪(美国Molecular Devices 公司);AB SCIEX 5500三重四极杆质谱仪(美国AB SCIEX 公司);EYELA 旋转蒸发仪(上海爱郎仪器有限公司);U3010 微量紫外可见分光光度仪(美国Thermo 公司);超低温高速离心机(美国Eppenndorf 公司);DEM-3 型自动洗板机(北京拓普分析仪器有限责任公司);82-5 控温磁力搅拌器(金坛市恒丰仪器厂);TC-2323 CO2培养箱(美国Shellab公司);CHA倒置光学显微镜(日本Olympus公司)。
泰妙菌素、罗红霉素、卡那霉素、恩诺沙星等标准品及N,N-二甲基甲酰胺(上海阿拉丁试剂公司);乳铁蛋白(LF)、鸡卵清白蛋白(OVA)、N-羟基琥珀酰亚胺(NHS)、二环己基碳亚二胺(DCC)、Freund完全佐剂与不完全佐剂、HRP标记的羊抗鼠IgG抗体(美国Sigma公司);化学发光底物液、化学发光增强液(广州万联生物技术有限公司);其它化学试剂均为国产分析纯。RPMI-1640 培养基(美国Gibco公司);小鼠骨髓瘤SP2/0(本实验室保存);SPF级Balb/c雌性小鼠(广东省医学实验动物中心)。
1.2 实验方法
1.2.1 人工抗原的制备与鉴定 参考文献[20],利用TML 分子中的羰基与NHS 缩合形成羧甲基羟肟手臂的半抗原泰妙菌素肟(TMLO)(图1)。然后,采用活泼酯法[21]将半抗原TMLO 与OVA 载体蛋白偶联为包被原TMLO-OVA,与LF 偶联为免疫原TMLO-LF,并用紫外吸收光谱扫描载体蛋白、半抗原和人工抗原,以鉴定人工抗原是否合成成功[22]。
1.2.2 单克隆抗体的制备与评价 参考文献[23],使用免疫原TMLO-LF 平行免疫3 只健康适龄(6~8周龄左右)的Balb/c雌性小鼠,3次免疫后一周对小鼠尾静脉采血,取抗血清上清进行效价和抑制检测,选用免疫应答最好的小鼠进行融合[24-25],通过亚克隆筛选获得单克隆细胞株,并经小鼠腹腔注射培养获得腹水,最后采用蛋白G(Protein G)亲和层析纯化后保存至-20 ℃冰箱备用。
1.2.3 CLEIA 方法的建立 参考文献方法[26],采用棋盘法选择合适的包被原浓度和抗体稀释倍数组合进行抑制曲线绘制,并根据IC50确定最佳包被原质量浓度与抗体质量浓度;然后,采用单因素实验优化药物和抗体稀释液(含吐温-20 的磷酸缓冲液(PBST)、磷酸缓冲液(PBS)、一级水)、反应缓冲溶液PBS离子浓度(0.005、0.01、0.02 mol/L)、酶标二抗稀释液(PBS、PBST、三羟甲基氨基甲烷盐酸盐缓冲液Tris-HCl)、酶标二抗质量浓度(3.33、2.50、2、1.67 μg/mL)及反应时间(20、30、40、50 min)等影响因素。最佳反应条件应具备适当的化学发光值(RLU0)、较低的IC50和较高的RLU0/IC50比值。RLU0/IC50越高,IC50越低,则灵敏度越高,综合最佳反应条件建立泰妙菌素标准曲线,其中,纵坐标B表示添加泰妙菌素时的化学发光值、B0表示未添加泰妙菌素时的化学发光值,横坐标为靶标药物质量浓度。
1.2.4 抗体的特异性 选取泰妙菌素常见结构或功能类似物氧氟沙星、氟罗沙星、恩诺沙星、诺氟沙星、罗红霉素、卡那霉素和克拉霉素标准品测定IC50,按以下公式计算交叉反应率(CRs):CRs(%)=[IC50(泰妙菌素)/IC50(类似物)]×100。
1.2.5 加标回收实验 鸡蛋样品前处理步骤:称取2.0 g 均质后的空白样品置于离心管中,加入2 mL 提取液(pH 7.4 的PBS 与甲醇等体积混合液),涡旋混合5 min 后振荡30 min。以10 000 r/min 离心10 min,取上层清液稀释。
采用上述样品前处理方法处理并消除基质干扰后进行加标回收实验,向阴性的实际样品中添加高、中、低3种浓度的待测药物,每个浓度做3组平行,计算加标回收率。
1.2.6 仪器确证方法比对 参考我国出入境检验检疫行业标准SN/T 4584-2016[27]的样品前处理方法进行处理,测定实际鸡蛋样品,将测定结果与所建立的CLEIA方法结果进行比对。
2 结果与讨论
2.1 人工抗原的制备与鉴定
分子的组成与空间构型不同,在紫外区的光谱也不同。半抗原成功偶联载体蛋白后,分子间通过共价键产生共轭与电子转移,导致峰形或位置发生一定变化,可根据该原则判断人工抗原是否偶联成功。UV-Vis 图谱显示(图2),在200~400 nm 的紫外波长范围内,载体蛋白LF 和OVA 在218 nm 和280 nm 左右分别有强弱两个特征吸收峰,偶联半抗原TMLO 后的抗原TMLO-LF和TMLO-OVA 在250~300 nm 之间的峰形与载体蛋白LF 和OVA 显著不同,说明人工抗原合成成功。另外,“2.2”部分的免疫抗血清评价产生的泰妙菌素的特异性抑制与识别也间接证明抗原合成成功。

图2 泰妙菌素半抗原、载体蛋白和人工抗原的紫外扫描图Fig.2 Ultraviolet scanning of haptens,carrier protein and synthesized antigens
2.2 抗血清评价与单克隆抗体制备
抗血清评价结果显示,药物质量浓度为1 μg/mL、包被原质量浓度为1 μg/mL 时,TMLO-LF 免疫原免疫的2号小鼠抗血清效价为8 k,抑制率为88.3%,效价和抑制率最高,说明该抗血清的亲和力好、识别泰妙菌素的能力高,可用于后续单克隆抗体的制备。小鼠进行细胞融合后,经有限稀释得到细胞上清效价/抑制率为10/95.8%的阳性株,通过细胞体外培养制备腹水,再纯化后得到抗体。
2.3 标准曲线的建立
通过优化实验得到CLEIA 方法的最佳实验条件为:包被原质量浓度0.26 μg/mL,抗体质量浓度为0.94 μg/mL,反应缓冲体系为0.02 mol/L的PBS(pH 7.4),酶标二抗稀释液为PBST,酶标二抗质量浓度为2 μg/mL,酶标二抗反应时间为40 min。在该条件下,建立了泰妙菌素的CLEIA 方法,检出限(LOD,IC10)为0.03 ng/mL,IC50为0.54 ng/mL,线性检测范围(IC20~IC80)为0.17~1.74 ng/mL(图3)。另外,与酶联免疫吸附分析(Enzyme-linked immunosorbent assay,ELISA)和胶体金免疫层析法(Gold immunochromatographic assay,GICA)相比,本方法具有更高的灵敏度(表1)。

图3 CLEIA的标准曲线(n=3)Fig.3 Dose-response curve for tiamulin by CLEIA(n=3)

表1 泰妙菌素检测方法比较Table 1 Comparation of the determination methods for tiamulin
2.4 特异性分析
以交叉反应(CR)为指标,考察了泰妙菌素与其结构功能类似物的特异性,发现其与类似物不存在明显交叉反应(表2),说明本研究建立的CLEIA方法对泰妙菌素具有良好特异性。
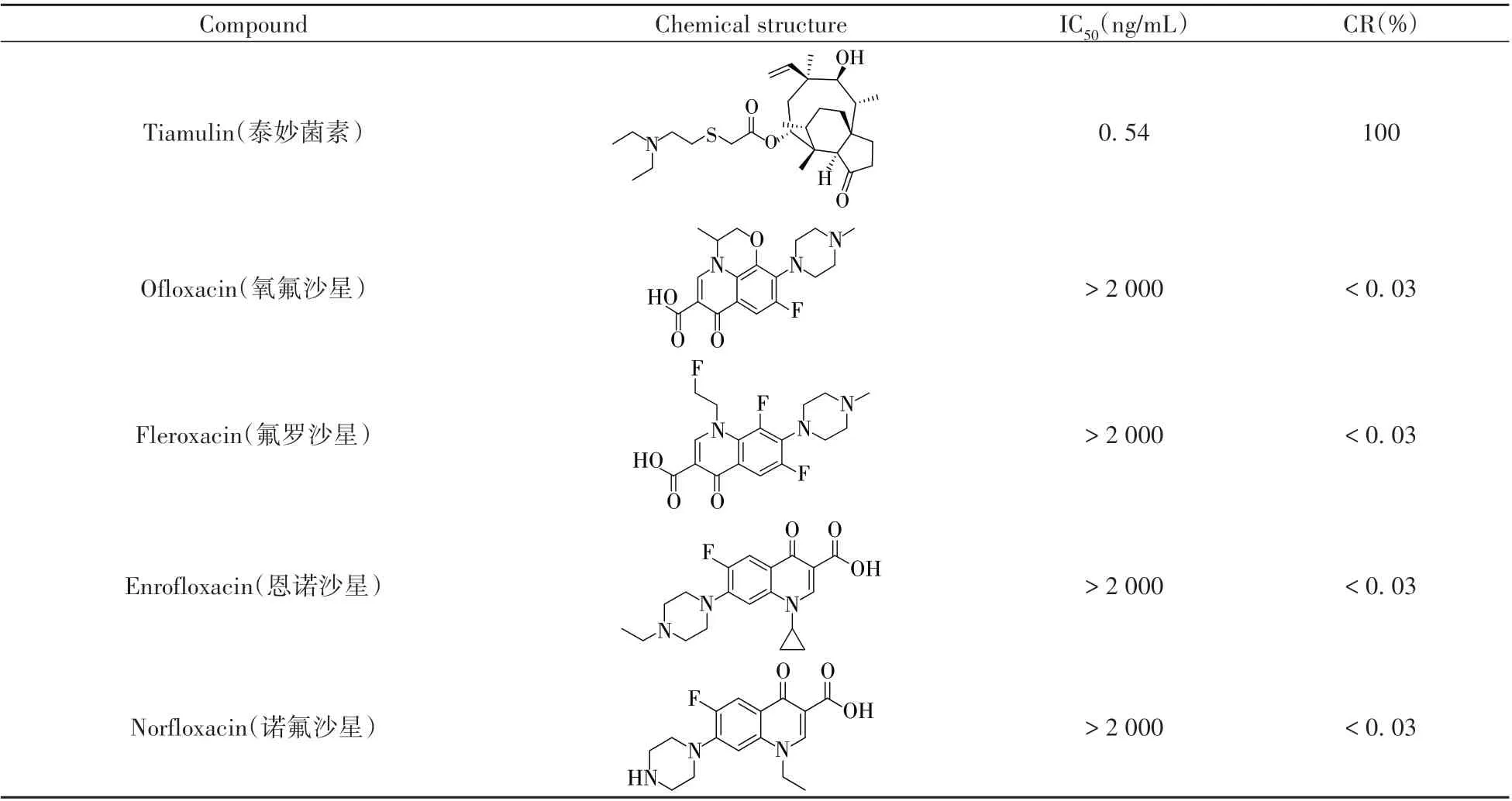
表2 与结构类似物的交叉反应(n=3)Table 2 Cross reactions with tiamulin analogues(n=3)
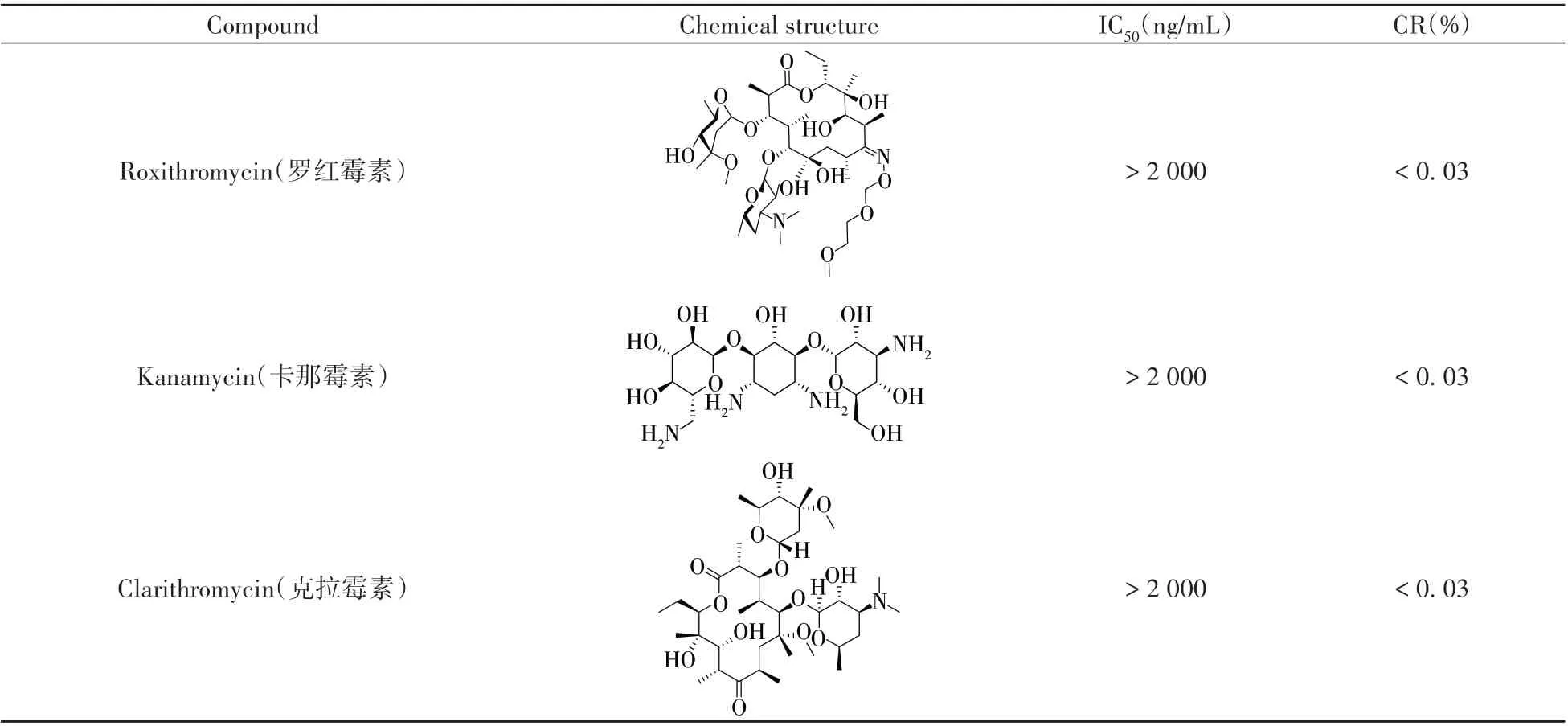
(续表2)
2.5 基质效应消除
鸡蛋样品经“1.2.5”方法前处理后,以PBS稀释25倍的提取液所绘制的CLEIA标准曲线与用PBS所绘制的标准曲线基本吻合,说明基本消除了基质对CLEIA 的干扰。因此,在加标回收实验中,鸡蛋样品经前处理后以PBS稀释25倍用于CLEIA检测。
2.6 样品加标回收实验及方法比对
选择鸡蛋阴性空白样品,添加低、中、高3 个浓度水平的泰妙菌素标准溶液,经相应的样品前处理后分别用CLEIA 方法和HPLC-MS/MS方法[27]检测,并计算其回收率和相对标准偏差(RSD)。每个样品测定3 次,取平均值,结果如表3 所示。CLEIA 方法的平均加标回收率为100%~118%。RSD 均小于10%。与HPLC-MS/MS 检测结果的相关性良好,回归方程为y=0.91x+3.68,r2为0.998 7。说明方法准确度良好,适用于鸡蛋样品中泰妙菌素的检测。
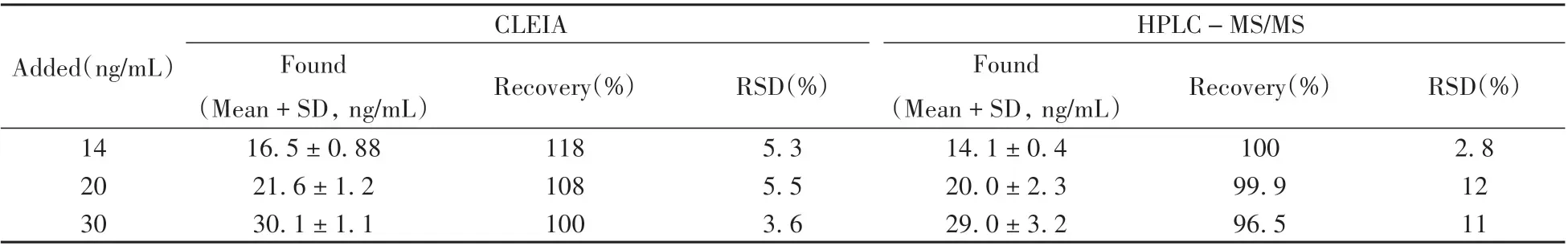
表3 泰妙菌素样品加标回收实验(n=3)Table 3 Spiked recoveries of tiamulin in blank samples(n=3)
3 结 论
本研究基于羧甲基羟肟为偶联手臂的半抗原TMLO,通过动物免疫、细胞融合筛选等获得了泰妙菌素特异性单克隆抗体,并建立了鸡蛋中泰妙菌素残留的CLEIA 检测方法。该方法对泰妙菌素的LOD 为0.03 ng/mL,IC50为0.54 ng/mL,线性检测范围(IC20~IC80)为0.17~1.74 ng/mL。与其功能结构类似物无交叉反应,特异性良好。实际样本加标回收率为100%~118%,RSD 小于10%,与HPLC-MS/MS 方法的检测结果相关性良好(r2= 0.998 7),适用于鸡蛋样品中泰妙菌素残留的快速筛查检测。
