复合污染中氯代脂肪烃对沙雷氏菌降解氯苯影响及其抑制动力学研究
2022-02-18张小平邢志林陈尚洁王永琼高艳辉赵天涛
苏 夏,张小平,邢志林,陈尚洁,王永琼,高艳辉,2,赵天涛,2
(1.重庆理工大学 化学化工学院, 重庆 400054; 2.重庆大学 环境与生态学院, 重庆 400044)
在“双碳”背景下,氯代芳烃污染物控制面临较大压力,其中氯苯(Chlorobenzene,CB)是化工产品中间体、杀虫剂和有机溶剂的重要组成成分,是氯代芳香族中应用最广泛的产品之一,非法排放致使其在环境中广泛存在[1-2]。据估计,全球每年由废水排放到环境中的CB超过500 000吨,持续挥发和沉积循环使其污染遍布全球,南北两极积雪中均检测出有CB存在[3-4]。CB为一级致癌物,被《斯德哥尔摩公约》和美国环保署列为第7位的优先控制污染物,具有高毒性、难降解和易生物蓄积等特性,严重危害生态环境和人类健康[5-6]。针对国家对持续性有机物处理的高要求[7],明晰环境中CB的转化特性,采取有效措施消除污染已成为亟需开展的研究。
多年来,研究者利用多种技术去除环境中CB污染,与其他方法相比,微生物处理技术具有成本低,条件温和及污染小等优势,在CB处理中具有重要应用潜力。国内外研究者利用多种功能菌株开展了CB的降解工作,Oanh等[8]从废水污泥样本中分离出一株CB降解菌BacillussubtilisstrainDKT,2 d内实现60 mg/L的CB降解了70%;同时,Irina等[9]筛选了一株氏乳杆菌PortucalensisstrainF11,相同时间实现100 mg/L CB降解率达85%;此外,Arno Kaschl等[10]从污染含水层中筛选出一株罗尔斯通菌Ralstoniasp,该菌株在21 h对60 mg/L CB降解率为93.4%。这些研究表明不同类型的菌株活性差异较大,高效氯苯降解菌的分离及应用一直是关注的重点。尽管CB生物降解研究开展多年,但绝大多数科研人员关注于单一污染条件下的CB转化过程[11],然而工业发展所导致的环境污染更具复杂性,往往存在复合污染现象。崔健等[12]调研发现CB污染水体中还含有TCE、PCE、1,2-DCA等十几种氯代脂肪烃。在多种因素作用下,有机物降解过程复杂,处理效率及生态毒性更具复杂性及不确定性,污染物常规处理过程受到极大挑战,有机复合污染生物降解的相互影响逐渐受到关注。Zhao等[13]研究反-1,2-二氯乙烯(tDCE)[14]、氯乙烯(VC)、1,1-二氯乙烯(1,1-DCE)、TCE、PCE的存在下顺-1,2-二氯乙烯(cDCE)的生物降解特性,发现在无其他氯乙烯条件下,cDCE的降解速度最快,其他氯代烃可显著抑制cDCE的降解[15]。还有研究发现多氯取代烃对低氯取代烃的还原脱氯有抑制作用,低氯取代烃对高氯取代烃的还原脱氯抑制作用较弱[16]。瞿福平等[17]对CB类同系物共存时CB生物降解性能的影响及作用机制进行了研究,发现邻二氯苯、间二氯苯的存在有利于整个体系的污染物降解,但CB的耗氧速率降低,对二氯苯、1,2,4-三氯苯存在会抑制整个体系及CB的降解。这些研究充分证明在有CB生物降解过程中,污染物共存及其影响特性是需要考虑的重要因素。
基于当前CB降解功能菌数量有限且效率低,前期开展了功能菌的富集筛选工作,获得了一株可同化和共代谢降解氯苯的菌株。当前关于复合污染物问题,更多关注的是同类型污染物间的相互影响,不同类型污染物间的影响研究还是十分有限。环境污染中,CB与其他氯代烃往往同时存在,如氯代脂肪烃,作为不同结构的氯代烃,氯代脂肪烃对CB转化的影响特性如何还未有关注。基于此,本研究选取典型氯代脂肪烃,利用分离的高效菌株,开展复合污染作用下CB的降解研究。明晰氯代烷烃和氯代烯烃作用下CB的降解特性;考察不同氯代脂肪烃的半数效应浓度;利用经典抑制动力学模型进行数据拟合,明晰不同氯代脂肪烃的抑制机理。研究结果为微生物技术在环境氯代有机物复合污染治理中的应用提供参考。
1 材料与方法
1.1 功能微生物
CB降解菌株分离自某废弃焦化厂污染土壤,该菌株能以CB为唯一碳源和能源,鉴定为粘质沙雷氏菌,命名为SerratiamarcescansTF-1(保藏号:M2019674,专利号:ZL201911162719.4)[18]。将纯菌TF-1接种到已灭菌的50 mL的LB培养基中富集,作为种子液。
1.2 培养基
无机盐培养基:CaCl2(0.1 g),MgSO4·7H2O(0.4 g),NH4Cl(2.02 g),KH2PO4(3.0 g),Na2HPO4·12H2O(17.7 g),NaCl(0.5 g),蒸馏水1 L,pH值:6.5~7.0。
LB培养基:酵母粉(5.0 g),蛋白胨(10.0 g),NaCl(5.0 g),蒸馏水1 L(培养基所需药品来自于成都市科龙化工试剂厂,分析纯)。
1.3 氯代脂肪烃对CB降解的影响实验
选取复合污染水体中普遍存在的氯代烃DCM、1,2-DCA、1,1,2-TCA、TCE和PCE为抑制剂开展研究,比较氯代脂肪烃中单双键结构及氯原子个数对抑制作用的影响。氯代脂肪烃及CB购买自阿法埃莎(天津)化学有限公司。
在无菌条件下,将一定量驯化后的TF-1菌悬液以4 000 r/min离心10 min,弃上清液,菌体用磷酸缓冲液洗涤2次。在上述实验得到的最适温度、pH值和接种量的基础上,在含60 mg/L CB的LB选择性培养基中,分别添加2、4、6和8 mg/L的 DCM、1,2-DCA、1,1,2-TCA、TCE和PCE,分装于125 mL血清瓶中,在30 ℃、160 r/min的摇床中培养。每间隔24 h,利用紫外分光光度计,选择600 nm的波长,UV-1800比色法测定不同条件下培养的菌液OD600,利用气相色谱监测CB浓度,每组实验均设3个平行组。
1.4 分析检测
氯代烃采用气相色谱检测,检测条件参见文献[9]。TF-1浓度采用分光光度计监测,数据处理及做图用Excel 2019和origin 2019软件。
1.5 半有效浓度曲线拟合
使用4参数逻辑函数拟合每个抑制剂的EC50值,它对应于底物/酶结合的50%的抑制,拟合的方程如下所示:
(1)
式中:A为与无限浓度相对应的B/B0(%)的最小值;D为对应于零浓度的B/B0(%)的最大值;logC为以中值抑制浓度(EC50)的自然对数表示的S型曲线的拐点;B为该点的希尔斜率C;X是抑制剂的浓度。
(2)
式中:A为吸光度;A0为被分析物零剂量时的吸光度;AXS为被分析物过量时的吸光度。
1.6 动力学拟合
TF-1对CB的降解符合Michaelis-Menten方程:
(3)
式中:rs为CB降解速率,mol/(gcell·h);rmax为CB最高降解速率,mol/(gcell·h);CS为CB浓度,mol/L;Km为米氏常数mol/L。
当有抑制剂存在时,抑制剂的酶抑制分为以下几种情况:
1) 竞争性抑制模型:微生物反应过程中抑制剂I在酶活性位点结合,阻碍酶与生长底物结合,致使酶促反应活性下降,特点为抑制剂对最大消耗速率无影响。该抑制方程如下:
(4)
式中:rSI为竞争性抑制的底物消耗速率,mol/(gcell·h);KmI为竞争抑制时米氏常数,mol/L;KI表示竞争性抑制时的解离常数,mol/L;CI为抑制剂的浓度,mol/L。
2) 非竞争性模型:生化反应过程中抑制剂与酶分子在非活性位点结合,该过程阻碍底物与酶结合,特点为方程中米氏常数不变,非竞争性抑制方程如下:
(5)
式中:rI,max为非竞争性抑制的底物最大消耗速率。
3) 反竞争性模型:生化反应过程中抑制剂不能直接与酶相结合,只能与酶和底物组成的复合物相结合,生成三元复合物,进而抑制底物催化。反竞争性抑制方程为:
(6)
以上公式推导参考文献[19]。
2 结果与讨论
2.1 氯代烷烃存在下CB的降解特性
在温度为30 ℃、CB浓度为100 mg/L的培养基中,研究典型氯代烷烃DCM、1,2-DCA、1,1,2-TCA为抑制剂时,TF-1对CB的降解特性,培养7 d后的CB浓度变化如图1所示。当DCM浓度为2 mg/L时,CB的降解率能够达到61.08%;浓度分别为4、6、8 mg/L时,CB的降解率达到37.84%、34.87%、42.07%,随着DCM浓度的升高,抑制效果也在逐渐增强。当1,2-DCA为抑制剂时,在4个不同浓度梯度下,降解率均在35%左右,对TF-1有较强的抑制作用;当1,1,2-TCA为抑制剂时,浓度分别为2、4、6、8 mg/L时,降解率均在30%左右,对CB的降解效果最差,说明对TF-1的抑制效果最强。由此表明,有氯代烷烃存在条件下对TF-1降解CB有较强的抑制作用,并且1,1,2-TCA抑制效果最强。由此推断,当氯代烷烃的结构越复杂,抑制效果越明显。
研究表明[20],氯代有机溶剂的毒性与其辛醇水分配系数(logPo/w)密切相关,DCM、1,2-DCA和1,1,2-TCA的logPo/w值分别为1.25,1.48和2.17,logPo/w值越高,溶剂的脂溶性越强,高脂溶性对细胞膜的破坏性更强,可能是1,1,2-TCA毒性强的主要原因。

图1 氯代烷烃存在下TF-1对CB降解曲线
2.2 氯代烯烃存在下CB的降解特性
同样在温度为30 ℃、含有100 mg/L CB的培养基中添加氯代烯烃,研究TCE、PCE为抑制剂时对TF-1降解CB的影响。培养7 d后CB的浓度变化如图2所示,当以TCE为抑制剂时,浓度分别为2、4、6、8 mg/L时,所对应的CB降解率分别为61.08%、37.84%、34.88%、42.07%,平均降解率分别为1.37、0.841、0.751、0.935 mg/(L·d),随着浓度逐渐增大,TCE对TF-1降解CB的抑制效果在不断增强。当PCE为抑制剂时,浓度分别为2、4 mg/L时,对CB的降解率能够达到50%左右,浓度分别为6、8mg/L时,对CB的降解率能够达到35%左右,抑制情况与TCE相似。
TCE和PCE的logPo/w值分别2.4和2.88,相较于氯代烷烃,氯代烯烃对TF-1降解CB的抑制作用相对较弱,表明双键作用可减小有机溶剂毒性。在结构方面,氯代有机溶剂往往通过破坏细胞膜影响细胞的结构和完整性,明晰溶剂作用下细胞结构的变化也是下一步研究的重点。
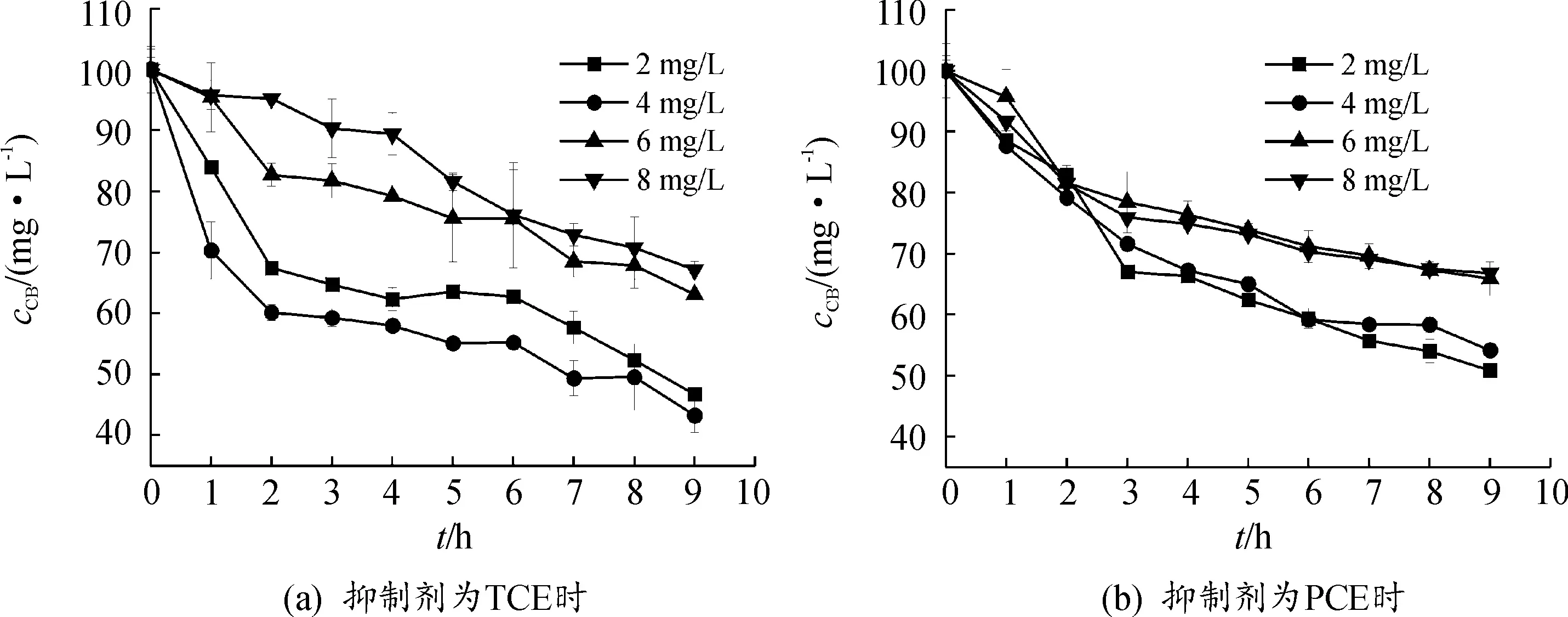
图2 TF-1在氯代烯烃存在下CB的降解特性
2.3 半数抑制效应浓度分析(EC50)
氯代脂肪烃为抑制剂时对TF-1的半数抑制效应浓度如图3所示,通过EC50我们可以了解到当TF-1受到50%抑制时及一半失活时,氯代脂肪烃所需浓度。氯代烷烃DCM、1,2-DCA、1,1,2-TCA的EC50值分别为3.42、3.16、3.12 mg/L,当DCM浓度达到3.42 mg/L时,才能抑制TF-1一半失活,而1,1,2-TCA浓度为3.12 mg/L时就能够抑制TF-1一半失活,发现随着氯代烷烃的结构复杂程度越大,半数抑制浓度在逐渐减小,说明氯代烷烃结构的复杂化可增强对TF-1的抑制。
氯代烯烃TCE和PCE的EC50分别为6.57和3.16 mg/L,半数效应抑制浓度相较于氯代烷烃有所增大,说明氯代烯烃对TF-1的生长抑制有所减弱,但是随着氯原子数目的增多,氯代烯烃的抑制作用显著增强。Joanna等[20]发现不同菌株对氯代烃的EC50差异很大,相同条件下不同菌株对相同氯代烃的EC50可相差几十倍;实验中发现厌氧菌的PCE和1,2-DCA的EC50值分别为149.2 mg/L和1217.2 mg/L,表明厌氧菌株对氯代烃的耐受能力更强。

图3 DCM、DCA、TCA、TCE、PCE为抑制剂时对TF-1的EC50浓度曲线
2.4 多种抑制模型拟合



图4 3种抑制形式的线性拟合(A:竞争性抑制;B:非竞争性抑制;C:反竞争性抑制)

表1 不同抑制形式的可决系数
2.5 抑制机理分析
本研究中,CAHs对TF-1降解表现为非竞争性抑制,抑制机理如图5所示。无抑制剂存在时,底物可与酶活性位点顺利结合,当抑制剂与酶非活性位点结合后,活性位点受到阻碍作用,无法进一步与底物结合,这导致底物催化反应速率迅速降低[23]。解离常数是衡量抑制剂抑制酶活的重要参数,由表2可以看出TCA的解离常数KI为7.54 mg/L,rI,max的变化范围分为9.99~16.12,明显大于无氯代脂肪烃的KI,说明该氯代烷烃在浓度为2~8 mg/L的范围内就会明显抑制TF-1降解菌的活性。DCM非竞争性抑制时的rI,max变化范围为3.87~6.84,解离常数KI为19.2 mg/L,随着CAHs浓度的不断增大,rI,max在逐渐减小,抑制效应增大。将TCA的rI,max变化范围9.99~16.12 mg/L和DCM的rI,max变化范围3.87~6.84 mg/L进行比较,发现TCA的抑制效果明显强于DCM,且三氯乙烷在较低的浓度时(2~8 mg/L)对TF-1就有很强的抑制效应,而TCE、PCE(2.23~4.71 mg/L、2.23~6.92 mg/L)只有微弱的影响。随着氯原子数增多,解离系数KI变小,说明CAHs饱和程度影响抑制情况。因此,在CB与氯代脂肪烃混合污染中,增大底物浓度无法消除氯代脂肪烃的抑制,需首先去除污染中的氯代脂肪烃。
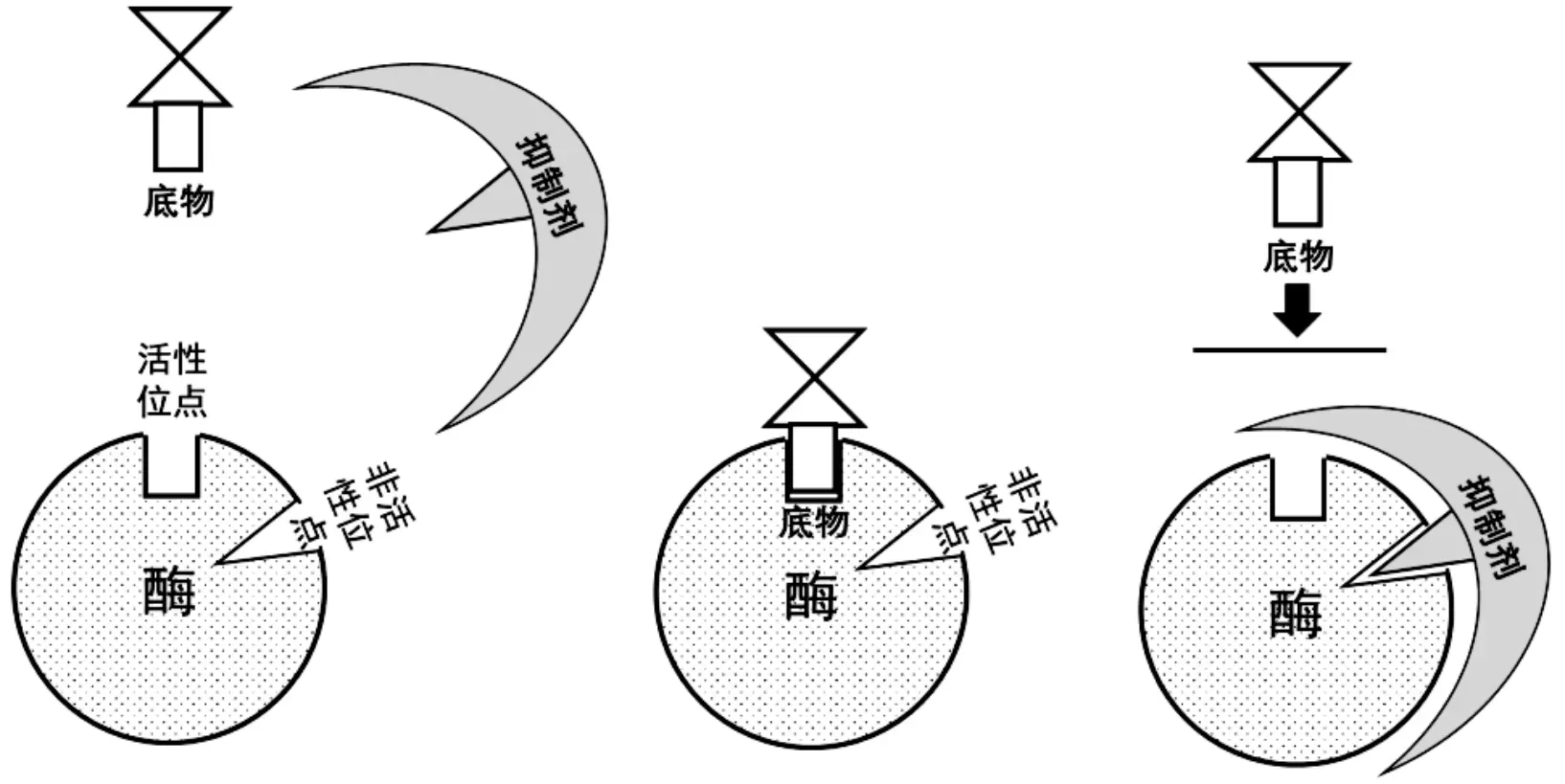
图5 非竞争性抑制机理

表2 非竞争性抑制拟合结果
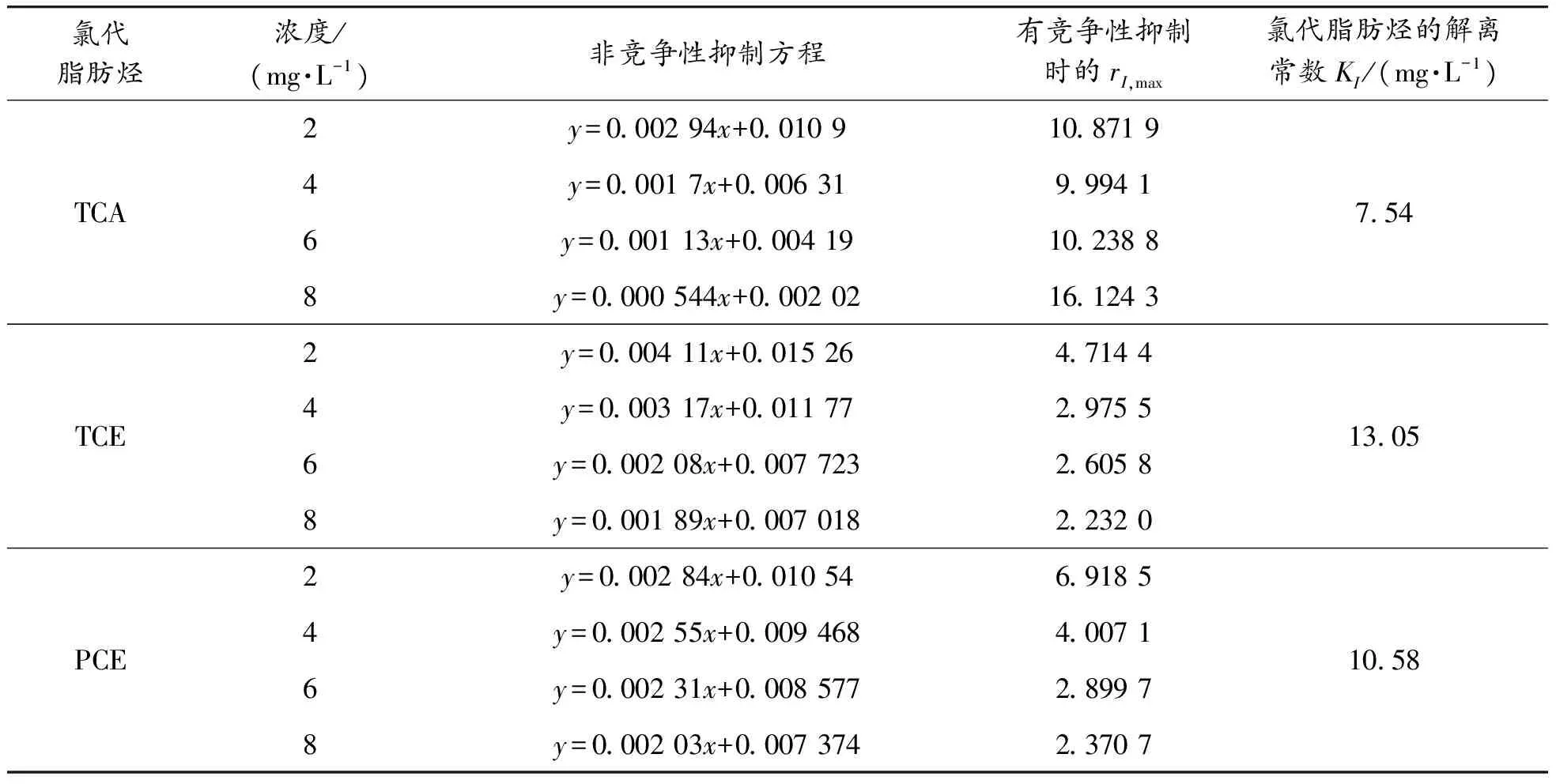
续表(表2)
3 结论
1) 在氯代脂肪烃对CB降解的影响及抑制动力学的研究中,不同氯代脂肪烃为抑制剂时,对TF-1降解CB的抑制效果各有不同。当氯代烷烃为抑制剂时,对TF-1降解CB有较强的抑制作用,其中1,1,2-TCA抑制能力最强;氯代烷烃的EC50值为3.12~3.42 mg/L,其中DCM的半数抑制效应浓度最大,其值为3.42 mg/L;其次是1,2-DCA及TCA,EC50值分别为3.16和3.12 mg/L,氯代烷烃结构复杂毒性越强。
2) 氯代烯烃的半数效应抑制浓度相较于氯代烷烃有所增大,TCE和PCE的EC50分别为6.57和3.16 mg/L,说明氯代烯烃对TF-1的生长抑制有所减弱,但是随着氯原子数目的增多,氯代烯烃的抑制作用显著增强;并且当PCE为抑制剂时,对TF-1的生长抑制效果与1,1,2-TCA相当。
3) 动力学拟合结果表明:CAHs对TF-1均表现为非竞争性抑制。抑制剂与酶非活性位点结合,而后阻碍底物与活性位点结合,污染处理中需首先考虑去除抑制剂。在DCM,1,2-DCA,1,1,2-TCA,TCE和PCE抑制作用下,解离系数KI分别为19.2,9.96,7.45,13.05和10.58 mg/L,说明氯代烷烃结构复杂毒性越强;随着氯原子数目的增多,抑制作用显著增强。
