不同中性盐胁迫对甜菜幼苗光合作用和抗氧化酶系统的影响
2022-02-18蔡琪琪董寅壮於丽华王宇光
蔡琪琪 王 堽 董寅壮 於丽华 王宇光 耿 贵,
(1黑龙江大学生命科学学院,150080,黑龙江哈尔滨;2黑龙江大学现代农业与生态环境学院,150080,黑龙江哈尔滨)
盐渍化是影响全球生态环境的重要限制因素之一[1]。全球大约有 1×109hm2的盐碱地,其中含NaCl和Na2SO4等中性盐的盐土约占23%[2]。NaCl和 Na2SO4等中性盐胁迫对植物生长发育有影响,且 NaCl和 Na2SO4对不同植物的影响有差异。研究[3]发现,NaCl和 Na2SO42种中性盐胁迫对苦豆子种子萌发均有抑制作用,且 Na2SO4胁迫的影响比 NaCl弱。对四翅滨藜的研究[4]也发现,NaCl胁迫抑制效果比Na2SO4胁迫强。而对鞑靼滨藜的研究[5]表明,Na2SO4胁迫的毒害程度高于NaCl胁迫。
甜菜(Beta vulgaris L.)是世界及中国北方主要糖料作物之一,具有良好的耐盐性,在我国新疆、内蒙古和黑龙江等盐碱地区种植较多[6]。目前,国内外对甜菜的耐盐性均有研究,但至今仍未完全了解其耐盐机制。为进一步揭示甜菜耐盐机制,本试验选用中性盐NaCl和Na2SO4对甜菜进行胁迫,以期通过对比2种盐对甜菜影响的差异,了解其耐盐机制。植物受到盐胁迫后,光合作用往往受到抑制,同时抗氧化酶系统被激活来抵抗逆境,因此,本研究通过分析不同中性盐胁迫对甜菜苗期光合作用及抗氧化酶系统影响的差异,为甜菜在不同盐碱地的筛选种植及生产布局提供依据,并为后期进一步研究甜菜对NaCl和Na2SO4的耐受机制提供参考。
1 材料与方法
1.1 试验材料及培养方法
以实验室保留的甜菜品种‘KWS1176’的丸粒化种子为材料。采用蛭石培养进行催苗,在25℃条件下催苗 5d,挑选长势均匀的幼苗进行移栽,用1/2 Hoagland营养液在光照培养室进行水培,光照有效辐射 460±15[μmol/(m3·s)],光照时间 6:00-20:00,昼夜温度分别为(25±2)℃和(20±2)℃,相对湿度65%~70%。
如表1,水培8d后对甜菜分别进行NaCl、Na2SO4及其混合盐胁迫处理,每种中性盐处理设置 2个Na+水平胁迫(中度胁迫LS:140mmol/L Na+;重度胁迫 HS:280mmol/L Na+),另外设置不加盐对照(CK)。其中,混合盐为NaCl与Na2SO4按相同Na+占比混合而成,其阴离子所带电荷量也相同,即NaCl与Na2SO4的摩尔比为2:1。所用化学试剂均为分析纯。培养过程中不间断向营养液中通入空气。每5d更换一次培养液,培养至18d时收获并测定相关指标。

表1 不同处理NaCl和Na2SO4添加量Table 1 The amount of NaCl and Na2SO4 added in different treatments mmol/L
1.2 测定项目及方法
1.2.1 甜菜幼苗生长相关指标 将收获的甜菜幼苗整株放入烘箱内,105℃杀青 35min,然后调至75℃烘干至恒重,使用分析天平称重,即为甜菜干重。将甜菜叶片完整剪下,并平铺在扫描仪上扫描,用 WINRHIZO Reg 2003b分析软件对扫描后的图片进行分析,计算甜菜的叶面积[7]。
1.2.2 甜菜光合作用相关指标 利用 95%乙醇研磨提取法测定甜菜叶片的叶绿素a(Chl a)、叶绿素 b(Chl b)、总叶绿素(Chl)及类胡萝卜素(Caro)含量[8]。用CI-340手持式光合仪(CID公司,美国)测定甜菜第2对真叶净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)和细胞间CO2浓度(Ci)。
1.2.3 甜菜叶片中抗氧化系统相关指标 采用抽滤法测定叶片相对电导率;采用硫代巴比妥酸显色反应法测定丙二醛(MDA)含量;采用氮蓝四唑法测定超氧化物歧化酶(SOD)活性;采用乙二胺四乙酸法测定抗坏血酸过氧化物酶(APX)活性;采用聚乙烯吡咯烷酮法测定过氧化氢酶(CAT)活性;采用愈创木酚法测定过氧化物酶(POD)活性[9-10]。
1.3 数据处理
用Microsoft Office Excel 2016软件进行数据整理及绘图;用SPSS分析软件进行方差分析和差异显著性检验(P<0.05)。
2 结果与分析
2.1 盐胁迫对甜菜幼苗生长的影响
盐胁迫影响植物生长发育,首先表现在对其生物量的累积上。如图1a所示,甜菜幼苗在不同中性盐处理下,其单株干重均有所下降。在 140mmol/L Na+浓度下,NaCl、Na2SO4和混合盐处理的甜菜单株干重与 CK相比分别下降了 12.14%、38.53%和17.93%;280mmol/L Na+浓度下,3个处理分别下降了52.57%、68.94%和57.34%。说明Na2SO4处理对甜菜生物量累积的影响最大,NaCl处理最小。叶面积是重要的形态指标。如图1b所示,在各组中性盐处理下,甜菜的叶面积均有所下降。在相同Na+浓度下,NaCl处理的甜菜叶面积较CK下降较少,混合盐处理次之,Na2SO4处理下降最多,140mmol/L Na+浓度下分别下降了 13.88%、39.31%和 35.07%,280mmol/L Na+浓度下分别下降了54.39%、72.11%和65.01%。

图1 不同中性盐处理对甜菜幼苗单株干重和叶面积的影响Fig.1 The effects of different neutral salt treatments on the dry weight per plant and leaf area of sugar beet seedlings
2.2 盐胁迫对甜菜幼苗叶片光合生理的影响
2.2.1 不同盐胁迫对甜菜光合色素含量的影响
植物在盐胁迫下,其体内光合色素会趋向分解。如图2所示,在不同中性盐胁迫下,甜菜叶片的光合色素含量较CK均有所下降。首先,Chl含量可以直观地反映NaCl、Na2SO4和混合盐3种处理对甜菜叶绿素影响的差异。在相同Na+浓度下,NaCl处理的甜菜叶片Chl含量下降最少,混合盐处理次之,Na2SO4处理下降最多:在140mmol/L Na+浓度下,3个处理分别下降了16.28%、24.15%和35.46%;在 280mmol/L Na+浓度下,分别下降了 39.82%、44.09%和 62.08%。在相同 Na+浓度下,混合盐和NaCl处理对甜菜Chl a含量的影响差异不显著,说明二者对甜菜叶片Chl a含量的影响没有差异。而Na2SO4与混合盐和 NaCl处理的差异显著,说明Na2SO4对甜菜的影响较大。同时发现,在中性盐处理下,Chl b下降幅度大于Chl a,在140mmol/L Na+浓度下,NaCl处理的Chl a含量下降了4.38%,而Chl b含量下降了31.68%,说明Chl b对中度盐胁迫更敏感。类胡萝卜素作为光合色素,不仅参与光合反应,还能有效清除叶绿体内过剩的激发能,减少活性氧[11]。结果(图2d)显示,不同中性盐处理的甜菜叶片Caro含量的变化趋势与Chl a相似,且Na2SO4处理对甜菜Caro含量的影响更大。

图2 不同中性盐处理对甜菜幼苗叶片Chl、Chl a、Chl b及Caro含量的影响Fig.2 Effects of different neutral salt treatments on the contents of Chl, Chl a, Chl b and Caro of leaves of sugar beet seedlings
2.2.2 不同盐胁迫对甜菜幼苗光合参数的影响如图3所示,不同中性盐处理后,Pn、Tr及Gs均有所下降,而Ci有所上升,且Na2SO4胁迫影响大于NaCl。
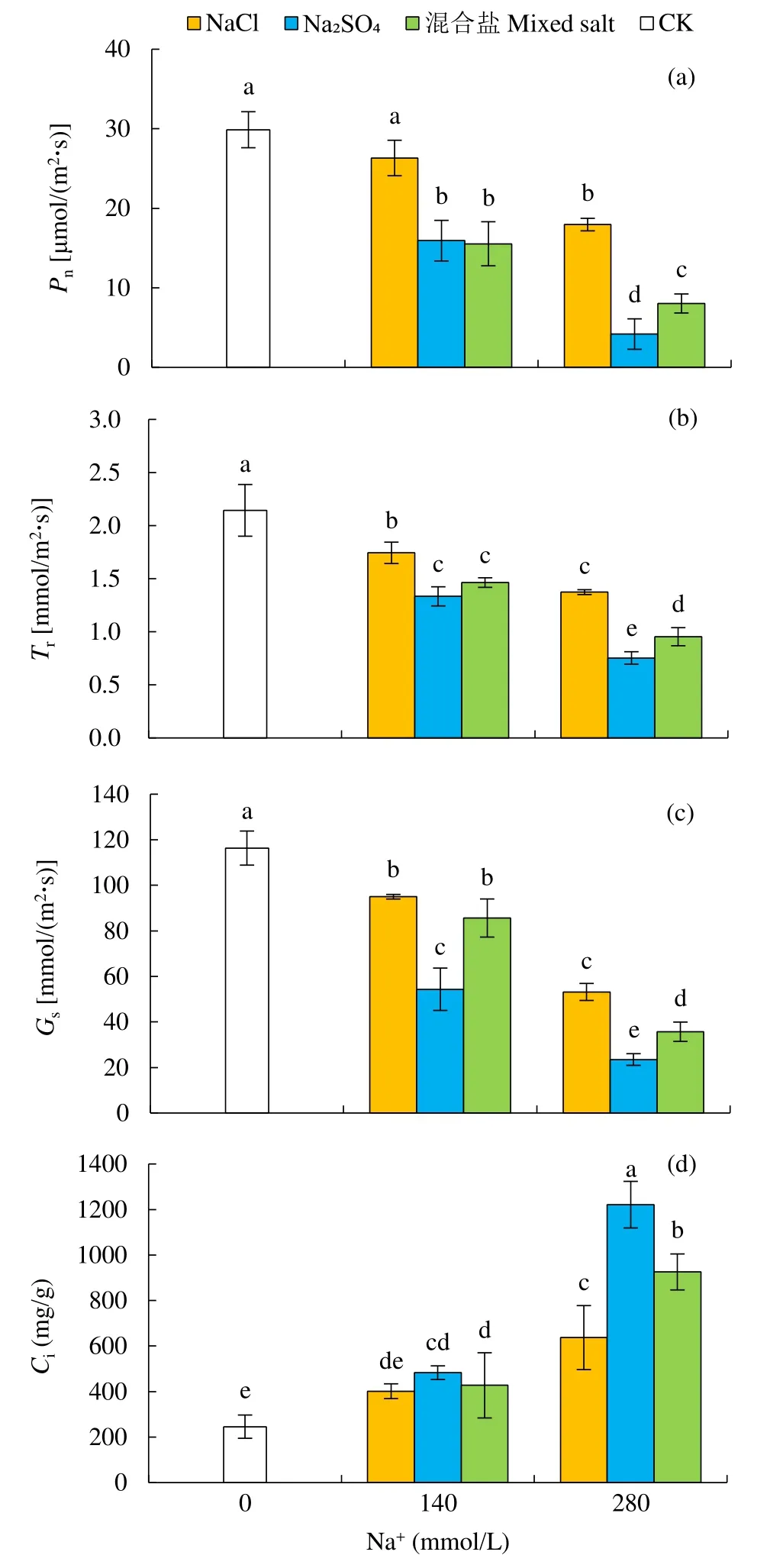
图3 不同中性盐处理对甜菜幼苗Pn、Tr、Gs和Ci的影响Fig.3 Effects of different neutral salt treatments on Pn, Tr, Gs and Ci of sugar beet seedlings
其中,不同中性盐对甜菜Pn和Tr的影响差异一致,在140mmol/L Na+浓度下,Na2SO4和混合盐处理的甜菜Pn无显著差异(P<0.05),且Na2SO4和混合盐处理的甜菜Pn下降幅度大于NaCl处理,甜菜Tr的显著性差异与Pn表现一致。NaCl、Na2SO4和混合盐处理的Pn分别下降了11.90%、46.68%和48.00%,Tr分别下降了18.66%、37.79%和31.73%。与Pn和Tr的变化不同,140mmol/L Na+浓度下,混合盐和NaCl处理的Gs无明显差异,NaCl、Na2SO4和混合盐处理分别下降了 26.40%、53.29%和18.36%,可见Na2SO4处理的甜菜Gs下降幅度大于混合盐和NaCl处理,表明Na2SO4对甜菜Gs的影响更大。同时发现盐胁迫使甜菜幼苗的Ci显著升高(P<0.05),且 Na2SO4处理的变化幅度最大,在140mmol/L Na+浓度下,NaCl、Na2SO4和混合盐处理依次升高了159.25%、396.93%和276.68%。
2.3 盐胁迫对甜菜幼苗叶片抗氧化系统的影响
2.3.1 盐胁迫对甜菜幼苗叶片相对电导率和 MDA含量的影响 结果(图4)显示,随着盐胁迫浓度的上升,甜菜叶片相对电导率及MDA含量显著提高(P<0.05);在相同Na+浓度的盐胁迫下,与CK相比,Na2SO4处理的甜菜积累的MDA更多,相对电导率也更大,混合盐处理次之,NaCl处理最小。

图4 不同浓度盐胁迫下叶片相对电导率和MDA含量变化Fig.4 Changes of relative conductivity and MDA content in leaves under salt stress of different concentrations
从图 4a看出,在 140mmol/L Na+浓度下,NaCl、Na2SO4和混合盐处理的甜菜相对电导率较CK分别提高了209.52%、303.91%和236.68%;在280mmol/L Na+浓度下,3个处理的相对电导率较CK分别提高了316.19%、384.04%和348.43%。可以看出,在不同中性盐处理下,甜菜幼苗叶片相对电导率均显著提升(P<0.05),且Na2SO4处理的相对电导率提高幅度最大,即 Na2SO4处理的甜菜膜系统受害程度最严重。
从图4b看出,甜菜叶片中MDA含量均随盐处理浓度的提高而显著上升(P<0.05),且Na2SO4处理积累的 MDA明显较其他 2个处理多。在140mmol/L Na+浓度下,NaCl、Na2SO4和混合盐处理的MDA含量分别较CK提高了20.02%、29.17%和27.53%;在280mmol/L Na+浓度下,3个处理的MDA含量分别较 CK提高了 34.16%、44.22%和37.09%,即随着盐浓度的提高,甜菜叶片细胞脂膜过氧化程度加重,且Na2SO4处理的细胞脂膜过氧化程度最严重。
2.3.2 盐胁迫对甜菜叶片抗氧化酶活性的影响
植物受到盐胁迫时,细胞内会积累大量活性氧,导致细胞内各组分受损。结果(图5)表明,甜菜抗氧化酶活性随着盐浓度的升高而升高,且 Na2SO4胁迫的甜菜抗氧化酶活性最高,混合盐处理次之,NaCl处理最低。
SOD是生物体清除活性氧自由基的首要物质。如图 5a所示,在 140mmol/L Na+浓度下,NaCl、Na2SO4和混合盐处理的SOD活性分别比CK提高了2.16%、6.53%和4.10%;280mmol/L Na+浓度下分别提高7.10%、14.36%和10.18%。APX主要负责清除植物体内的 H2O2,且其反应生成物在清除活性氧方面也起到重要作用[11]。由图5b所示,在140mmol/L Na+浓度下,甜菜叶片APX活性较CK显著提高(P<0.05),NaCl、Na2SO4和混合盐处理分别提高了 61.11%、100.42%和 84.19%。在280mmol/L Na+浓度下,APX活性进一步提升,NaCl、Na2SO4和混合盐处理叶片APX活性分别提高了120.95%、139.87%和129.22%。由图5c可见,CAT活性的变化在低盐和高盐处理下差异较大:NaCl处理在低盐和高盐处理下叶片 CAT活性较CK分别提高了16.78%和41.10%,Na2SO4处理的叶片CAT活性较CK分别提高了30.94%和60.93%,混合盐处理则分别提高了27.67%和46.41%。

图5 不同中性盐处理甜菜SOD、APX、CAT和POD活性的变化Fig.5 The changes in SOD, APX, CAT and POD activities of sugar beet treated with different neutral salts
POD被誉为植物氧化胁迫的标志酶,可以清除线粒体、内质网或细胞液中产生的 H2O2[12]。如图5d所示,在中度和重度盐胁迫下,甜菜POD活性均表现为Na2SO4>混合盐>NaCl。
3 讨论
3.1 不同盐胁迫对甜菜幼苗生长及光合生理的影响
植物幼苗干重是衡量植物生长状况的综合指标之一。研究[7]表明,干物质累积量会随着盐害程度的增加而减少。本研究发现,Na2SO4处理的甜菜单株干重下降幅度最大,说明Na2SO4对甜菜的毒害作用最强。甜菜作为草本植物,地上部分主要为叶片,且叶片是进行光合作用的主要器官,因此叶面积既可以表现甜菜的生长情况,又可以反映其光合作用的效率。本研究中,盐处理的甜菜叶面积较CK均呈下降趋势,进一步证实甜菜的生长在盐胁迫下受到抑制,且Na2SO4对甜菜生长发育的影响大于NaCl和混合盐。
光合作用能将光能转化为有机物并放出能量,维持植物生长,对植物的生长发育具有重要意义。分析光合作用各项指标发现,盐胁迫下甜菜光合作用受到抑制,且 Na2SO4处理受抑制程度最大,光合色素含量表现为 Na2SO4<混合盐<NaCl。光合色素是植物进行光合作用的重要物质,其主要作用为吸收光能,并将光能转化为电能,因此,其含量可以衡量植株对光能的利用率[13]。对甜菜的研究[14]发现,随着盐胁迫程度的加深,其叶片光合色素含量逐渐降低,即盐胁迫对甜菜的毒害作用越强,光合色素含量下降幅度越大。
另外,根据Chl a、Chl b和Caro含量变化可以发现,盐胁迫对Chl b含量的影响最大,表明Chl b对盐胁迫更敏感,这可能与甜菜的耐盐生理机制有关,还需进一步研究。而甜菜Chl a和Caro在盐胁迫下的变化趋势相近,表明Chl a和Caro对不同中性盐的响应变化一致。
光合作用限制酶主要受到CO2浓度的调控,因此气孔是重要的光合限制因子之一。本试验中,不同中性盐处理的甜菜叶片 Gs均表现为下降,表明盐胁迫会引起气孔关闭。盐胁迫引起气孔关闭的原因分为气孔限制和非气孔限制,前者是盐胁迫引起叶片含水量降低,使气孔关闭,导致Ci下降,进而引起光合速率的降低,即光合速率的降低是植物生理调节引起的;后者是由于盐胁迫降低了光合速率,引起Ci升高,进而引起气孔的关闭,即盐胁迫直接影响了光合作用[15]。本研究中,Pn、Tr及Gs下降的同时,Ci有所上升,表明光合速率降低的主要原因是非气孔限制。
3.2 不同盐胁迫对甜菜幼苗抗氧化酶系统的影响
植物在逆境中,由于代谢紊乱会产生过量活性氧,造成氧化胁迫。体内活性氧清除系统不足以抵消生成的活性氧便会引起细胞膜氧化损伤[15],通常用相对电导率和 MDA含量来衡量细胞膜受损的程度[16]。研究[17]发现,随着盐浓度的升高,葡萄幼苗的相对电导率和MDA含量呈上升趋势。本研究发现,不同中性盐胁迫下甜菜的MDA含量及相对电导率均显著高于 CK(P<0.05),表明不同中性盐处理甜菜幼苗细胞膜系统的稳定性均遭到破坏。同时对比发现,在相同Na+浓度下,Na2SO4处理的MDA含量和相对电导率变化均较大,混合盐处理次之,NaCl处理最小。说明Na2SO4处理的甜菜细胞质膜受到盐胁迫损伤较严重,细胞膜透性大大提高,导致进入细胞中的MDA含量增加[18]。
为有效抵御氧化胁迫,植物在长期的进化过程中形成了一套抗氧化系统,以防御活性氧和自由基对膜脂的伤害,并有利于维持膜结构的完整性。其中SOD、POD、CAT和APX在抗氧化代谢中起着关键作用[15]。
本研究发现,不同中性盐处理的甜菜幼苗的SOD、APX、CAT和POD活性均明显高于CK,这与前人的研究[19]结果相同,说明甜菜在盐胁迫下,能够通过累积抗氧化酶来减轻对膜系统的过氧化伤害[20]。抗氧化酶活性随着盐浓度的增高而增加,说明随着盐害程度的加重,植物需要累积更多的抗氧化物酶来清除过多的活性氧,从而降低细胞受到的损害,较大程度地维持植物正常生长。而对比相同Na+浓度下3个中性盐处理的SOD、APX、CAT及POD活性发现,Na2SO4胁迫的甜菜各类抗氧化酶活性均高于其他二者,说明 Na2SO4胁迫对甜菜幼苗的伤害大于其他处理。
从光合作用和抗氧化酶系统2个方面的分析发现,甜菜对相同Na+浓度条件下NaCl和Na2SO42种中性盐的耐受程度不同,由此推测甜菜对 Cl-和SO42-2种阴离子的适应机制可能存在差异。后续可以针对这一情况进行分子水平的研究,探索甜菜对2种离子的适应机制,并进一步揭开植物耐盐机制。此外,本研究使用水培方式进行培养,而在实际生产中,甜菜栽培主要在土壤中进行,土壤成分更加复杂,SO42-容易与其他物质结合沉淀,进而出现与水培不同的生长情况,因此接下来将采取土培方式对其进行研究,以期为不同盐碱地选择甜菜栽培品种提供更详尽的理论依据。
4 结论
不同种类中性盐对甜菜幼苗的影响存在差异。在水培条件下,Na2SO4胁迫对甜菜幼苗的影响大于NaCl胁迫。对光合作用和抗氧化系统相关指标进行分析,Na2SO4胁迫对甜菜光合作用抑制及氧化损伤更严重,混合盐次之,NaCl较轻。
