人工模拟寒冷环境对呼吸道合胞病毒感染幼鼠肺组织中病毒载量及肺损伤的影响
2022-02-17张秀英王雪峰赵航宇穆婧雯杨梦飞
张秀英,王雪峰,王 蕾,赵航宇,穆婧雯,刘 清,杨梦飞
(1. 辽宁中医药大学附属医院,辽宁 沈阳 110032;2. 辽宁中医药大学,辽宁 沈阳 110032)
呼吸道合胞病毒(RSV)是婴幼儿急性下呼吸道感染最常见的病原,常引发病毒性肺炎和毛细支气管炎,是儿童生命健康的重大威胁之一[1-2]。RSV感染有明显的季节性,北方地区多在寒冷季节流行,南方地区多在湿度大的季节流行,说明RSV病毒的传播与气温、相对湿度密切相关[3-4]。目前寒冷气候条件对肺组织RSV载量及肺损伤的影响程度尚不清晰,因此本实验以幼鼠为研究对象,借助人工气候箱模拟外界寒冷气候进行了相关研究。
1 实验材料与方法
1.1病毒 RSV-long株,首都儿科研究所提供,冻存于辽宁中医药大学附属医院病毒室,半数组织培养感染量为10-3。
1.2动物 SPF级SD雌性大鼠18只,鼠龄3~4周,体重60~80 g,购自武汉大学,动物合格证号:2021-0065。饲养于恒温、恒湿动物房,温度保持(23±2)℃,湿度(50±6)%,自由饮水、摄食。本实验按照《实验动物使用管理指南》(中国,2011年) 进行。
1.3主要仪器 全外排Ⅱ级生物安全柜(BSC-1300II B2,西班泰克);精密轮转切片机(LEiCA RM2016,上海徕卡仪器有限公司);石蜡包埋机(JB-L5,武汉俊杰电子有限公司);系统生物显微镜(Nikon YS100,Nikon);低温高速离心机(SCT-12 SCILOGCX);荧光定量PCR仪(Bio-Rad荧光定量PCR仪CFX96,美国伯乐);RT-PCR试剂盒(反转录试剂盒:ABScript Ⅲ RT Master Mix for qPCR with gDNA remover;qPCR试剂盒:ABclonal 2X Universal SYBR Green Fast qPCR Mix);人工气候箱(恒温恒湿试验箱HD-E702-800,海达仪器);移液器(Finnpipette);电热恒温培养箱(武汉一恒苏净科学仪器有限公司,37 ℃);洗板机(Tianshi,988洗板机);酶标仪(Rayto,RT-6100,450 nm波长);恒温摇床(HT-111B,上海赫田);电子天平(1.120 g/0.1 mg电子分析天平,AE1204型,上海良平);电子分析天平(XB220A型,瑞士PRECISA);搅拌器(81-2恒温磁力搅拌器);细胞破碎仪(EasyWeLL系列,JY98-ⅢN型);白细胞介素-8(IL-8)ELISA试剂盒(武汉傲星生物科技有限公司,AX1571)、肿瘤坏死因子-α(TNF-α)ELISA试剂盒(武汉傲星生物科技有限公司,AX29322)。
1.4实验方法 幼龄大鼠适应性饲养7 d后,随机分为对照组、RSV感染组、RSV感染+寒冷环境组,每组6只。对照组幼鼠给予生理盐水滴鼻,常温下饲养;RSV感染组幼鼠给予RSV滴鼻感染,常温下饲养;RSV感染+寒冷环境组幼鼠给予RSV滴鼻感染后4 h放入制备寒环境气候的人工气候箱[温度(6±2)℃],每天刺激4 h,其余时间正常环境饲养,连续刺激7 d。各组幼鼠均自由进食饮水。
1.5检测指标及方法
1.5.1肺组织中RSV病毒载量 7 d刺激结束后,禁食1 d,无菌摘除大鼠肺脏,每只各取30 mg肺组织在液氮中充分研磨,研磨时加入1 mL Trizol,用匀浆器匀浆处理。从NCBI GenBank下载基因序列,用Primer premier 5.0软件进行序列分析并设计引物,依据引物优化原则确定引物的Tm值、GC含量及3’末端稳定性等基本参数[3],引物由武汉金开瑞生物科技有限公司合成。RSV引物序列:上游5’-AACTAATGCATTGGCTAAGG-3’,下游5’-TTGTAACACTGGCATTGTTG-3’,产物大小为548 bp。参照物为GAPDH,上游5’-GACATCAAGAAGGTGGTGAAG-3’,下游5’-TGGAAATTGTGAGGGAGATGC-3’,产物大小为336 bp。提取总RNA,计算总RNA含量。RNA纯度A260/A280在1.8~2.2范围内。基因组DNA去除体系:5 μL 200 ng/L total RNA,2.0 μL 5×g DNA Eraser Buffer,1.0 μL gDNA Eraser,2.0 μL RNase Free dH2O,反应体系10 μL 。PCR 仪反应条件:42 ℃ 2 min,4 ℃保存。RT反应体系:2X Universal SYBR Green Fast qPCR Mix 10 μL,DNA模板1 μL,正向引物(10 μmol/L)0.4 μL,反向引物(10 μmol/L)0.4 μL,ddH2O to 20 μL;反应过程:预变性95 ℃ 3 min,循环反应(变性95 ℃ 5 s,退火/延伸58 ℃ 30 s,循环50次)。反应结束后通过熔解曲线分析来鉴定PCR产物的特异性。使用Sequence Detection System软件分析PCR过程各检测样本的Ct值。
1.5.2肺湿干比 取各组大鼠左侧肺组织,滤纸吸干血迹后称湿重,然后置于60 ℃烤箱中烘烤72 h,再称干重,计算出肺湿干重比。
1.5.3肺组织病理检查 取各组大鼠左侧肺脏,经4%多聚甲醛固定后石蜡包埋,连续切片,脱蜡,HE染色后镜下观察。每张切片随机选高倍视野5个,根据肺泡充血、出血、血管壁中性粒细胞浸润和肺泡间隔增厚的程度进行病理学评分,4项指标得分相加为总分[5]。
1.5.4肺泡灌洗液中炎性因子含量 大鼠处死后,分离主支气管,结扎右主管,注射器抽取0.5 mL生理盐水注入主气管,然后回抽,反复操作3次,收取1.5 mL肺泡灌洗液,然后离心收集上清液。按照ELISA试剂盒说明书检测IL-8、TNF-α含量。
1.6统计学方法 用GraphPad Prism8软件进行统计学分析作图,组间差异比较采用LSD检验,P<0.05为差异有统计学意义。
2 结 果
2.1各组大鼠肺组织RSV载量比较 RSV感染组、RSV感染+寒冷环境组大鼠肺组织中RSV载量均明显高于对照组(P均<0.05),且RSV感染+寒冷环境组明显高于RSV感染组(P<0.05)。见图1。
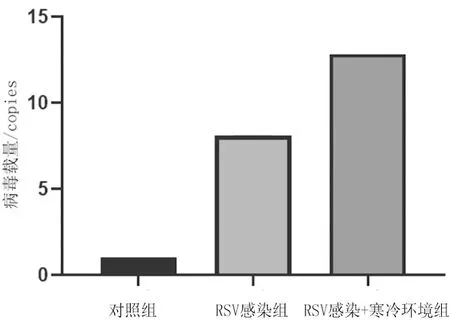
图1 对照组和呼吸道合胞病毒感染7 d各组大鼠肺组织病毒载量
2.2各组大鼠肺湿干比比较 RSV感染组、RSV感染+寒冷环境组大鼠肺湿干比均明显高于对照组(P均<0.05),且RSV感染+寒冷环境组明显高于RSV感染组(P<0.05)。见图2。

图2 对照组和呼吸道合胞病毒感染7 d各组大鼠肺湿干比
2.3各组大鼠肺组织形态学表现及肺组织病理损伤评分比较 对照组大鼠肺组织未见异常变化;RSV感染组大鼠肺泡壁轻度或中度充血、水肿,肺泡壁增厚,管腔内可见炎性渗出物;RSV感染+寒冷环境组肺泡壁重度充血、水肿,肺泡壁明显增厚,管腔内可见大量炎性渗出物。RSV感染组、RSV感染+寒冷环境组肺组织病理损伤评分均明显高于对照组(P均<0.05),且RSV感染+寒冷环境组明显高于RSV感染组(P<0.05)。见图3及图4。

图3 对照组和呼吸道合胞病毒感染7 d各组大鼠肺组织HE染色表现(×200)
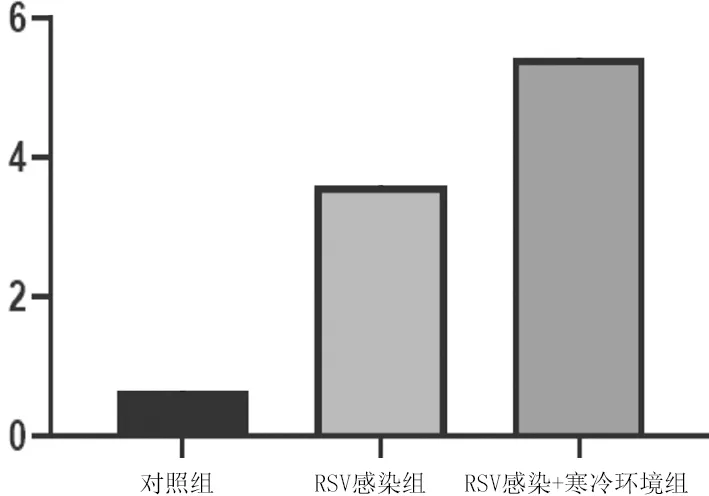
图4 对照组和呼吸道合胞病毒感染7 d各组大鼠肺组织病理评分
2.4各组大鼠肺泡灌洗液中炎性因子含量比较 RSV感染组、RSV感染+寒冷环境组大鼠肺泡灌洗液中IL-8、TNF-α含量均明显高于对照组(P均<0.05),且RSV感染+寒冷环境组均明显高于RSV感染组(P均<0.05)。见图5。

图5 对照组和呼吸道合胞病毒感染7 d各组大鼠肺泡灌洗液中IL-8、TNF-α含量
3 讨 论
中医学认为传染性疾病为六气所化六淫所致,即气候、致病因子、正气的强弱等多种因素共同作用导致宿主、病毒、环境之间的相关性失衡所引发[6-7]。寒邪伤卫阳,卫阳被遏不能奋起抗邪,驱邪外出,导致病毒在体内大量繁殖。“寒凝则血涩”,寒冷环境下呼吸道毛细血管痉挛、血流减慢,有利于病毒繁殖。现代研究显示寒冷环境下病毒活性增强,其在外界环境中的存活时间延长[8]。本实验使用人工气候箱模拟寒邪环境,结果显示RSV感染组、RSV感染+寒冷环境组大鼠肺组织中RSV载量、肺湿干比、肺组织病理损伤评分均明显高于对照组,且RSV感染+寒冷环境组均明显高于RSV感染组;病理观察发现肺组织病理损伤明显,且RSV感染+寒冷环境组更明显。提示寒冷环境下肺组织中RSV病毒载量大,肺损伤更明显。
既往研究认为,高载量的病毒在肺内复制,被气道上皮细胞模式识别受体如Toll 样家族受体、胞内病毒传感器视黄酸诱导基因1样受体和核苷酸寡聚化结构域样受体识别,释放大量炎症因子及趋化因子,诱发“炎症因子风暴”,破坏气道上皮细胞,导致肺免疫病理损伤[9-12]。TNF-α和IL-8与疾病严重程度密切相关[13]。TNF-α是炎症早期机体分泌的主要炎性因子,可促使中性粒细胞向肺泡和肺间质聚集,其过量分泌可释放溶酶体、氧自由基和髓过氧化物酶等而损伤肺组织;其还可产生血小板活化因子,增加肺血管壁通透性[14]。IL-8 是介导中性粒细胞聚集的趋化因子,参与炎症反应[15]。本实验结果显示,RSV感染组、RSV感染+寒冷环境组大鼠肺泡灌洗液中IL-8、TNF-α含量均明显高于对照组,且RSV感染+寒冷环境组均明显高于RSV感染组。说明RSV感染、RSV感染联合寒冷环境刺激均可导致IL-8和TNF-α释放,RSV感染联合寒冷环境刺激可引起二者大量释放,进而引起严重的肺损伤。
综上所述,寒冷环境对RSV诱导肺损伤时病毒载量、肺湿干比、病理损伤及相关细胞因子均有明显影响,肺组织中的RSV含量及肺损伤的程度与寒邪环境密切相关,提示疾病的产生不是致病因子单一作用的结果,与“天地人”这一生态系统的相互作用密切相关。
利益冲突:所有作者均声明不存在利益冲突。
