TTC在食品菌落总数中的应用研究
2022-02-17李人趙吴江霞付刚剑唐从霞
李人趙,吴江霞,付刚剑,唐从霞
(江中食疗科技有限公司,江西九江 332020)
菌落总数是指食品检样经过处理,在一定条件下(如培养基、培养温度和培养时间等)培养后,所得1 g或1 mL检样中形成的微生物菌落总数。目前,食品中菌落总数的测定一般采用《食品安全国家标准 食品微生物学检验 菌落总数测定》(GB 4789.2—2016)[1]中的平板计数琼脂倾注法,由于食品基质的不同,对于某些特殊样品(如米糊、米粉、奶粉等),此方法存在一定的局限性,如不进行优化容易造成较大的误差。例如,在测定米糊的菌落总数时,由于糊片基质小,吸水膨胀形成糊状,接种平板时会带入大量糊片,倾注培养基后糊片呈白色或米黄色,与菌落形态、颜色相似或接近,导致样品与菌落不易区分,在计数时容易将米糊和菌落混淆,造成计数结果出现偏差,影响结果的准确性。此外,部分菌落也会沿着米片生长或生长在米片内部,即使借助放大镜依然很难准确计数[2],只有经验丰富的检验员才能准确无误的计数。
2,3,5-三苯基氯化四氮唑(2,3,5-Triphenyl-2HTetrazolium Chloride,TTC)的氧化态为无色,而嗜中温性需氧菌在新陈代谢过程中产生的琥珀脱氢酶可以使无色的TTC被还原成不溶性的红色三苯甲臜,即在平板计数琼脂培养基中加入TTC,可以使菌落显红色[3]。本文对不同的TTC使用方法和使用浓度对测定菌落总数准确度的影响进行研究。
1 材料与方法
1.1 主要仪器
ACB-4A1超净工作台,新加坡艺思高科技有限公司(ESCO)生产;YXQ-LS-75G立式压力蒸汽灭菌器、BPX-272电热恒温培养箱和BGZ-146电热鼓风干燥箱,均为上海博迅实业有限公司医疗设备厂生产;PL602E电子天平和ML204T电子天平,梅特勒-托利多仪器(上海)有限公司生产;DK-98-11水浴锅,天津市泰斯特仪器有限公司生产;Scientz-11L拍击式均质器,宁波新芝生物科技股份有限公司生产。
1.2 试剂及溶液
TTC:上海蓝季生物;氯化钠:西陇科学股份有限公司;平板计数琼脂、无菌均质袋:北京陆桥技术股份有限公司;2%TTC溶液(称取2.0 g TTC于100 mL棕色容量瓶中,加入少量蒸馏水使其溶解,再用蒸馏水稀释至刻度,摇匀,放置于2~10 ℃冰箱中保存备用。使用前按照需要配制成适宜的浓度并灭菌备用)。
1.3 实验方法
1.3.1 判定方法
(1)颜色的判定。通过肉眼观察培养基及菌落的颜色。
(2)菌落总数的检测。参照《食品安全国家标准食品微生物学检验 菌落总数测定》(GB 4789.2—2016)执行。①称取25 g样品置盛有225 mL稀释液的无菌均质袋中,用拍击式均质器拍打1~2 min,制成1∶10的样品匀液。②用1 mL无菌吸管或微量移液器吸取1∶10样品匀液1 mL,沿管壁缓慢注于盛有9 mL稀释液的无菌试管中(注意吸管或吸头尖端不要触及稀释液面),在振荡器上振摇均匀,制成1∶100的样品匀液。③分别吸取1 mL上述2个稀释度的样品匀液于无菌培养皿内,每个稀释度做两个培养皿。同时,分别吸取1 mL空白稀释液加入两个无菌培养皿内作空白对照。④倾注15~20 mL冷却至46 ℃左右的平板计数琼脂培养基,并转动培养皿使其混合均匀,水平放置待琼脂凝固后,将平板翻转,于 36 ℃ ±1 ℃条件下培养 48 h±2 h。
(3)结果判定。①标准值:以未添加TTC溶液的结果作为标准值;②偏差度(Z值):表示结果与标准值的偏离程度,以“Z值=(检测值-标准值)/标准值*100%”计算;③判定:当|Z值|≤5%,表明检验结果与标准值偏差较小,为可接受的偏差;当|Z值|>5%,表明检验结果与标准值出现了偏离,为不可接受的偏差。
1.3.2 实验设计
(1)TTC加入方式的确定。配制3瓶100 mL平板计数琼脂培养基,培养基溶解后,其中1瓶(A号)不加2% TTC溶液,作为对照培养基;1瓶(B号)在灭菌前加入1 mL 2% TTC溶液,混匀;1瓶(C号)在灭菌后加入1 mL已灭菌的2% TTC溶液,混匀。分别观察并记录培养基的颜色,同时取同一份米糊样品进行菌落总数检测,观察并记录菌落形态。
(2)TTC溶液使用初步范围的确定。配制7瓶500 mL平板计数琼脂培养基,将培养基及15 mL 2%TTC溶液分别置于121 ℃高压灭菌15 min。灭菌结束,待冷却至(46±1) ℃时,分别向7瓶培养基加入经121 ℃高压灭菌的2% TTC溶液0 mL、0.05 mL、0.25 mL、0.50 mL、1.25 mL、2.50 mL和5.00 mL,摇匀。此时培养基中TTC的浓度分别为0%、0.000 2%、0.001 0%、0.002 0%、0.005 0%、0.010 0% 和0.020 0%[4]。使用这7瓶培养基分别对10份米糊样品进行菌落总数检测。其中以TTC添加浓度为0%的样品作为对照培养基培养计数,观察、记录菌落形态并计数偏离度Z值。
(3)TTC溶液适宜使用范围的进一步确定。配制7瓶500 mL平板计数琼脂培养基,灭菌结束,待冷却至(46±1) ℃时,按比例加入定量已灭菌的TTC溶液,使培养基中TTC的浓度分别为0.002%、0.002 5%、0.003 0%、0.003 5%、0.004 0%、0.004 5%和0.005 0%。使用这7瓶培养基对10份米糊样品再次进行菌落总数检测,以1.3.2(2)项下TTC添加浓度为0%的作为对照计数,观察、记录菌落形态并计数偏离度Z值。
2 结果与分析
2.1 不同顺序加入TTC溶液的效果
经过对培养基和菌落形态颜色效果观察,灭菌后加入TTC溶液最合适,结果见表1及图1。

图1 不同方式添加TTC的培养基及平板中菌落的颜色

表1 不同方式添加TTC对检测的影响表
2.2 TTC溶液的使用初步范围
由图2可知,经过对菌落形态颜色观察,当TTC溶液浓度低于0.002%时显色效果不明显,菌落呈浅红色,个别菌落未染色成功。

图2 不同TTC浓度的菌落形态颜色显示效果
由表2及图3可知,当TTC溶液浓度高于0.005%时,菌落结果呈下降趋势,表明此浓度对菌落有抑菌作用[5]。偏离度|Z|值>5%,表明该结果存在偏离,不宜采用。故TTC溶液初步使用范围宜在0.002%~0.005%。

图3 TTC浓度与平均菌落总数关系趋势图

表2 不同浓度TTC(0%~0.020 0%)对菌落总数的影响表
2.3 进一步确定TTC溶液的使用范围
由表3和图4可知,当TTC浓度高于0.003 5%时,菌落总数呈一定的下降趋势,表明此浓度TTC对菌落总数有一定的抑菌作用,TTC浓度在0.004 0%~0.005 0%时,偏离度|Z|值在5.90%~10.40%,偏离度|Z|值>5%,表明该结果存在偏离,不宜采用。结合2.2项下的结果建议TTC溶液的使用浓度为0.002 0%~0.003 5%
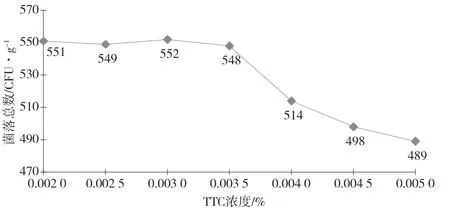
图4 TTC浓度与平均菌落总数关系趋势图

表3 不同浓度TTC(0.002 0%~0.005 0%)对菌落总数的影响表
3 结论与不足
3.1 结论
①当TTC与培养基混合后再灭菌,不仅菌落会被染色,培养基也会被染色,从而影响菌落计数。因此,在实际检验时,TTC应与培养基分开灭菌,在使用前按比例添加至46 ℃左右的培养基中,混匀后使用。②TTC浓度<0.002%时,菌落不显色或显浅粉色,在菌落计数时发现仍有部分菌落因未显色而容易忽略,导致结果偏低;TTC浓度在0.002 0%~0.003 5%时,菌落显明显的红色,可以很快点计菌落数,同时结果与未添加TTC的结果对照偏离值|Z|≤5%,差异很小,符合要求;当TTC浓度>0.003 5%时,菌落总数与浓度呈反比趋势,即TTC开始对菌落产生抑制作用,同时结果与未添加TTC的结果对照偏离值|Z|>5%,差异相对明显,结果偏离。故在食品菌落总数检测中TTC溶液的最适宜添加浓度为0.002 0%~0.003 5%。③本研究为麦片类、米粉(米糊)类等食品的菌落总数检测提供了科学可靠的优化方案,操作流程简单,结果准确,可推广性强。
3.2 不足
①自身颜色深的产品,如果粒橙、胡萝卜汁等不宜添加TTC,容易导致菌落显色与产品自身颜色混淆。②本文仅通过多次检测数据对TTC溶液的抑菌浓度进行判断分析,未经过菌种添加回收等方式研究计算高浓度TTC溶液对菌落总数的具体抑菌效果。
