胃肠道间质瘤中LMTK3、caspase 3及caspase 7的表达意义①
2022-02-17王世超成元华张艳慧张亚娟贵州医科大学病理学教研室贵阳550004
王世超 成元华 张艳慧 张亚娟 (贵州医科大学病理学教研室,贵阳 550004)
胃肠道间质瘤(gastrointestinal stromal tumor,GIST)是起源于 Cajal 间质细胞(interstitial cells of Cajal,ICC)的一种间叶源性肿瘤,具有不同的恶性潜能,可发生于胃肠道任何部位,好发于胃和小肠,其次为结、直肠,也可发生于腹腔内[1]。超过80%的GIST由KIT 基因或血小板源性生长因子受体α(plateletderived growth factor receptor alpha,PDGFRA)基因突变引起,而缺乏KIT/PDGFRA 基因突变的GIST 仅占10%~15%[2]。目前,对于GIST 的靶向治疗是以KIT/PDGFRA 活性为靶点,酪氨酸激酶抑制剂甲磺酸伊马替尼作为其靶向治疗药物已在临床广泛应用[3]。
狐猴酪氨酸激酶3(lemur tyrosine kinase 3,LMTK3)为丝氨酸-苏氨酸-酪氨酸激酶家族成员之一,该家族包括3 个亚型,分别为:LMTK1、LMTK2及LMTK3,主要参与细胞的分化及凋亡。其中,LMTK3 作为近年来新发现的肿瘤相关蛋白,在肿瘤的发生、发展过程中发挥着重要作用[4]。细胞凋亡失调是某些肿瘤发生发展的重要机制。半胱氨酸天冬氨酸蛋白酶(cysteinyl aspartate specific proteinase,caspase)家族是凋亡过程的重要参与者,其中caspase 2、caspase 8、caspase 9 及 caspase 10 是凋亡过程的启动因子,caspase 3 和caspase 7 则是凋亡过程的重要执行者。许多肿瘤的治疗方法都间接影响caspase的活性从而激活凋亡途径,进而清除肿瘤细胞[5-6];同时,LMTK3 对于 KIT 基因突变型 GIST 中KIT 基因的表达至关重要[7]。国外文献报道:在KIT基因突变型GIST 细胞系中LMTK3 具有正向调控KIT 蛋白表达的作用,从而促进GIST 细胞系增殖和生长[8];LMTK3 基因沉默导致 caspase 3 和 caspase 7活性显著增加,从而促进KIT 基因突变型细胞系的凋亡增加。本研究通过检测GIST 中LMTK3、caspase 3 及 caspase 7 蛋白的表达情况,探讨这 3 种蛋白表达与该肿瘤临床病理特征的关系,为临床准确评估GIST的预后和靶向治疗提供理论依据。
1 资料与方法
1.1 资料 收集 2014 年 9 月至 2018 年 9 月期间贵州医科大学附属医院病理科已确诊的GIST 患者的蜡块共102 例,其中具有肿瘤旁正常组织77 例,无肿瘤的切缘组织3 例;男性42 例,女性60 例;年龄29~83 岁,中位年龄 54 岁;≤54 岁者 46 例,>54 岁者56 例;肿瘤发生于胃69 例、肠道30 例及胃肠道外3 例;极低危险度23 例、低危险度28 例、中危险度20例及高危险度31例。
1.2 方法 采用免疫组化EnVision 二步法。石蜡包埋组织连续切片,厚4 μm;所用一抗包括:LMTK3多克隆抗体(Gene tex,1∶300)、caspase 3多克隆抗体(万类生物公司,1∶500)及 caspase 7 多克隆抗体(Affinity 生物公司,1∶70);三者均用EDTA(pH9.0)溶液进行高温高压抗原修复5 min;严格按照常规免疫组织化学方法染色,二氨基联苯胺(DAB)显色,苏木素复染细胞核,PBS代替一抗作为空白对照。LMTK3蛋白的阳性表达定位于细胞核和细胞质,caspase 3和caspase 7蛋白的阳性表达均定位于细胞质。
判读标准:每一张切片选取5 个高倍视野进行观察,采用双盲半定量法进行评分。①按染色强度评分:不着色为0 分,浅黄色为1 分,棕黄色为2 分,棕褐色为3分;②按着色细胞百分比计分:阳性细胞数≤5%为0 分,阳性细胞数6%~25%为1 分,阳性细胞数26%~50%为2 分,阳性细胞数≥51%为3 分。最终得分为①②两种评分相乘,总分0分计为阴性,1~2 分计为弱阳性,3~6 分计为阳性,7~9 分计为强阳性;总分<4 分视为低表达,总分≥4 分视为高表达[9]。
1.3 统计学处理 采用SPSS25.0软件进行统计学分析。计数资料比较采用秩和检验或χ2检验;相关性分析采用Spearman 等级相关分析法。P<0.05 为差异具有统计学意义。
2 结果
2.1 LMTK3、caspase 3 及 caspase 7 蛋白在 GIST 肿瘤组织及正常组织中的表达情况 LMTK3 蛋白表达于细胞核和细胞质中,正常组织高表达22 例,低表达58 例;在GIST 肿瘤组织高表达55 例,低表达47 例。LMTK3 在GIST 肿瘤组织中表达高于相应正常组织,差异有统计学意义(P<0.05,图 1A、B)。caspase 3 蛋白表达于细胞质中,正常组织低表达14 例,高表达 66 例;GIST 肿瘤组织低表达 79 例,高表达23 例,差异有统计学意义(P<0.05,图1C、D)。caspase 7 蛋白表达于细胞质中,正常组织中低表达25 例,高表达 55 例;GIST 肿瘤组织中低表达 95 例,高表达7例,差异有统计学意义(P<0.05,图1E、F)。
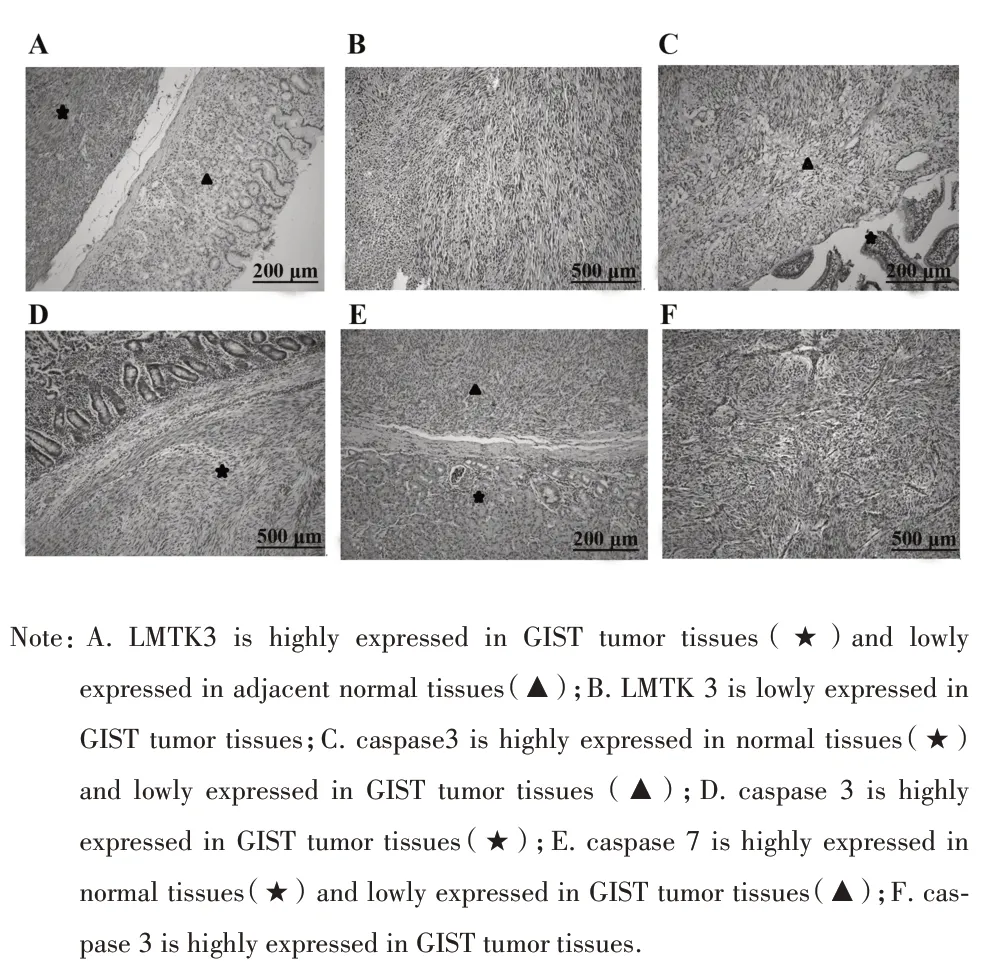
图1 GIST 肿瘤组织及正常组织中LMTK3、caspase 3 及caspase 7蛋白的表达情况Fig.1 Expressions of LMTK3,caspase 3 and caspase 7 protein in GIST tumor tissues and corresponding normal tissues
2.2 GIST 中 LMTK3、caspase 3 及 caspase 7 的表达与临床病理特征的关系 LMTK3 蛋白在肿瘤直径>5 cm 组中表达水平高于≤5 cm 组(P<0.05);核分裂像>5/50 HPF组中表达水平高于核分裂像≤5/50 HPF组(P<0.05);在中、高危险度分组中表达水平高于在极低和低危险度分组(P<0.05);LMTK3蛋白的表达在不同性别、年龄及肿瘤发生部位组间比较差异均无统计学意义(P>0.05)。caspase 3 和caspase 7蛋白在不同的肿瘤直径、核分裂象、肿瘤发生部位、危险度分级、年龄及性别组间比较差异均无统计学意义(P>0.05,表1)。

表1 GIST中LMTK3、caspase 3及caspase 7与GIST临床病理学特征的关系Tab.1 Relationship between expression level of LMTK3,caspase 3 and caspase 7 in GIST tumor tissues and clinicopathologic characteristics of GIST
2.3 LMTK3 蛋白表达与 caspase 3 及 caspase 7 蛋白表达的关系 在GIST 肿瘤组织中LMTK3 蛋白表达与caspase 3 及caspase 7 蛋白表达之间均无相关性(P>0.05)。
2.4 LMTK3 蛋白表达与GIST 患者预后的关系102例GIST患者中获访72例,随访时间24~72个月。死亡病例5 例,其中1 例因合并胃癌去世,4 例因GIST去世。在死亡病例中,4例LMTK3呈高表达,1例呈低表达。1例复发及转移,该例LMTK3呈高表达。
3 讨论
GIST 是胃肠道中最常见的间叶源性肿瘤,手术切除是首选治疗方式,但手术完整切除的患者仍可能复发或转移[10]。尽管靶向治疗药物伊马替尼可显著降低患者复发率、转移率并延长生存期,但仍有部分患者会出现继发性耐药,这可能与KIT 基因继发性突变有关[11-12]。KLUG 等[7]研究发现,LMTK3蛋白表达与KIT 基因继发性突变相关,因此进一步研究LMTK3 是有必要的,这可为GIST 发生、发展机制提出新的见解及对临床靶向药物治疗提供新的理论依据。近来发现,LMTK3 通过直接或间接途径参与雌激素受体通路、Wnt 信号通路、miR-34a 相关通路及FOXO3 相关通路,影响肿瘤的发生、发展[4]。LI等[13]研究表明,LMTK3 在胃癌组织中表达水平明显高于癌旁组织,并与肿瘤浸润深度和分期相关,LMTK3 阴性表达者术后生存率明显高于LMTK3 阳性者。夏鑫等[9]发现,LMTK3 在结直肠癌中表达水平明显高于癌旁组织,并且表达水平与淋巴结转移和 TNM 分期相关,LMTK3 高表达患者比 LMTK3 低表达患者预后差。LMTK3 也参与调控肺小细胞癌及乳腺癌等肿瘤的发生、发展[14-15]。因此,LMTK3主要促进肿瘤的增殖和侵袭。近年来,KLUG等[8]研究发现,LMTK3 能正向调控KIT 基因突变细胞的翻译,并促进KIT 基因突变型GIST 细胞株的生长与增殖。本研究结果显示,GIST 肿瘤组织中LMTK3 的表达水平明显高于相应正常组织,并在不同肿瘤直径、核分裂象计数及危险度分组之间有差异,提示LMTK3在GIST 肿瘤组织中高表达可能促进GIST 的生长和增殖,这与KLUG等的实验结果相似。
凋亡能清除体内衰老及异常的细胞,并在维持多种细胞功能方面有重要作用。caspase 3和caspase 7作为凋亡过程的执行者,对于肿瘤的发生、发展非常重要。研究表明caspase 3 蛋白在乳腺浸润性导管癌中低表达并与脉管侵犯相关[16];也可抑制肝癌的生长并诱导其凋亡[17]。而提高caspase 7 蛋白的表达可促进鼻咽癌肿瘤细胞的凋亡[18]。因此,caspase 3 和caspase 7 蛋白主要功能是抑制肿瘤细胞的增殖并促进凋亡。本研究结果显示:caspase 3和caspase 7 蛋白在正常组织中表达水平明显高于GIST 肿瘤组织,推测caspase 3和caspase 7的低表达与GIST肿瘤的发生和发展相关;但两者表达水平在不同性别、年龄、发生部位、肿瘤直径、核分裂像计数及危险度分组之间比较差异均无统计学意义(P>0.05)。caspase 3和caspase 7蛋白在GIST 肿瘤中的表达与临床病理特征的关系有别于其他上皮源性肿瘤,这一结果提示可能存在多种因素影响GIST的进展。KLUG 等[8]首先发现,沉默 LMTK3 会导致caspase 3和caspase 7活性增加,从而诱导GIST 细胞株凋亡,提示LMTK3 在GIST 中调控肿瘤生长的机制可能与凋亡相关。但本研究显示:LMTK3 蛋白表达与caspase 3 及caspase 7 蛋白表达之间无相关性;分析可能是由于KLUG 等实验所用细胞株为KIT 基因突变型GIST细胞,本实验所选取的肿瘤可能同时存在其他基因突变,而caspase 3 和caspase 7 作为凋亡过程的下游执行蛋白可能受其他基因调控影响,因此本实验结果与KLUG 等的实验结果不完全一致。国外学者通过实验推测,Wnt/β-catenin 信号通路的激活与 GIST 发生、发展相关[19-20]。SHI 等[21]研究发现,LMTK3 可作用于 Wnt/β-catenin 信号通路从而促进肿瘤的增殖。也有研究表明miR-34a 作为肿瘤抑制基因在GIST 细胞中表达会抑制细胞株的生长[22],因此推测 miR-34a 的沉默有助于 GIST 肿瘤细胞的增殖。而miR-34a 通过与LMTK3 mRNA 的3'-UTR 结合从而抑制其稳定性和转录翻译[23]。miR-34a 的表达增强会促进caspase 3 活性增加,从而抑制肿瘤生长[24]。因此,本研究结果与Klug 等试验结果不完全一致,可能是由于人体GIST 肿瘤组织中miR-34a 有不同程度的表达;也有可能由于本实验样本量相对较小有关,LMTK3 在GIST 发生、发展中的机制尚需进一步研究。
综上,LMTK3 在GIST 肿瘤组织中呈高表达,LMTK3 表达情况可以作为评估GIST 恶性潜能的新指标;增加caspase 3 和caspase 7 的活性,进而促进凋亡过程也可以作为GIST治疗的新思路。
