芍药苷对糖尿病肾病模型大鼠肾脏的保护作用及作用机制*
2022-02-17赵洪霄张金颖陈俊玲陶艳丽王学武
赵洪霄,李 英,张金颖,陈俊玲,陶艳丽,王学武
(新疆维吾尔自治区人民医院中医科,新疆 乌鲁木齐 830000)
糖尿病肾病(DN)为糖尿病的严重并发症,临床主要表现为水肿、蛋白尿、高血压、肾功能不全等肾脏病变,是导致患者病情向终末期肾病进展,并引起肾脏衰竭的主要原因,但目前尚无能阻止DN进展的有效方法[1]。肾脏炎症与氧化应激在DN的发生与发展中起重要作用[2],沉默信息调节因子1(SIRT1)/核因子E2相关因子2(Nrf2)/核因子−κB(NF−κB)信号通路与炎症及氧化应激相关途径的激活密切相关[3],以SIRT1/Nrf2/NF−κB作为靶标可能成为抑制DN氧化应激及炎症,发挥肾脏保护作用的潜在治疗策略。芍药苷为白芍总苷中的主要有效成分,具有抗炎、抗氧化、增强免疫力、利尿等多种药理学作用[4],能减轻DN模型小鼠肾组织损伤程度,改善肾组织炎性反应[5],但尚未明确其对DN的作用机制是否与SIRT1/Nrf2/NF−κB通路相关。本研究中通过对大鼠一次性腹腔注射链脲佐菌素(STZ)复制DN模型,探讨了芍药苷灌胃对DN模型大鼠肾功能的保护作用及作用机制。现报道如下。
1 材料与方法
1.1 仪器、试药及动物
仪器:ACCU−CHEK Advantage型血糖仪(德国罗氏公司);7600型全自动生化分析仪(日本日立公司);iMark型酶标仪、EC3型聚丙烯酰胺凝胶电泳装置、电泳仪(美国Bio−Rad公司);Olympus BX51型光学显微镜(日本Olympus公司)。
试药:芍药苷(中国食品药品检定研究院,批号为S02001601);卡托普利片(常州制药有限公司,批号为991023−3,规格为每片25 mg);STZ(美国Sigma公司,批号为2201601);苏木精−伊红(HE)染色试剂盒(北京索莱宝科技有限公司,批号为2041S02);肿瘤坏死因子−α(TNF−α,批号为20200211),白细胞介素1β(IL−1β,批号为20200318),白细胞介素6(IL−6,批号为20200109),超 氧 化 物 歧 化 酶(SOD,批 号 为20200217),丙二醛(MDA,批号为20200108),谷胱甘肽过氧化物酶(GSH−Px,批号为20200123)酶联免疫吸附试验(ELISA)检测试剂盒,均购自武汉博士德生物技术有限公司;SIRT1(批号为0104623),Nrf2(批号为0206725),NF−κB p65(批号为0203528),β−actin(批号为0106416)一抗,均购自Santa Crutz Biotechnology Inc.。
动物:SPF级SD大鼠50只,体质量(200±20)g,购自新疆医科大学实验动物中心,动物合格证号为SCXK(新)2018−0002,饲养于温度为20~25℃、相对湿度为50%~65%的SPF环境中,实验前适应性饲养1周。所有实验均经新疆维吾尔自治区人民医院实验动物伦理委员会审核批准。
1.2 方法
建模、分组及给药:随机选取10只SD大鼠作为空白组,其余大鼠均一次性腹腔注射STZ 60 mg/kg,空白组大鼠腹腔注射等体积生理盐水。注射72 h后尾静脉取血,并收集大鼠24 h内的尿液,检测各组大鼠空腹血糖及24 h尿蛋白定量(24 hpro),以连续3次血糖达到并超过16.7 mmol/L,24 hpro>30 mg为建模成功[6]。将建模成功的大鼠随机分为模型组、阳性对照组、芍药苷低剂量组、芍药苷高剂量组,各10只。芍药苷低、高剂量组分别灌胃芍药苷50,100 mg/kg,阳性对照组灌胃卡托普利30 mg/kg,空白组及模型组大鼠均予等体积生理盐水(每100 g体质量1 mL),每日1次,连续8周。
血、尿及生化指标观察:各组治疗结束后,以代谢笼收集大鼠24 h尿液,检测24 hpro;于大鼠腹主动脉取血,分离血清,采用ACCU−CHEK Advantage型血糖仪测定空腹血糖,采用7600型自动生化分析仪检测血清中尿素氮(BUN)和血肌酐(Cr)水平。
肾组织病理形态观察:大鼠腹主动脉取血,处死,解剖后取部分肾组织,于4%多聚甲醛溶液中固定,石蜡包埋,切片机切片5µm后进行HE染色,中性树胶封片,采用Olympus BX51型光学显微镜观察肾组织的病理形态。
肾组织中TNF−α,IL−1β,IL−6,SOD,GSH−Px,MDA水平检测(ELISA法):取大鼠肾组织500 mg,置预冷生理盐水中制成10%肾组织匀浆,以8 500 r/min的速率离心15 min,取上清液。采用ELISA法测定大鼠肾组织匀浆上清液中TNF−α,IL−1β,IL−6,MDA的水平及SOD,GSH−Px的活性。于酶标仪450 nm波长下检测各孔吸光度(OD),并建立标准曲线,计算各指标含量。
肾组织中SIRT1,Nrf2,NF−κB p65蛋白表达水平检测[蛋白免疫印迹(Western blot)法]:取大鼠肾组织100 mg,匀浆后加入RIPA裂解液,提取组织总蛋白,采用蛋白质定量(BCA)法于652 nm波长下测定SIRT1,Nrf2,NF−κB p65蛋白的浓度。将各蛋白样本稀释到固定浓度(5 µg/mL),制备12%分离胶和5%浓缩胶;加入10µL蛋白样品,电泳分离,冰上转膜,室温封闭2 h,一抗4℃孵育过夜,二抗室温孵育2 h,滴加显影液,凝胶成像并拍照,采用Image J软件进行定量分析。
肾组织中SIRT1,Nrf2,NF−κB p65 mRNA表达水平检测(Western blot法):取大鼠肾组织50 mg,采用Trizol法提取组织总RNA,测定总RNA浓度,逆转录试剂盒合成cDNA,进行聚合酶链式反应(PCR)扩增,以β−actin为参照。反应参数为95℃变性10 s,60℃退火30 s,72℃延伸30 s,扩增40个循环。用相对定量2−ΔΔCt法分析SIRT1,Nrf2,NF−κB p65 mRNA的表达量。基因引物序列见表1。

表1 基因引物序列Tab.1 Primer sequence of each gene
1.3 统计学处理
采用SPSS 20.0统计学软件分析。计数资料以±s表示,组间比较行t检验,组内行单因素方差分析比较。P<0.05为差异有统计学意义。
2 结果
2.1 血糖及24 hpro,BUN,Cr水平
与空白组比较,模型组大鼠的血糖及24 hpro,血清BUN,Cr水平均明显升高(P<0.01);与模型组比较,阳性对照组及芍药苷低、高剂量组大鼠上述指标水平均明显降低(P<0.05),且芍药苷高剂量组较低剂量组改善更明显。结果见表2。
表2 芍药苷对各组大鼠血糖及24 hpro,BUN,Cr水平的影响比较(±s,n=10)Tab.2 Effect of paeoniflorin on blood glucose and 24 hpro,BUN and Cr levels of rats in each group(±s,n=10)

表2 芍药苷对各组大鼠血糖及24 hpro,BUN,Cr水平的影响比较(±s,n=10)Tab.2 Effect of paeoniflorin on blood glucose and 24 hpro,BUN and Cr levels of rats in each group(±s,n=10)
注:与空白组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01。图2、表3至表5同。Note:Compared with those in the blank group,*P<0.05,**P<0.01(for Tab.2−5 and Fig.2);Compared with those in the model group,#P<0.05,##P<0.01(for Tab.2−5 and Fig.2).
组别空白组模型组阳性对照组芍药苷低剂量组芍药苷高剂量组血糖(mmol/L)7.46±2.49 28.17±9.62**11.68±4.60*##19.34±5.06**#15.92±6.83**##24 hpro(mg)13.42±2.88 76.41±11.32**29.59±7.45**##42.08±5.73**##35.59±9.27**##BUN(mmol/L)5.13±0.77 14.06±1.34**7.34±1.45**##10.48±1.14**##8.05±1.33**##Cr(mmol/L)22.57±3.04 45.19±8.09**26.57±5.30**##36.28±6.95**#30.36±4.75**##
2.2 肾组织病理形态
与空白组比较,模型组大鼠造模后出现多饮、多尿、消瘦等糖尿病典型症状,体质量明显下降,反应迟钝,毛色失去光泽。阳性对照组及芍药苷低、高剂量组灌胃给药后,症状较模型组减轻,体质量下降减缓,精神状态及毛色改善。HE染色显示,空白组大鼠肾组织结构未见异常变化;模型组大鼠肾小球面积增大,囊腔缩小,系膜及基底膜增生,肾间质充血,肾小管上皮细胞可见空泡变性,并伴有炎性细胞浸润;阳性对照组及芍药苷低、高剂量组大鼠肾小球面积缩小,肾小球系膜、基底膜增生,肾间质充血及肾小管上皮水肿情况均减轻,炎性细胞浸润减少,大鼠肾组织损伤明显改善。详见图1。
2.3 肾组织中TNF-α,IL-1β,IL-6水平
与空白组比较,模型组大鼠肾组织中TNF−α,IL−1β,IL−6水平均明显升高(P<0.01);与模型组比较,阳性对照组及芍药苷低、高剂量组大鼠肾组织中上述指标均明显降低(P<0.05),且芍药苷高剂量组较低剂量组降低更明显。结果见表3。
表3 芍药苷对各组大鼠肾组织中TNF-α,IL-1β,IL-6水平的影响比较(±s,ng/mL,n=10)Tab.3 Effect of paeoniflorin on the TNF-α,IL-1β and IL-6 levels in rats of each group(±s,ng/mL,n=10)
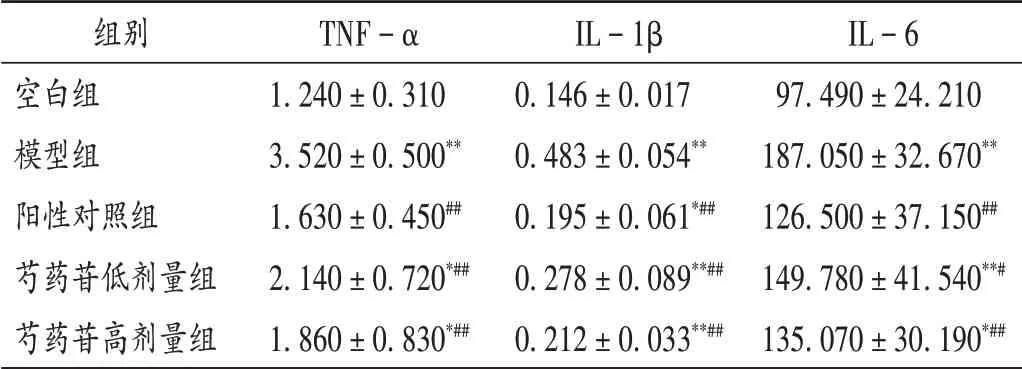
表3 芍药苷对各组大鼠肾组织中TNF-α,IL-1β,IL-6水平的影响比较(±s,ng/mL,n=10)Tab.3 Effect of paeoniflorin on the TNF-α,IL-1β and IL-6 levels in rats of each group(±s,ng/mL,n=10)
组别空白组模型组阳性对照组芍药苷低剂量组芍药苷高剂量组TNF−α 1.240±0.310 3.520±0.500**1.630±0.450##2.140±0.720*##1.860±0.830*##IL−1β 0.146±0.017 0.483±0.054**0.195±0.061*##0.278±0.089**##0.212±0.033**##IL−6 97.490±24.210 187.050±32.670**126.500±37.150##149.780±41.540**#135.070±30.190*##
2.4 肾组织中SOD,GSH-Px活性及MDA含量
与空白组比较,模型组大鼠肾组织中SOD和GSH−Px的活性均明显下降,MDA含量明显增多(P<0.01);与模型组比较,阳性对照组及芍药苷低、高剂量组大鼠肾组织中SOD和GSH−Px的活性均明显升高,MDA含量明显减少(P<0.01),且芍药苷高剂量组较低剂量组改善更明显。结果见表4。
表4 芍药苷对各组大鼠肾组织中SOD,GSH-Px活性及MDA含量的影响比较(±s,n=10)Tab.4 Effect of paeoniflorin on SOD,GSH-Px activity and MDA content in renal tissue of rats in each group(±s,n=10)
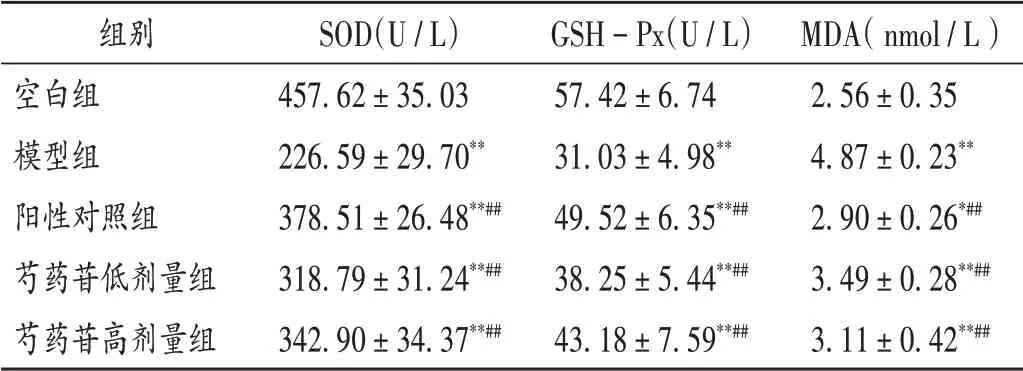
表4 芍药苷对各组大鼠肾组织中SOD,GSH-Px活性及MDA含量的影响比较(±s,n=10)Tab.4 Effect of paeoniflorin on SOD,GSH-Px activity and MDA content in renal tissue of rats in each group(±s,n=10)
组别空白组模型组阳性对照组芍药苷低剂量组芍药苷高剂量组SOD(U/L)457.62±35.03 226.59±29.70**378.51±26.48**##318.79±31.24**##342.90±34.37**##GSH−Px(U/L)57.42±6.74 31.03±4.98**49.52±6.35**##38.25±5.44**##43.18±7.59**##MDA(nmol/L)2.56±0.35 4.87±0.23**2.90±0.26*##3.49±0.28**##3.11±0.42**##
2.5 肾组织中SIRT1,Nrf2,NF-κB p65蛋白表达水平
与空白组比较,模型组大鼠肾组织中SIRT1和Nrf2的蛋白表达水平均明显降低,NF−κB p65的蛋白表达水平明显升高(P<0.01);与模型组比较,阳性对照组及芍药苷低、高剂量组大鼠肾组织中SIRT1和Nrf2的蛋白表达水平均明显升高,NF−κB p65的表达水平明显降低(P<0.05)。详见图2。

A.空白组B.模型组C.阳性对照组D.芍药苷低剂量组E.芍药苷高剂量组图1各组大鼠肾组织病理形态学(HE染色,×200)A.Blank group B.Model group C.Positive control group D.Paeoniflorin low−dose group E.Paeoniflorin high−dose groupFig.1 Patholmorphology of renal tissue of rats in each group(HE staining,×200)
2.6 肾组织中SIRT1,Nrf2,NF-κBp65mRNA表达水平
与空白组比较,模型组大鼠肾组织中SIRT1和Nrf2的mRNA表达水平均明显降低,NF−κB p65的mRNA表达水平明显升高(P<0.01);与模型组比较,阳性对照组及芍药苷低、高剂量组大鼠肾组织中SIRT1和Nrf2的mRNA表达水平均明显升高,NF−κB p65的表达水平明显降低(P<0.01)。结果见表5。
表5 芍药苷对各组大鼠肾组织中SIRT1,Nrf2,NF-κB p65 mRNA表达水平的影响比较(±s,n=10)Tab.5 Effect of paeoniflorin on SIRT1,Nrf2 and NF-κB p65 mRNA expression levels in renal tissue of rats in each group(±s,n=10)
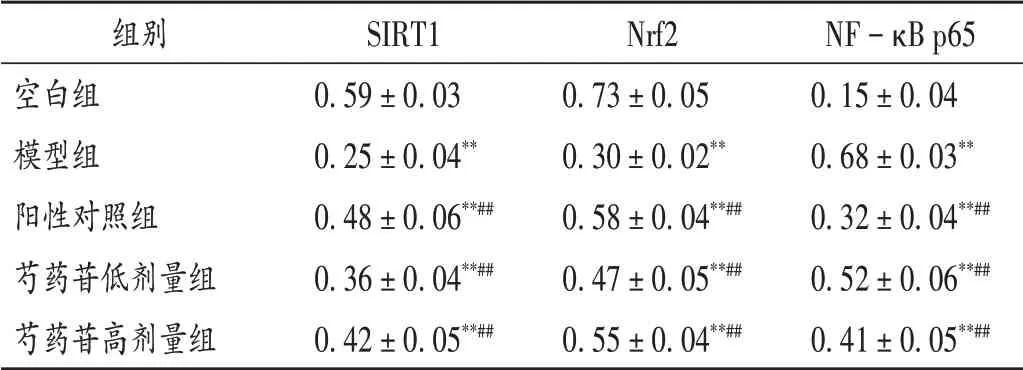
表5 芍药苷对各组大鼠肾组织中SIRT1,Nrf2,NF-κB p65 mRNA表达水平的影响比较(±s,n=10)Tab.5 Effect of paeoniflorin on SIRT1,Nrf2 and NF-κB p65 mRNA expression levels in renal tissue of rats in each group(±s,n=10)
组别空白组模型组阳性对照组芍药苷低剂量组芍药苷高剂量组SIRT1 0.59±0.03 0.25±0.04**0.48±0.06**##0.36±0.04**##0.42±0.05**##Nrf2 0.73±0.05 0.30±0.02**0.58±0.04**##0.47±0.05**##0.55±0.04**##NF−κB p65 0.15±0.04 0.68±0.03**0.32±0.04**##0.52±0.06**##0.41±0.05**##
3 讨论
DN的发病机制与肾脏炎症及氧化应激引起的肾功能损伤密切相关[2],其导致的持续高糖状态能引起机体的蛋白、脂类、DNA等发生改变,使机体抗氧化能力减弱,活性氧生成过量,损伤细胞结构,还可诱导细胞内多种炎性因子表达,进一步加重肾功能损伤[7−8]。
SIRT1是一类组蛋白去乙酰化酶,能调节机体氧化应激反应、炎性反应、细胞凋亡等多种生理病理活动[9],Nrf2等多种转录因子脱乙酰化,从而影响细胞内炎症与氧化应激相关途径的激活[10]。Nrf2是调控内源性抗氧化途径的一种核心转录因子,静止状态下与kelch样环氧氯丙烷相关蛋白1(Keap1)结合于细胞质中,活化的SIRT1能改变Keap1的构象,使Nrf2与其解离,易位进入细胞核而被激活,激活的Nrf2能调节抗氧化途径,提高组织和细胞的抗氧化能力,从而减轻肾脏氧化应激程度[11−12]。此外,Nrf2的活化还可通过调控NF−κB,抑制肾组织炎性细胞因子表达水平而发挥肾脏保护作用[13]。NF−κB是一种常见的促炎转录因子,能促进免疫细胞浸润及炎性细胞因子分泌,在多种炎性疾病中发挥作用[14]。SIRT1可通过使NF−κB p65亚基去乙酰化而抑制NF−κB活化,抑制其下游炎性因子的过度表达,阻止炎性进程[15]。SIRT1的活化可促进NRf2表达,并抑制NF−κB的转录活性,以SIRT1/Nrf2/NF−κB信号通路作为靶标,可能成为抑制DN氧化应激及炎症,从而发挥肾脏保护作用的潜在治疗策略。
白芍总苷是从毛茛科植物芍药的干燥根中提取的一种糖苷类物质,具有抗炎、镇痛、免疫调节等功效,在类风湿关节炎、系统性红斑狼疮等自身免疫反应疾病的治疗中发挥重要作用[16]。芍药苷是白芍总苷中的主要生物活性成分,能减轻DN模型小鼠肾组织损伤状态,改善肾组织炎性反应,但其对DN的潜在作用机制还未完全阐明。
本研究结果显示,芍药苷干预后DN模型大鼠一般症状较模型组明显改善,24 hpro及空腹血糖水平均明显降低。BUN和Cr是反映肾功能的重要指标[17],芍药苷灌胃给药后,DN模型大鼠血清中BUN及Cr的水平均较模型组明显降低,提示芍药苷能减轻DN模型大鼠症状,改善肾功能损伤,对DN具有明显的治疗作用。DN肾组织病理学特征主要为肾小球增大,系膜及基底膜增厚,肾小管上皮水肿,炎性细胞浸润等[18]。由图1可知,芍药苷能有效改善DN模型大鼠肾小球及肾小管组织学损伤状态,说明其能修复受损肾组织,在病理学层面证实其对DN肾功能的保护作用。肾脏炎性反应及氧化应激反应能刺激细胞增殖,导致肾小球系膜细胞及基质增生,与DN的发生与发展密切相关[19]。由表3可知,经芍药苷干预后,DN模型大鼠肾组织匀浆中的TNF−α,IL−1β,IL−6促炎细胞因子的表达水平均较模型组明显降低。SOD是体内氧自由基的天然清除剂,对于维持机体抗氧化能力具有重要作用;GSH−Px能清除体内有毒过氧化物,阻断自由基损伤,维持细胞内氧化还原状态[20];MDA是机体内脂质过氧化反应的产物,其含量的多少可反映机体氧化损伤程度[21]。由表4可知,经芍药苷干预后,DN模型大鼠肾组织匀浆中MDA含量较模型组明显减少,SOD及GSH−Px活性均较模型组明显升高,提示芍药苷可抑制DN模型大鼠肾脏炎性反应,改善体内过氧化状态,从而减轻肾组织损伤程度,发挥肾脏保护作用。由图2和表5可知,芍药苷明显上调了DN模型大鼠肾组织中SIRT1和Nrf2的蛋白及mRNA的表达,下调了NF−κB p65的表达,提示其对DN模型大鼠的肾脏保护作用可能与调控SIRT1/Nrf2/NF−κB途径相关。
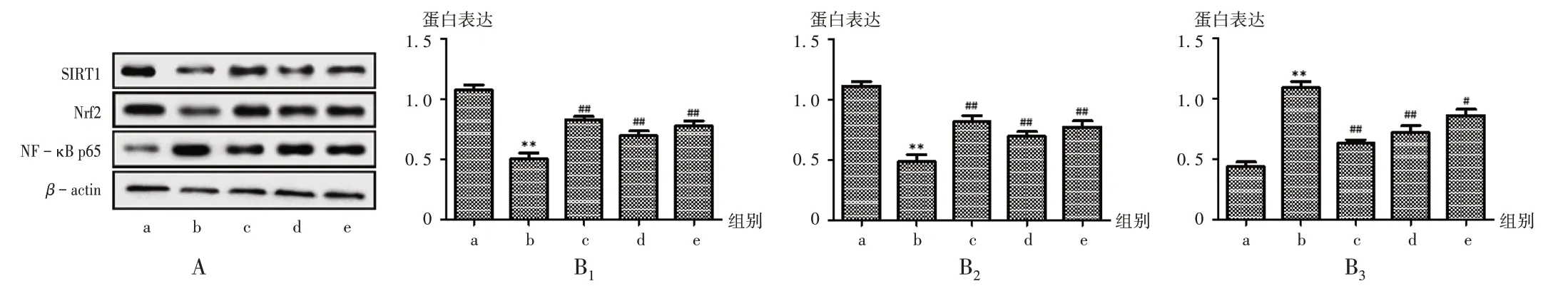
a.空白组b.模型组c.阳性对照组d.芍药苷低剂量组e.芍药苷高剂量组A.电泳图B1−B3.数据统计(分别为SIRT1,Nrf2,NF−κB p65)图2各组大鼠肾组织中SIRT1,Nrf2,NF-κB p65的蛋白表达水平a.Blank group b.Model group c.Positive control group d.Paeoniflorin low−dose group e.Paeoniflorin high−dose groupA.Electrophoretogram B1−B3.Data statistics(SIRT1,Nrf2,NF−κB p65,respectively)Fig.2 The expression levels of SIRT1,Nrf2 and NF-κB p65 protein in renal tissue of rats in each group
综上所述,芍药苷能明显改善DN模型大鼠的肾脏损伤状态,其作用机制可能与调控SIRT1/Nrf2/NF−κB信号通路,减轻肾脏氧化应激反应及炎性反应有关。
