一例猪沙门氏菌的分离鉴定及药敏试验
2022-02-17于新友李天芝
于新友,李天芝
(1.山东绿都生物科技有限公司,山东 滨州 256600;2.滨州渤海先进技术研究院,山东 滨州 256600)
沙门氏菌有2 500多个血清型,在环境中广泛存在,可感染多种动物和人,是一种人兽共患病原菌。猪沙门氏菌病又称仔猪副伤寒[1],是由猪霍乱沙门氏菌、鼠伤寒沙门氏菌和肠炎沙门氏菌等引起[2]。该病是一种急性、亚急性、慢性细菌性传染病,临床表现主要为败血、肠炎、肺炎、脑炎等[3]。各日龄猪均可感染,2~4月龄猪发病率、死亡率高[4]。一年四季均可发病,多雨潮湿季节多发[5]。易与多种疾病混感,猪群死亡率增加。病猪和带菌猪是主要传染源,主要通过消化道传播。病猪耐过后成为僵猪,生长发育缓慢[6]。该病在全球范围广泛流行,给养猪业造成严重的经济损失,随着禁抗时代的到来,该病在猪场发病率有增加趋势。
2021年4月滨城区周边某养猪场,共饲养32头保育猪,部分猪只精神沉郁,体温升高达42 ℃,食欲废绝,呼吸急促,眼有脓性分泌物,粪便灰黄色,恶臭,粪中带血,腹下部有紫色斑点,自行抗生素治疗,无明显效果,3 d后1头猪衰竭死亡,剖检可见脾脏肿大,质地硬如橡皮,切面呈蓝紫色;肾脏肿大、出血;肝脏有白色坏死点;肠系膜淋巴结肿大,肠黏膜坏死、脱落。无菌采集病死猪肝脏、脾脏等脏器作样品,进行细菌分离、形态学观察、PCR鉴定、生化试验、药敏试验及致病性试验,现报告如下。
1 材料
1.1 试验时间与地点
2021年4月11日至5月15日,在山东绿都生物科技有限公司质量监察部进行试验。
1.2 病料
对滨城区周边某养殖户疑似沙门氏菌病死猪解剖,无菌采取肝脏、脾脏等脏器。
1.3 试验用动物
18~22 g昆明小白鼠8只,购自山东省实验动物中心。
1.4 试剂
普通琼脂平板、血琼脂平皿、SS琼脂平皿、马丁液体培养基、LB液体培养基、革兰氏染色液如草酸铵结晶紫、革兰氏碘液、石炭酸复红染液等均由山东绿都生物科技有限公司质量监察部提供;糖发酵管及生化反应试剂和药敏纸片购自杭州天和微生物试剂有限公司; Pro Taq HS预混型探针法荧光PCR检测试剂购自艾科瑞生物, DL 2 000 DNA Marker、pMD18-T载体购自宝生物工程(大连)有限公司;质粒小量提取试剂盒、DNA凝胶纯化回收试剂盒等购自百泰克生物科技有限公司。
1.5 PCR引物设计
参照文献[7]根据沙门氏菌invA 基因序列引物和探针,引物序列为F:5'-CTGACCATT GGTGATGGTCTT-3',R:5'-TCGCCCAGATCCC CGCA-3',探针序列为P:5'-GGCACTAATCGCAA TCAACA-3',建立了检测沙门氏菌的通用型荧光PCR检方法,荧光基团标记为FAM,淬灭基团标记为BHQ1。引物和探针由通用生物系统(安徽)有限公司合成。
2 方法
2.1 直接涂片镜检
将无菌采取的病死猪肝脏、脾脏,玻片触片,后酒精灯火焰干燥、固定后,传统革兰氏染色,显微镜镜检观察结果。
2.2 细菌分离培养
将采集的猪肝脏、脾脏等无菌条件下划线接种于准备好的血琼脂培养皿,37 ℃培养24 h,观察生长情况,挑取平皿上单菌落涂片,革兰氏染色后镜检[5]。挑疑似菌落再次划线接种于SS琼脂培养皿,纯化培养,收获,按1∶20比例接种于马丁肉汤液体培养基,37 ℃培养24 h。
2.3 玻片凝集试验
取清洁玻片,移液器吸取20 μL沙门氏菌多价O血清至玻片上,吸取2.2制备的沙门氏菌纯培养物20 μL,枪头涂布混匀后,2 min观察反应结果。
2.4 生化鉴定
取2.2收集的纯化培养后的分离菌液,按试剂说明书进行糖发酵试验及其他生化试验。
2.5 PCR检测
取2.2收集的纯化培养后的分离菌液,提取细菌基因组DNA作模板,进行荧光PCR扩增反应。反应体系(20 μL):2×Pro Taq HS Probe Primix 10 μL,上游引物1 μL(10 pmol/L),下游引物1 μL(10 pmol/L),探针0.5 μL(10 pmol/L)。模板1 μL,加水补足至20 μL。扩增反应程序:95 ℃ 2 min;94 ℃ 10 s,55 ℃ 10 s,72 ℃ 20 s,45个循环。
2.6 药敏试验
药敏试验采用纸片琼脂扩散法,取2.2纯培养分离菌液,进行适当浓度稀释后,无菌棉签均匀涂布在血琼脂培养基上,用镊子夹取药敏纸片放置在平板上,保持纸片间适度距离,每个平板上最好不超过6张药敏纸片。将平板置于37 ℃恒温培养箱中培养24 h后,观察结果,测量并记录抑菌圈直径。
2.7 致病性试验
将8只昆明小鼠平均分为两组,试验组和对照组数量相同。按2.2操作制备分离细菌纯培养液,腹腔接种小鼠0.2 mL/只 (菌体含量5×108CFU/mL),对照组小鼠腹腔注射0.2 mL马丁液体培养基作对照。试验组和对照组小鼠分开饲养,连续观察7 d,记录小鼠状态,对死亡及试验结束存活小鼠剖杀,无菌采集肝脏、脾脏等,重新进行细菌分离。
3 结果与分析
3.1 直接涂片镜检
肝脏、脾脏触片后,革兰氏染色后镜检,可见红色短杆状两端钝圆菌体,呈单个或散在,符合沙门氏菌特性。
3.2 细菌分离培养
在血琼脂平皿上37 ℃培养24 h后,可见灰白色、圆形、隆起、边缘整齐圆润的菌落。在SS琼脂平皿上37 ℃培养24 h后,可见黑色、边缘整齐、湿润光滑菌落。挑单个菌落涂布于加生理盐水的玻片上,革兰氏染色,显微镜镜检观察,可见革兰氏染色呈阴性、单个存在、散在排列、两端钝圆的短小杆菌。马丁肉汤培养基培养时,菌液呈均匀浑浊,管底有灰白色沉淀物。
3.3 玻片凝集试验
枪头涂布混匀后,2 min内出现典型凝集现象,进一步表明所分离菌为猪沙门氏菌。
3.4 生化试验
由表1可知,所分离沙门氏菌不能发酵水杨苷、肌醇、菊糖、蔗糖、乳糖,能发酵葡萄糖、鼠李糖、木糖、果糖、半乳糖、麦芽糖、山梨醇、甘露醇、卫矛醇,H2S试验阳性,MR试验阳性,V-P试验阴性,靛基质试验阴性,与沙门氏菌的生化特征一致。

表1 分离菌的生化反应结果
3.5 PCR检测
采用沙门氏菌通用引物和探针对所分离菌进行荧光PCR检测,结果显示,所分离未知菌有S型扩增曲线(图1),阴性和阳性对照均成立,说明分离菌为沙门氏菌。
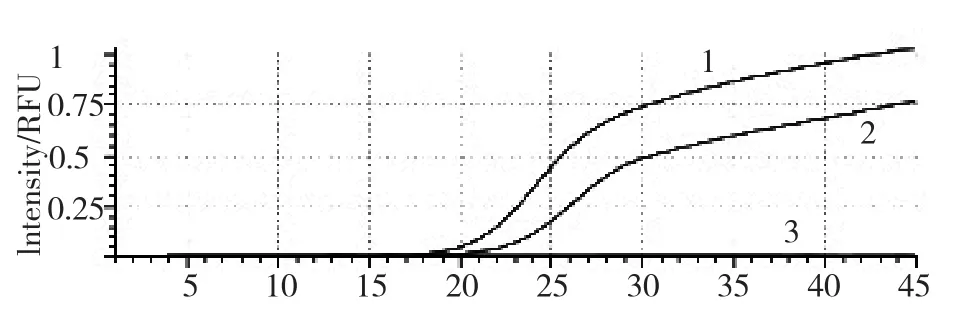
图1 分离菌荧光PCR扩增结果
3.6 药物敏感性试验
由表2可知,分离菌对头孢噻呋、丁胺卡那、磷霉素高度敏感,对强力霉素、恩诺沙星、环丙沙星中度敏感,对四环素、林可霉素、大观霉素、氟苯尼考、卡那霉素、庆大霉素、链霉素、阿莫西林耐药。
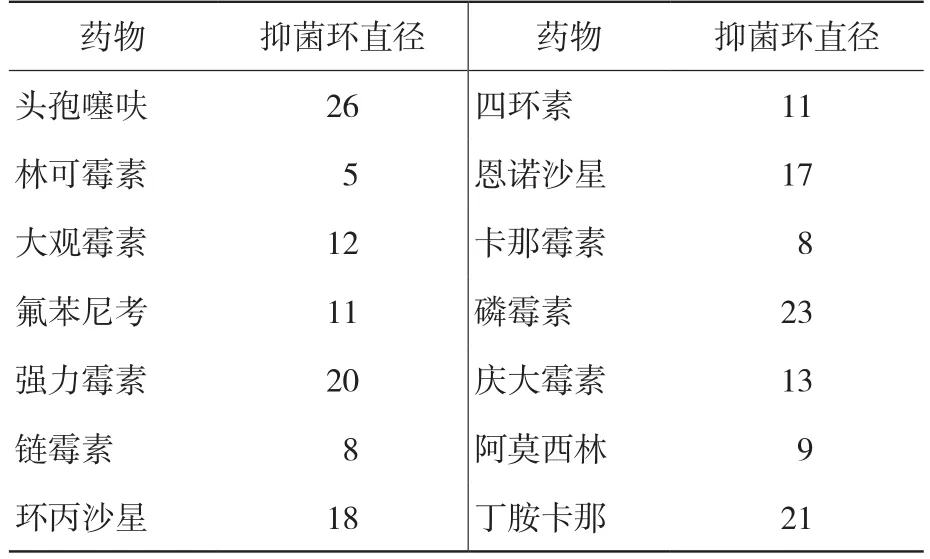
表2 分离菌株的药物敏感性试验结果 mm
3.7 致病性试验
试验组小鼠注射分离菌液10 h后,精神沉郁,采食和活动减少,20 h后被毛粗乱,对外界刺激反应迟钝,拉血便,30 h后1只开始死亡,72 h内试验组小鼠全部死亡。剖检可见小鼠肝脏有坏死点、脾脏肿大,肠道出血。无菌取肝脏,细菌分离后,革兰氏染色镜检,可见呈革兰氏染色阴性短小杆菌。对照组小白鼠全部健活,处死后剖检没有分离到细菌。
4 讨论
沙门氏菌是猪场环境中常在菌,对外界环境抵抗力强,广泛存在于环境和猪体中。当天气骤变、饲养管理不当、卫生条件不良、长途运输或猪群遭受其他应激时容易诱发。猪沙门氏菌病是猪的一种常见多发的细菌性传染病。对猪沙门氏菌病主要应以预防为主,饲喂优质全价配合饲料,不突然更换饲料。加强饲养管理,饮水中添加消毒剂。环境温度和湿度适宜,尽量减少猪群密度和不必要的应激。做好猪副伤寒活疫苗免疫接种工作,具体为怀孕母猪在产前20~25 d经口免疫,仔猪15~20日龄首免,间隔3~4周再免疫1次。做好猪瘟、伪狂犬病等其他常规疫苗的免疫接种工作。发病后可分离病原菌,进行药敏试验,选用敏感抗生素治疗,同时注意联合用药,以提高猪群治疗效果。
本试验对滨城区周边某养殖户送检猪病料进行细菌分离、生化试验、PCR检测、药敏试验和小鼠致病性试验。生化试验结果表明,该分离菌生化特征与沙门氏菌一致,不能发酵水杨苷、肌醇、菊糖、蔗糖、乳糖,能发酵葡萄糖、鼠李糖、木糖、果糖、半乳糖、麦芽糖、山梨醇、甘露醇、卫矛醇,H2S试验阳性,MR试验阳性,V-P试验阴性,靛基质试验阴性,与沙门氏菌的生化特征一致。沙门氏菌容易产生耐药性,加上临床抗生素不合理使用,一些理论上有效的药物应用后常不能达到预期效果,所以要进行细菌分离后筛选有效药物。药敏试验结果表明,该分离菌对头孢噻呋、丁胺卡那、磷霉素高度敏感,对强力霉素、恩诺沙星、环丙沙星中度敏感,对四环素、林可霉素、大观霉素、氟苯尼考、卡那霉素、庆大霉素、链霉素、阿莫西林耐药。猪场按照药敏试验结果,将病情严重猪只挑出,隔离饲养,头孢噻呋注射,全群强力霉素拌料饲喂,同时在饮水中添加2倍剂量的高质量黄芪多糖和电解质多维,或者在饲料中加入粉碎的复方中草药制剂(包括白头翁10 g、黄连10 g、苍术6 g、车前子10 g)连续饲喂7 d[8],同时加强环境消毒,沙门氏菌对多种消毒剂敏感,可选用聚维酮碘、戊二醛、石碳酸、氢氧化钠、来苏尔等[9],圈舍每天清理粪便污物,保持干燥、清洁和卫生,减少猪群饲养密度,加强通风,死亡猪只无害化焚烧或深埋处理,5 d后猪场情况好转,无死亡猪只。初步分析该猪场发病原因为该猪场为新建猪场、并未免疫仔猪副伤寒活疫苗,饲养管理经验不足,加上天气突然变化所致,及时采取措施后为猪场挽回了损失。本试验分离的沙门氏菌对小鼠有较强的致病性,下一步计划对该菌进一步分型鉴定,丰富猪场自家灭活疫苗的菌种库研制,以更好地防控猪病。
