伴非瓣膜性心房颤动急性缺血性脑卒中合并脑微出血患者发生症状性脑出血危险因素分析
2022-02-17何萧伊张艳丽王晓玲武建朝
何萧伊, 张艳丽, 王晓玲, 武建朝
1.大连大学附属中山医院 神经内科,辽宁 大连 116001;2.辽宁省人民医院 神经内科,辽宁 沈阳 110000;3.抚顺市第三医院 神经内科,辽宁 抚顺 113004
心房颤动是心律失常的常见类型,非瓣膜性心房颤动是指除外风湿性二尖瓣狭窄、瓣膜置换或修复等情况出现的心房颤动[1-2]。心房颤动会增加缺血性脑卒中发生的风险,是急性缺血性卒中(acute ischemic stroke,AIS)的独立危险因素[3]。伴心房颤动的缺血性脑卒中患者长时间口服传统抗凝药物华法林、新型口服抗凝药(new oral anticoagulant,NOACs)可获益已得到指南认可,且相较于华法林,口服NOACs患者的脑出血(intracranial hemorrhage,ICH)发生风险较低,颅内出血事件发生较少[4]。目前,口服抗凝药物已经被用于伴心房颤动的缺血性脑卒中患者,但因其对出血事件的不利影响,以及患者对更严重、甚至致死的并发症,如症状性脑出血(symptomatic intracranial hemorrhage,sICH)的恐惧,导致并非所有伴心房颤动的缺血性脑卒中患者都能接受抗凝治疗。2019年的一项前瞻性研究发现,心房颤动还会增加ICH患者住院期间死亡风险和90 d后死亡风险[5]。脑微出血(cerebral microbleeds,CMBs)通常与脑小血管损伤有关[6]。缺血性脑卒中患者CMBs的检出率为35%~71%,心房颤动患者CMBs的检出率为30.5%[7-8]。CMBs作为sICH的预测指标,而当AIS患者合并CMBs时,发生ICH的风险进一步增加[9-10]。临床上对于伴非瓣膜性心房颤动的AIS患者进行抗凝治疗时,患者同时伴有CMBs的情况并不少见,这可能会进一步增加sICH的风险。本研究以口服抗凝剂治疗的伴非瓣膜性心房颤动的AIS患者为研究对象,观察存在CMBs患者的临床特征,并对口服抗凝药90 d内发生sICH情况进行随访,探讨其口服抗凝药治疗的安全性。现报道如下。
1 对象与方法
1.1 研究对象 选取自2016年4月至2020年11月于辽宁省人民医院住院治疗的83例伴非瓣膜性心房颤动的AIS患者为研究对象,患者均行头部核磁共振常规序列及磁敏感加权成像(susceptibility weighted imaging,SWI)序列检查。CMBs诊断为SWI序列上病变直径<1.0 cm,一般为0.2~0.5 cm的类圆形、轮廓分明、均匀且低信号的被脑实质围绕的区域[11],并排除其他可能导致SWI低信号的疾病。根据SWI检查结果,将患者分为无CMBs组(n=27)与CMBs组(n=56)。纳入标准:(1)满足《中国急性缺血性脑卒中诊疗指南2014》的AIS诊断标准[12],于发病后72 h内就诊并完善头部核磁共振常规序列及SWI序列检查;(2)经心电图和(或)超声心动图诊断为非瓣膜性心房颤动[2]。排除标准:(1)发病前已应用口服抗凝剂;(2)经影像学检查明确为血管畸形、肿瘤或其他原因所致出血;(3)合并严重脏器功能衰竭、重度感染、恶性肿瘤;(4)合并血液系统疾病或其他部位出血性疾病;(5)不能完成头部核磁共振检查;(6)不能完成随访。本研究经医院伦理委员会批准,患者均签署知情同意书。
1.2 研究方法
1.2.1 抗凝药用药方法 美国国立卫生院神经功能缺损评分(National Institutes of Health stroke scale,NIHSS)评分<8分的轻度AIS患者在发病第3天开始服用抗凝药;NIHSS评分为8~15分的中度AIS患者在发病第6天经头部CT或核磁共振评估无出血转化时,开始服用抗凝药;NIHSS评分>16分的重度AIS患者在发病第12天经头部CT或MRI评估无出血转化时,开始服用抗凝药。
1.2.2 临床观察指标及随访情况 记录并比较两组患者年龄、性别、吸烟史、饮酒史、既往病史(高血压、糖尿病、卒中)、NIHSS评分、非瓣膜性心房颤动患者脑卒中危险评分(CHA2DS2-VASc)、出血风险评分(HAS-BLEDS)等临床资料。记录CMBs患者的严重程度分级、发生CMBs部位。CMBs病灶部位根据CMBs解剖评定量表(microbleed anatomical rating scale,MARS)[13]分为脑叶(皮质及皮质下,额叶、颞叶、顶叶、枕叶)、深部(基底节、丘脑、内囊、外囊、胼胝体、脑室周围白质)、幕下(小脑、脑干)及混合部位(合并脑叶和深部,脑叶和幕下或上述部位均有)。根据CMBs数量观测量表(brain observer microbleedscale,BOMBS)[14]将CMBs程度分为轻度(1~2个)、中度(3~10个)和重度(CMBs数量>10个)。根据国际血栓与止血学会心房颤动和静脉血栓栓塞的非外科手术患者出血的定义[15],记录本组患者小出血、临床相关非大出血、大出血发生情况。对患者的随访方式为电话随访或面对面随访,主要终点事件为口服抗凝药90 d内发生sICH,随访内容包括口服抗凝药物种类、抗凝药物服用时间、是否在服用抗凝药物90 d内有肢体瘫痪等局灶性神经功能缺损表现及复查头CT或核磁共振成像情况,分析CMBs患者口服抗凝剂治疗安全性。
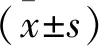
2 结果
2.1 出血发生情况 本研究出血事件发生率为16.9%(14/83)。其中,小出血10例(12.1%),包括牙龈出血、皮肤瘀斑、痰中带血、便潜血、轻微眼底出血。临床相关非大出血2例(2.4%),包括便血、严重眼底出血;大出血2例(2.4%),为脑出血。
2.2 无CMBs组与CMBs组患者临床特征比较 两组患者年龄、性别、吸烟史、饮酒史、有糖尿病病史患者比例、NIHSS评分、CHA2DS2-VASc评分、HAS-BLEDS评分及sICH发生情况比较,差异无统计学意义(P>0.05)。CMBs组有高血压病病史患者比例高于无CMBs组,差异有统计学意义(P<0.05)。见表1。
2.3 终点事件发生情况 2例患者分别于口服抗凝药物第64天和第82天发生sICH。其中,例1因出现头晕、头痛1 d后,行头部CT显示ICH,出血部位为左侧额叶,出血量约为3 ml(见图1);例2因突发肢体活动不灵行头部CT显示ICH,出血部位为左侧基底节区,出血量约为5 ml(见图2)。2例患者的出血部位均与原梗塞部位无关,但出血部位既往均存在CMBs病灶。
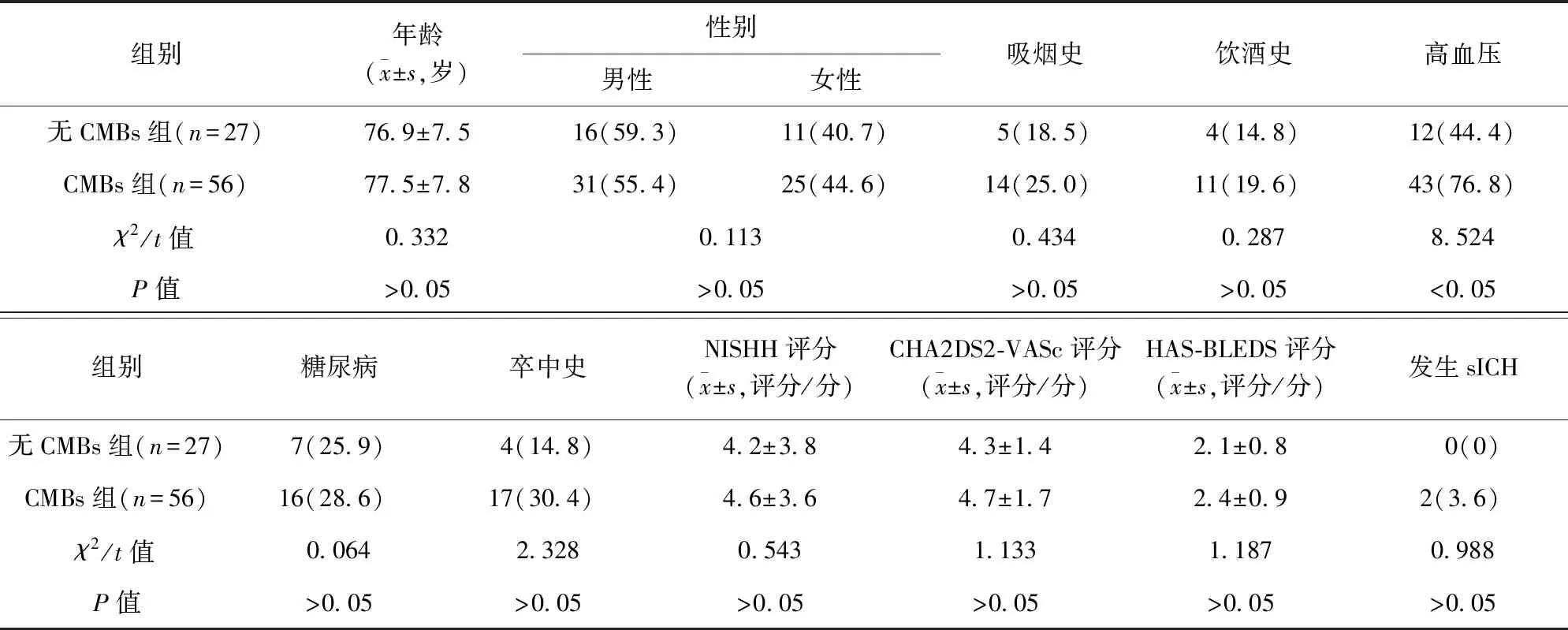
表1 无CMBs组与CMBs组患者临床特征比较/例(百分率/%)
2.4 伴非瓣膜性心房颤动的AIS合并CMBs患者发生sICH的单因素分析 单因素分析结果显示,NIHSS评分、CBMs程度可能与伴非瓣膜性心房颤动的AIS合并CMBs患者发生sICH有关(P<0.1)。见表2。
2.5 伴非瓣膜性心房颤动的AIS合并CMBs患者发生sICH的危险因素 以有无sICH发生为因变量,将单因素分析筛选出P<0.1的因素纳入自变量(NIHSS评分、CMBs程度),应用多因素逐步Logistic回归模型进行多因素分析,计算其对sICH的相对风险。多因素分析结果显示,NIHSS评分是发生sICH的独立危险因素(OR=0.448,95%可信区间0.150~1.344,P=0.032)。

图1 例1影像学检查(a.口服抗凝药物前头部SWI;b.口服抗凝药物第64天头部CT) 图2 例2影像学检查(a.口服抗凝药物前头部SWI;b.口服抗凝药物第82天头部CT)

表2 伴非瓣膜性心房颤动的AIS合并CMBs患者发生sICH的单因素分析/例(百分率/%)
3 讨论
既往研究表明,心房颤动相关的脑梗死(ischemic stroke,IS)患者中,CMBs的检出率为30.5%,发生CMBs可能因心房颤动使栓子更易脱落,进而引发CMBs[8,16]。本研究中,发生CMBs的患者占比高达67.5%(56/83),明显高于既往文献报道的发生率[8]。其可能原因如下:(1)纳入患者年龄较高;(2)本研究纳入患者除口服抗凝药外,还存在其他CMBs的危险因素。多种病因或危险因素可导致CMBs发生,其中,高血压是较常见的危险因素[8]。本研究发现,CMBs组有高血压病史患者比例明显高于无CMBs组(P<0.05)。高血压引发CMBs的可能机制是血压升高(特别是高收缩压)导致血管内皮细胞受到不利影响,从而使颅内小血管发生玻璃样变性和纤维化,血管平滑肌细胞和弹力纤维减少,进而使微小血管硬化、破裂出血致CMBs形成[6]。
高龄、高血压病、淀粉样脑血管病(cerebral amyloid angiopathy,CAA)、合并CMBs、既往脑血管病、CYP450基因多态性、抗血小板治疗及抗凝药物剂量大等危险因素均与抗凝药物相关出血性卒中相关[17]。有研究显示,有CMBs的心房颤动患者抗凝治疗后,出现sICH的风险较无CMBs的患者明显升高,且心房颤动还会增加sICH患者的住院期间死亡风险和90 d后死亡风险[5]。2010年的一项前瞻性研究报道,抗栓治疗的卒中患者中,合并CMBs患者发生sICH风险是无CMBs患者的12.1倍,且增高sICH风险与抗栓治疗有关[14]。2016年的一项Meta分析结果显示,在接受抗栓治疗的IS患者中,合并CMBs的患者发生IS、sICH风险均较无CMBs患者增高[17]。2016年的一项研究报道,在合并0~4个CMBs的患者中,sICH发生风险低于IS发生风险,但在合并≥5个CMBs患者中,sICH发生风险高于IS发生风险[18]。本研究中,伴心房颤动的AIS患者口服抗凝剂时,发生sICH患者均为合并重度CMBs(CMBs数量>10个)者,但多因素分析显示,CMBs程度不是sICH的独立危险因素,其原因可能是本研究为单中心回顾性研究,且样本量较小,结果存在偏倚,仍需更大样本的前瞻性研究进一步探讨。但结合其他研究结果,对于此类患者,临床上在给予抗凝治疗前可考虑行SWI检查来筛查重度CMBs患者,可能有助于评估抗凝出血风险。此外,本研究结果显示,NIHSS评分是伴非瓣膜性心房颤动的AIS合并CMBs患者发生 sICH的独立危险因素。分析其原因,较高的NIHSS评分说明患者病情较重,血-脑屏障的损伤更大,合并的危险因素可能更多,更易在口服抗凝剂后出现sICH。
综上所述,伴非瓣膜性心房颤动的AIS患者有较高的CMBs的发生率,高血压病史与CMBs的发生相关。对于伴非瓣膜性心房颤动的AIS合并CMBs患者,NIHSS评分与sICH的发生独立相关。
