外周血NLR表达水平在乳腺癌辅助诊断中的应用
2022-02-16郭岷白永颖张靖华
郭岷,白永颖,张靖华
浙江大学医学院附属妇产科医院检验科,浙江杭州 310006
2020年全球发病率超过226万,占全球癌症病例总数的11.7%,造成了超过680 000例死亡数量[1-2]。在我国,乳腺癌也是女性恶性肿瘤中发生率最高的癌症,对女性患者的生活质量与生命安全造成了较大威胁[3]。尽管进行了数十年的实验室、流行病学和临床研究,乳腺癌的发病率仍继续上升[4]。目前CA153作为乳腺癌较为特异的血清标志物,其与乳腺癌分期、肿瘤大小、腋窝淋巴结阳性有关,但CA153的敏感性却不足7%[5]。近年来,越来越多的研究表明炎症在癌症的发生和发展中起关键作用。外周血中性粒细胞与淋巴细胞比率(NLR)是全身炎症的指标,可以灵敏地反映机体的炎症状态,现已被认为是癌症的不良预后指标[6-7],但是与乳腺癌患者临床、病理参数的关系及其在乳腺癌中诊断效能的研究相对较少。故本研究选取2020年8月—2021年8月浙江大学医学院附属妇产科医院收治的278例乳腺癌患者为研究对象,同期选取278名健康体检者为正常组,通过分析NLR在乳腺癌患者外周血中的表达水平,并探讨其在乳腺癌中的临床价值,现报道如下。
1 资料与方法
1.1 一般资料
回顾性选取本院收治并治疗的乳腺癌患者278例为乳腺癌组,按照性别年龄一一匹配原则,另选取健康体检者278名为正常组。乳腺癌组:年龄20~82岁,平均(50.79±11.03)岁。正常组:年龄20~82岁,平均(50.79±11.03)岁。两组一般资料对比,差异无统计学意义(P>0.05),具有可比性。
1.2 纳入与排除标准
纳入标准:乳腺癌组经术后病理证实为乳腺癌;年龄在18周岁以上。
排除标准:乳腺癌组术前采取针对乳腺癌进行治疗措施者;合并有肿瘤、自身免疫性疾病、传染性疾病或其他重大疾病者;妊娠期、哺乳期女性。
1.3 方法
乳腺癌组、正常组均在清晨空腹状态下抽取外周静脉血置于真空采血管中。NLR检测仪器为日本希森美康公司XN9000血液分析仪,CA153检测仪器为瑞士罗氏公司Cobase801分析系统。CA153以24 U/mL为临界值,超过临界值判定为阳性结果。
1.4 观察指标
统计分析了两组中性粒细胞与淋巴细胞比率(neutrophil-to-lymphocyte ratio NLR)水平,分析NLR与乳腺癌患者不同临床资料的比较及其在乳腺癌中的诊断效能。
1.5 统计方法
采用SPSS 9.0统计学软件处理数据,非正态分布计量资料以中位数(四分位数间距)描述,两组间比较用Wilcoxon秩和检验。采用Graphpad Prism软件绘制ROC曲线并用于评价乳腺癌的诊断效能并计算曲线下面积(area under the cure, AUC)。最佳的诊断效率根据约登指数得出。P<0.05为差异有统计学意义。
2 结果
2.1 乳腺癌组和正常组NLR水平比较
乳腺癌组NLR水平1.86(1.44,2.37)高于正常组1.63(1.25,2.09),差异有统计学意义(Z=-4.023,P<0.05)。见图1。
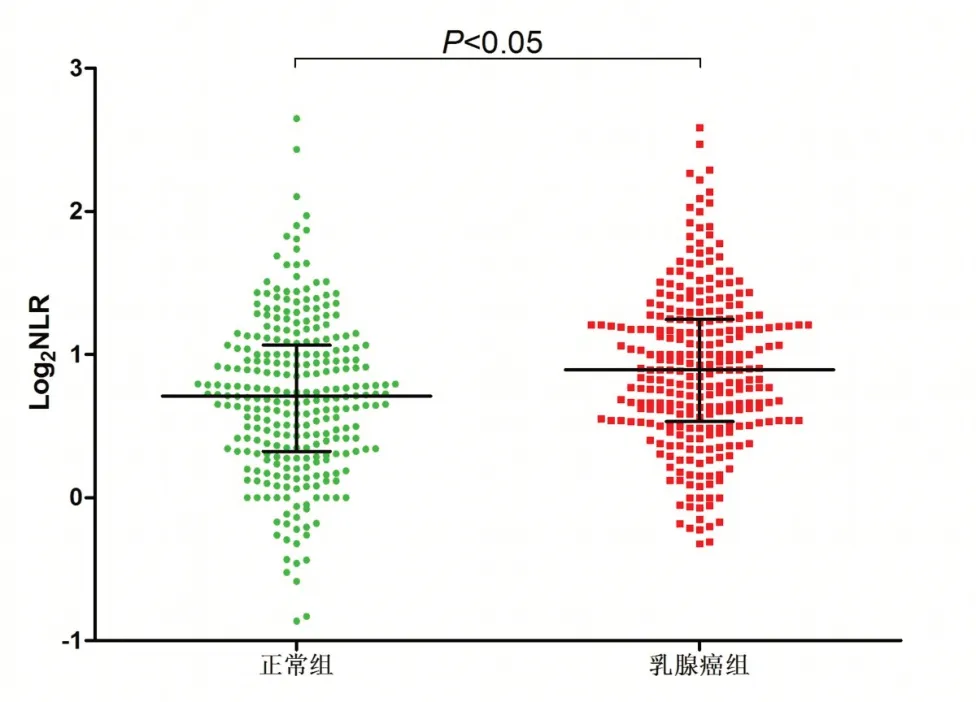
图1 乳腺癌组和正常组NLR水平比较
2.2 NLR与乳腺癌患者不同临床资料比较
NLR与乳腺癌患者的年龄、是否绝经、病理类型、肿瘤大小及淋巴结转移相关。其中,年龄≥50岁患者的NLR水平显著高于年龄<50岁患者,未绝经患者的NLR水平显著高于已绝经患者;在病理资料方面,侵袭性乳腺癌的NLR水平高于非侵袭性乳腺癌患者,肿瘤>2 cm患者NLR水平高于肿瘤≤2 cm患者水平,淋巴结转移患者NLR水平高于非转移患者,差异有统计学意义(P<0.05),见表1。

表1 NLR与乳腺癌患者不同临床资料的比较 [M(P25,P75)]
2.3 NLR诊断乳腺癌的效能评价
以正常组为参照,通过绘制ROC曲线来判断NLR的诊断价值大小。结果显示,NLR诊断乳腺癌的曲线下面积达到了0.599,见图2。当截断值根据约登指数设为1.742时,乳腺癌组共有152例患者高于此截断值,正常组仅有111例,其敏感性为54.68%,特异性为60.07%。
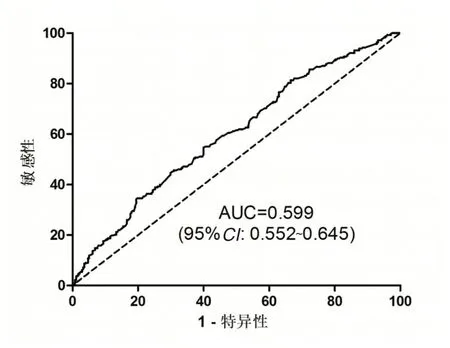
图2 NLR诊断乳腺癌的ROC曲线
3 讨论
在1863年,Virchow观察到肿瘤组织内存在炎症细胞,这首次说明了肿瘤与炎症的内在联系[8]。然而,只有在近十年中,才获得明确的证据表明炎症在肿瘤发生中起关键作用。炎症是机体对组织损伤的反应,该反应可引起损伤组织中细胞变化和免疫反应,从而导致受损组织中细胞增殖。若身体炎症持续存在甚至转为慢性时,则极易引起细胞突变和增殖,并朝向一个有利于癌症发生的方向发展[9]。目前越来越多的研究表明炎症与肿瘤发生的各个阶段有关,如细胞增殖、侵袭、血管生成、转移等[10]。中性粒细胞是众所周知的免疫细胞,具有致瘤特性,包括在转移过程中增强细胞增殖、血管生成和侵袭性。另一方面,外周和浸润性肿瘤淋巴细胞具有强大的抑制肿瘤活性作用。而且,NLR作为一种外周血炎性标志物,因此探讨NLR在乳腺癌中的临床价值具有较大的临床实用意义。
目前已有较多文献报道了NLR与乳腺癌的密切关系,Koh CH等[11]的研究结果显示乳腺癌患者NLR 水平显著高于健康女性;Ozyalvacli G等[12]研究成果表明术前高水平NLR有助于区分乳腺癌和乳腺良性病变;Ethier JL等[7]揭示了高水平NLR是乳腺癌患者预后的独立危险因素。本研究结果显示,乳腺癌组外周血的NLR水平1.86(1.44,2.37)高于正常组 1.63(1.25,2.09)(P<0.05),与国内学者的研究结果较为一致,均表现为乳腺癌患者外周血的NLR水平显著高于健康对照组,然而仅在具体数值上略有不同,说明NLR确实在乳腺癌的发生、发展中发挥重要作用,这可能是由于炎症作为乳腺癌的诱发因素,随着机体与乳腺癌之间逐步失衡,NLR逐渐升高并偏离正常范围,然而对于其中的具体机制仍有待于研究[13]。此外,由于乳腺癌患者的病理类型、年龄、是否绝经等因素均可能影响NLR水平,因此确定乳腺癌的最佳诊断临界值对乳腺癌的诊断至关重要。本研究ROC曲线分析显示,NLR的ROC曲线下面积为0.599,展现了一定的诊断性能,与刘丛芳等[14]的研究结果相近(AUC=0.573),且低于张慧等[15]的研究结果(AUC=0.72),说明不同地域之间的数值存在一定差异,但均表现出了一定的诊断价值。当本研究截断值设为1.742时,NLR的敏感性为54.68%,而乳腺癌患者中CA153超过临界值数量仅为12例,敏感性仅为4.32%。上述结果说明NLR对于临床上常用的肿瘤标志物CA153在诊断乳腺癌时可以起到补充作用,进而达到早发现早治疗的目的。
诸多研究已经证明了高中性粒细胞计数是癌症复发和存活的独立预后标志物,包括胃癌、转移性肾细胞癌、转移性黑色素瘤和晚期非小细胞肺癌[16],而中性粒细胞与淋巴细胞比率有易于测量、可重复且廉价等优点的临床炎性标志物,并且在包括乳腺癌在内的各种癌症类型中具有预后作用。本研究通过对NLR与乳腺癌临床病理特征发现,NLR与乳腺癌肿瘤大小、病理类型、是否淋巴结转移有关,可能原因为NLR升高即中性粒细胞相对增加,而中性粒细胞可与循环肿瘤细胞结合刺激肿瘤生长进展、侵袭和淋巴结转移[17]。
综上所述,外周血NLR水平在乳腺癌患者中表达升高,在乳腺癌中具有一定的诊断效能,且NLR与乳腺癌患者的年龄、是否绝经、病理类型、肿瘤大小及淋巴结转移相关,可以作为临床预后的检测指标。另外,由于这种生物标志物直接来自血常规参数计算,具有检测方便,费用低廉等优势。然而本研究是小规模的回顾性研究,因此结论仍需大规模的多中心临床研究进一步验证。
