小剂量5-脱氧杂氮胞苷诱导HepG2 肝癌细胞新生肿瘤-睾丸抗原CT10 和SSX1 表达及其意义
2022-02-16赵慧霞曾志艳李庆艳李秋文肖文华
张 鹤 赵慧霞 曾志艳 李庆艳 云 超 关 娜 李秋文 肖文华
解放军总医院第四医学中心肿瘤内科,北京 100048
肝细胞肝癌是我国常见恶性肿瘤,严重威胁人们的健康和生命。当前抗血管生成联合免疫检查点抑制剂(immune-check point inhibitor,ICI)的治疗使晚期肝癌患者的平均生存时间超过1 年[1],但仍有提升的空间。ICI 的治疗目的主要是释放细胞毒性T 淋巴细胞(cytotoxic T cell,CTL)的杀瘤能力;产生CTL 必须具有的特异性肿瘤抗原,尤其是肿瘤新抗原(tumour neoantigen,TNA)[2]。当前TNA 定义是肿瘤基因编码区非同义突变产生的新的癌蛋白[2];然而,该定义并不全面,忽略了另一大类受表观遗传调控的、与TNA 同样具有肿瘤特异性和强大免疫原性的新抗原肿瘤-睾丸抗原(cancer-testis antigen,CTA)。CTAs 是一大类只在睾丸和肿瘤中表达的免疫原性较强的肿瘤相对特异抗原,因高甲基化而沉默。由于肿瘤的广泛低甲基化,导致位于X 染色体的CTAs 基因不同程度去甲基化,部分沉默的CTAs 重新开放表达并诱导免疫反应[3]。但是,由于CTAs 表达水平受其去甲基化程度的影响,同一肿瘤不同个体,甚至同一肿瘤不同亚克隆瘤细胞的CTAs 表达存在明显的异质性。长期的低浓度CTAs 慢性刺激将导致CTL 失能或衰竭,或CTAs 被再甲基化而再次沉默从而影响免疫治疗效果或产生继发性耐药[3-4]。因此,新生CTAs(novel cancer-testis antigens,nCTAs)的产生是提高免疫治疗或逆转免疫耐药的重要措施之一。5-脱氧杂氮胞苷(5-aza-2’-deoxycytidine,5-aza-CdR)是DNA 甲基转移酶抑制剂,能使CTAs去甲基化并重新和持续表达[5],但由于该药存在细胞毒性,限制了临床广泛应用。本文目的是探讨小剂量的5-aza-CdR 能否诱导肝癌细胞表达nCTAs,为未来制订肝癌的免疫治疗及免疫耐药的再挑战提供对策。
1 材料与方法
1.1 肝癌细胞株和主要试剂
肝癌细胞株HepG2、SMMC-7721 和BEL-7402 购自中国细胞收藏中心,MHCC97L 和MHCC97M3 购自复旦大学中山医院肝癌研究所;胎牛血清(北京中科康源生物科技公司,货号:#13011-611);兔抗人CT10抗体(英国Abcam 公司,货号ab209667);鼠抗人-tubulin 抗体和羊抗兔二抗(美国Sigma 公司,货号分别为#T9026 和#12-349);5-aza-CdR(美国Sigma 公司,货号:#2353-33-5);Trizol RNA 提取试剂盒(美国Qiagen 公司,货号:#97306);Oligo(dT)、RT-PCR 试剂盒、Moloney 小鼠白血病病毒反转录酶(美国Promega 公司,货号分别为:#M1701 和#A1260);DNA Marker、Taq 酶(德国Qiagen 公司,货号分别为#929560和#201203);蛋白浓度Bio-Rad 测定试剂盒(美国Bio-Rad 公司,货号:#5000002EDU)。
1.2 细胞培养
人肝癌细胞株HepG2、SMMC-7721、BEL-7402,MHCC97L 和MHCC97M3 在含10%胎牛血清和各100 U/ml 的青、链霉素的高糖DMEM 培养基中,于37℃、5%CO2饱和湿度培养箱中培养、胰酶消化传代,取对数生长期的细胞进行后续实验。
1.3 药物处理
将处于对数生长期的肝癌细胞株HepG2 按每组接种1×104个细胞于培养瓶中继续培养,每组重复3 次,24 h 后换新鲜配制的分别含5-aza-CdR 0、0.5、1.0、1.5 μmol/L 的培养液于四组培养瓶中培养3 d,每24 h 更换培养液,0 mmol/L 处理的细胞作为对照组,0.5 μmol/L 为实验1 组,1.0 μmol/L 为实验2 组,1.5 μmol/L为实验3 组。5-aza-CdR 药物浓度的选择是参照以前的实验研究和文献[5]而选定的。
1.4 RT-PCR 技术检测CTAs mRNA 表达
用Trizol 试剂(Gibco BRL)提取总RNA;参照试剂盒说明书用oligo-dT 引物和Moloney 小鼠白血病病毒逆转录酶逆转录为cDNA,RT 反应体系包括总RNA 2 μg,oligo-dT 0.5 μg,10×缓冲液2 μl,dNTP 1 mmol/L,RNasin 20 U,Moloney 小鼠白血病病毒逆转录酶200 U,去离子水,总反应体积20 μl;然后采用PCR 扩增cDNA,所用PCR 扩增仪为Smart Cycler(Biotech,Beijing);PCR 反应体系总体积30 μl,其中含去离子水22.5 μl,10×缓冲液3 μl,上下引物各1 μl(500 pmol/L),dNTP 1 μl(200 μmol/L),Taq 酶0.5 μl(1 U),相应cDNA 1 μl;扩增参数为:先95℃变性5 min,然后95℃20 s,退火45 s(退火温度见表1),72℃延伸30 s,共循环36 次,最后72℃孵育10 min;将PCR产物在1.5%琼脂糖凝胶中电泳分离,EB 染色、照相。所用引物见表1。

表1 PCR 扩增各种CTAs 引物序列
1.5 Western blot 检测HepG2 细胞CT10 蛋白表达
由于SSX 抗原有9 个成员,其氨基酸序列同源性高达87%~96%,到目前为止尚无针对任一SSX 成员的特异性抗体,不能进行单个SSX 的蛋白印迹。收集培养处于对数生长期的HepG2 肝癌细胞于含蛋白酶抑制剂的缓冲液中裂解,蛋白浓度采用Bio-Rad 测定试剂盒测定。取50 μg 蛋白于10%SDS-聚丙烯酰胺凝胶中电泳分离过夜,并将凝胶中分离的蛋白转印至聚偏氟乙烯复合分离膜(美国Bio-Rad,货号:1620177),在4℃下,用5%去脂乳液封闭非特异成分,用封闭液稀释一抗CT10,稀释度为1∶100,在Tris-缓冲液中与抗CT10 抗体进行杂交过夜,洗膜,加入辣根过氧化物酶标记的羊抗兔二抗(稀释度为1∶2 500)室温孵育1 h,洗膜、ECL 法发光、X 线曝光、照相。采用SSX1 和CT10 表达量与内参照β-actin 表达量的灰度比值作为两种CTAs 的相对表达量。
1.6 统计学方法
采用SPSS 22.0 统计学软件进行分析,计量资料采用均数±标准差()表示,组间比较采用单因素方差分析。并采用SNK-q 法进行均数多重比较。以P<0.05 为差异有统计学意义。
2 结果
2.1 肝癌细胞株CTAs 的差异表达
在SMMC-7721、BEL-7402、MHCC97L、MHCC97M3和HepG2 肝癌细胞株中,MAGE1、MAGE3、CT10、CTp11、NY-ESO-1 和SSX1 存在差异表达,其中HepG2 表达MAGE1、MAGE3、CTp11 和NY-NSO-1,MHCC97L 和MHCC97M3表达MAGE1、MAGE3、CT10、CTp11和SSX1,BEL-7402 表达MAGE1、MAGE3 和CTp11,而SMMC-7721 只表达MAGE1、MAGE3,见图1。在HepG2 肝癌细胞株中,MAGE1、MAGE3、CTp11 和NY-ESO-1 表达,但CT10 和SSX1 不表达;选择HepG2 肝癌细胞株作为下一步研究的细胞模型。
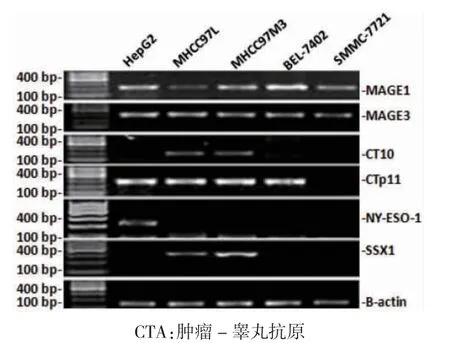
图1 5 株肝癌细胞CTAs 的差异表达(n=3)
2.2 5-aza-CdR 可诱导新的CT10 和SSX1 的表达
2.2.1 小剂量5-aza-CdR 诱导新抗原CT10 和SSX1 mRNA 表达RT-PCR 检测发现对照组无新生CTA SSX1 和CT10 表达,实验1、2 和3 组均可诱导HepG2 细胞SSX1 和CT10 新生抗原不同程度表达。在SSX1 表达上,实验3 组mRNA 表达高于实验1、2 组,差异有统计学意义(P<0.05);实验2 组表达高于实验1 组,差异有统计学意义(P<0.05)。在CT10 表达上,实验3 组表达高于实验1 组和2 组,差异有统计学意义(P<0.05);实验1 组和2 组比较,差异无统计学意义(P>0.05)。见图2。
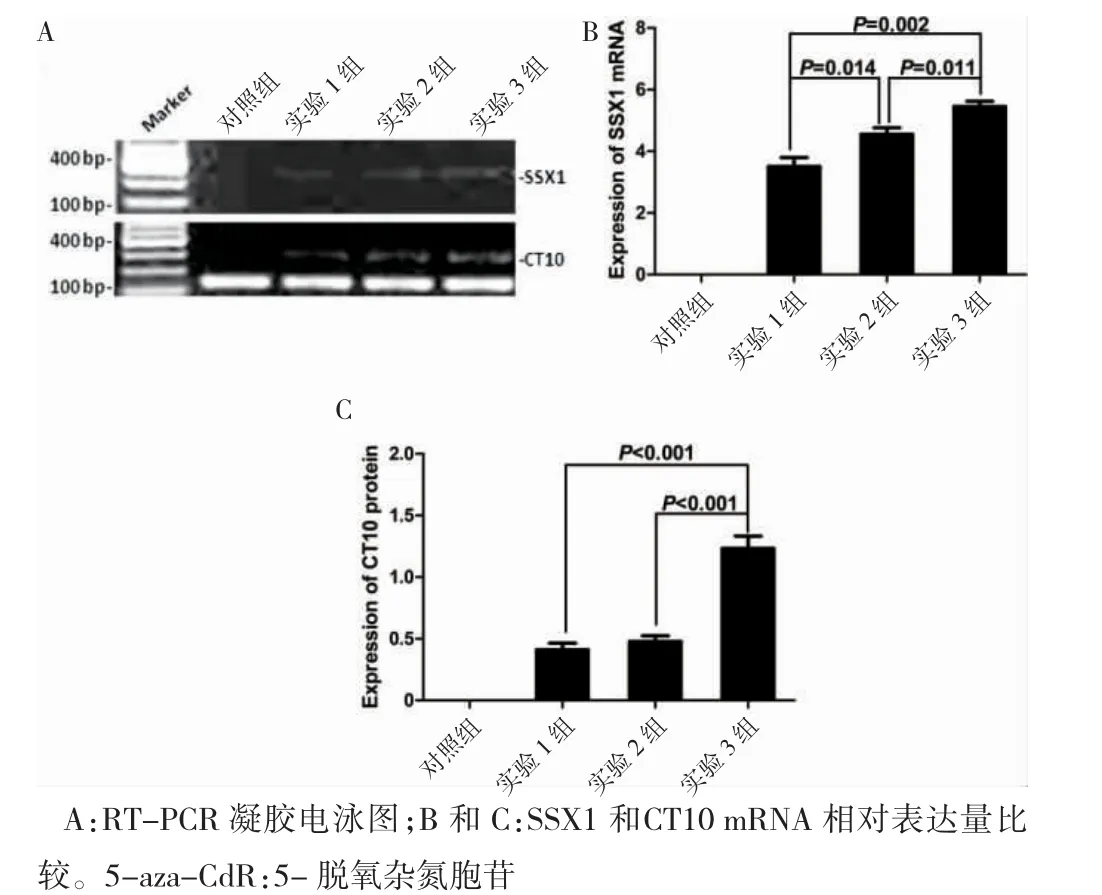
图2 不同浓度5-aza-CdR 诱导HepG2 肝癌细胞株新生SSX1和CT10 mRNA 表达(n=3)
2.2.2 小剂量5-aza-CdR 诱导新抗原CT10 蛋白的表达Western blot 显示对照组无CT10 蛋白表达,实验1、2 和3 组均可诱导CT10 蛋白表达,实验3 组相对表达量最高,与实验1 组和2 组比较,差异有统计学意义(P<0.05);实验1 组和2 组相对表达量比较,差异无统计学意义(P>0.05)。见图3。

图3 不同浓度5-aza-CdR 诱导HepG2 肝癌细胞株新生CT10 蛋白表达水平比较(n=3)
3 讨论
狭义的NTA 一般被认为是肿瘤癌基因编码区发生导致氨基酸发生改变的非同义突变,这些癌蛋白具有较强的免疫原性,容易被机体识别为外来抗原并产生特异的CTL,NTA 是ICI 治疗效果的另一重要的指标[6]。总之,NTA 需具备两个基本条件:①机体免疫系统从未接触过只在癌细胞中表达的癌蛋白,即抗原表达的肿瘤特异性;②癌蛋白具有较强的免疫原性,即该抗原能刺激机体产生CTL 细胞。那么CTAs 蛋白是机体成熟免疫系统从来未接触的肿瘤相对特异、只在肿瘤和睾丸生殖细胞中表达,后者由于缺乏MHC Ⅰ分子,不能激发起相关免疫反应,即CTAs 的肿瘤特异性;同时,CTAs 具有较强的免疫原性,能诱导机体产生强大的免疫反应,在既往肿瘤疫苗、CTL 和CAR-T制备及联合免疫治疗中都显示出强大的抗肿瘤作用[7],符合肿瘤新生抗原的两大基本特点。因此,认为CTAs 尽管没有发生基因突变和蛋白质氨基酸改变,而是通过表观遗传修饰的变化产生的新抗原,本研究首次提出nCTAs 是广义的肿瘤新生抗原。ICI 阻断PD-1/PD-L1 免疫负性调节,解除其对已经存在肿瘤微环境中的CTL 的禁锢,释放其杀伤肿瘤细胞的能力,是目前逆转免疫耐药的重要手段[8],但对严重T 细胞功能衰竭和CTL 数量衰减的免疫功能恢复较困难[9],亟须更多新生的肿瘤抗原丰富T 细胞受体多样性,刺激产生更多的、新的CTL 克隆来对付抗原已经变异的肿瘤细胞,是恢复抗肿瘤免疫反应的关键因素之一。
除了因肿瘤基因突变产生的新抗原外,以5-aza-CdR 为代表的表观遗传药物可以催生肿瘤细胞新生CTAs 表达,即新出现的具有强免疫原性nCTAs,可以诱导产生新的CTL 克隆。5-aza-CdR 为DNA 甲基转移酶抑制剂,除抑制其酶活性外,还可降低其转录水平[10],使CTAs 基因5’端启动子CpG 岛去甲基化而促进基因的表达[7,11]。除此之外,体外较大剂量5-aza-CdR可诱导DNA 的快速损伤和严重的细胞毒性,甚至使正常细胞发生基因表达异常[12];因此,目前的5-aza-CdR 表观遗传治疗肿瘤目的是把因高甲基化失活的抑癌基因或CTAs 甲基化水平降低到能再次表达,尽量减少5-aza-CdR 剂量而去除因较高剂量所致的细胞毒性,即非细胞毒性的表观遗传治疗[13-14]。Karahoca 等[15]总结了5-aza-CdR 在体内外使用的剂量和时间,发现不同肿瘤类型来源的细胞株对5-aza-CdR的敏感性不一样,其敏感性除了与药物浓度有关外,还与药物作用时间长短相关;即使同为结肠癌来源的细胞株之间对5-aza-CdR 的敏感性也不一样[15]。Tsai等[13]发现100 nM 5-aza-CdR 短暂处理癌细胞,就可以使乳腺癌细胞株、肺癌细胞株和结肠癌细胞株基因组广泛低甲基化,受高甲基化失活的抑癌相关基因去甲基化并重新表达、癌细胞生长受阻、凋亡增加,相关重要的细胞生长信号通路受到抑制;在肝癌细胞株的研究中,绝大多数5-aza-CdR 的浓度均在1~100 μmol/L之间[16-18]。在前期基础研究中,还发现小剂量5-aza-CdR 只诱导肿瘤细胞CTAs 表达,而不诱导正常上皮细胞CTAs 的表达,其机制可能与癌变的细胞CTAs本身存在不同程度的低甲基化状态,小剂量的5-aza-CdR 就可使CTAs 能表达的去甲基化程度[19];在一项5-aza-CdR 治疗肝转移性肿瘤的Ⅰ期临床研究中发现:肝动脉灌注5-aza-CdR 可使30 个CTAs 中的21 个表达上调[20];此外,5-aza-CdR 已经批准用于骨髓异常增生综合征的适应证,临床发现常规剂量5-aza-CdR常常导致严重的骨髓抑制。因此,探索小剂量和超小剂量5-aza-CdR 有实际临床意义[21-22]。本研究采用了5 株肝癌细胞株,采用RT-PCR 技术分析了MAGE1、MAGE3、CTp11、CT10、NY-ESO-1 和SSX1 等6 种CTAs抗原的mRNA 表达,发现5 株肝癌细胞表达不同的CTAs,呈现明显的异质性,提示针对CTAs 的特异免疫治疗需先确定肿瘤CTAs 的表达谱,然后筛选出不表达CT10 和SSX1 的肝癌细胞株HepG2 作为本实验的细胞模型,并分别采用3 种低剂量的5-aza-CdR处理HepG2 细胞,结果发现0.5 μmol/L 低浓度的5-aza-CdR 就可以诱导本身不表达CT10 和SSX1 的HepG2 肝癌细胞表达,并且呈剂量依赖性,提示CT10和SSX1 为HepG2 肝癌细胞株的新生抗原;同时小剂量的5-aza-CdR 也减少了药物的细胞毒性,增加了药物的依从性和联合其他药物的机会;理论上推测这种具有较强的免疫原性的nCTAs 更能刺激机体免疫系统产生新的CTL 克隆;在联合ICI、过继免疫和其他改善免疫微环境的治疗情况下,大幅度提高免疫治疗效果,对免疫耐药的复发和难治性肿瘤的解救治疗也发挥了重要的作用[23-25]。本研究在当前恶性肿瘤免疫治疗时代,率先提出了小剂量的5-aza-CdR 通过表观遗传机制诱导nCTAs,丰富了TNA 的理论,为表观遗传药物联合ICI 免疫治疗恶性肿瘤提供了实验依据。
