CT 评分及血清学指标联合预测颅脑损伤早期临床转归的价值
2022-02-16岳盛魁刘浩波潘东红
岳盛魁 刘浩波 潘东红 方 伟 夏 天
1.江苏省无锡市第九人民医院神经外科,江苏无锡 214000;2.山西省阳煤集团总医院神经外科,山西阳泉 045000
颅脑损伤是临床常见的神经外科疾病,并且颅脑损伤具有较高的概率合并多发伤,此类患者的病情通常涉及多个部位,常导致病情复杂,病情进展加速,增加了治疗的难度,易导致患者死亡或伤残[1-2]。颅脑损伤患者即使存活,绝大部分也会遗留不同程度的感觉障碍、失语、瘫痪等[3]。近些年针对颅脑损伤的开颅手术逐渐普及,但部分患者术后的转归仍不理想,许多患者依旧存在自主生活能力受限、意识障碍等,因此有关颅脑损伤术后早期转归的评估逐渐成为临床重点研究课题之一[4-5]。本研究结合实验室血清学指标、CT 评分及患者基本情况,旨在为颅脑损伤早期临床转归评估提供依据。
1 资料与方法
1.1 一般资料
选择2019 年1 月至2021 年12 月山西省阳煤集团总医院收治的112 例及江苏无锡第九人民医院收治的6 例颅脑损伤患者作为研究对象。患者年龄36~68 岁,平均(54.72±12.36)岁;男61 例,女57 例;体重指数(body mass index,BMI)18~26 kg/m2,平均(23.09±2.33)kg/m2;颅脑损伤类型:局限性脑挫裂伤36 例,硬膜外血肿46 例,脑挫裂伤合并硬膜下血肿或脑内血肿36 例;出血量34~56 ml,平均(43.81±4.25)ml。患者均行开颅手术治疗,根据术后3 个月的格拉斯哥预后量表扩展版(Glasgow outcome scaleextended,GOS-E)[6]评分将其分为预后良好组(76 例)和预后不良组(42 例)。GOS-E 分为5 个评分等级:1 分为死亡,2 分为植物生存仅有最小反应,3 分为中重度残疾但清醒,4 分为轻度残疾并可独立生活,5 分为虽有轻度缺陷但恢复良好可正常生活,1~4 分为预后不良,5 分为预后良好。本研究已获医院伦理委员会批准(2022-03)。
1.2 纳入标准
①入院格拉斯哥昏迷量表(Glasgowcomascale,GCS)评分≤12 分,并且昏迷时间>6 h;②有头部外伤史,经头颅CT 确诊为颅脑损伤;③具有开颅手术适应证;④发病至入院时间≤24 h;⑤临床资料完整,且术后至少完成3 个月的随访。
1.3 排除标准
①合并出血性疾病或严重贫血;②合并四肢多发骨折、脾脏或肝脏破裂;③合并免疫系统、神经系统疾病;④合并明确诊断的恶性肿瘤。
1.4 研究方法
收集所有患者临床资料,包括年龄、性别、文化程度、BMI、颅脑损伤原因、并发症、入院GCS 评分、颅脑损伤类型、出血量。CT 评分[7]:术前行头颅CT 检查,记录CT 评分,共包含三脑室变化评分(2 分)、侧脑室变化评分(3 分)、中线移位评分(4 分)及环池、脚间池、四叠体池评分(各2 分),总分15 分,具体评分如下。①三脑室变化评分,消失记2 分,缩小记1 分,正常记0 分;②侧脑室变化评分,双侧完全或基本消失记3 分,双侧变形或大部分消失记2 分,单侧变形或大部分消失记1 分,正常记0 分;③中线移位评分,以大脑镰和透明隔为标志,对其与颅骨内板前后极连线的距离进行测量,移位>1.5 cm 记4 分、移位>1.0~1.5 cm 记3 分、移位>0.5~1.0 cm 记2 分,移位≤0.5 cm 记1 分,正常记0 分;④环池、脚间池、四叠体池评分:完全消失记2 分、模糊或变小记1 分、正常记0 分。血清学指标检测:采用酶联免疫吸附试验检测血清白细胞介素(interleukin,IL)-1β、IL-6、S100 钙结合蛋白B(S100 calcium-binding protein B,S100B)水平。
1.5 统计学方法
采用SPSS 22.0 对所得数据进行统计学分析。计量资料采用均数±标准差()表示,比较采用t 检验。计数资料采用例数和百分率表示,比较采用χ2检验;等级资料比较采用秩和检验。采用logistic 回归模型分析影响因素,受试者操作特征曲线分析预测价值。以P <0.05 为差异有统计学意义。
2 结果
2.1 两组基础资料、CT 评分及血清学指标比较
预后不良组入院GCS 评分3~8 分占比、CT 评分及血清IL-1β、IL-6、S100B 水平均高于预后良好组,差异有统计学意义(P<0.05)。见表1。
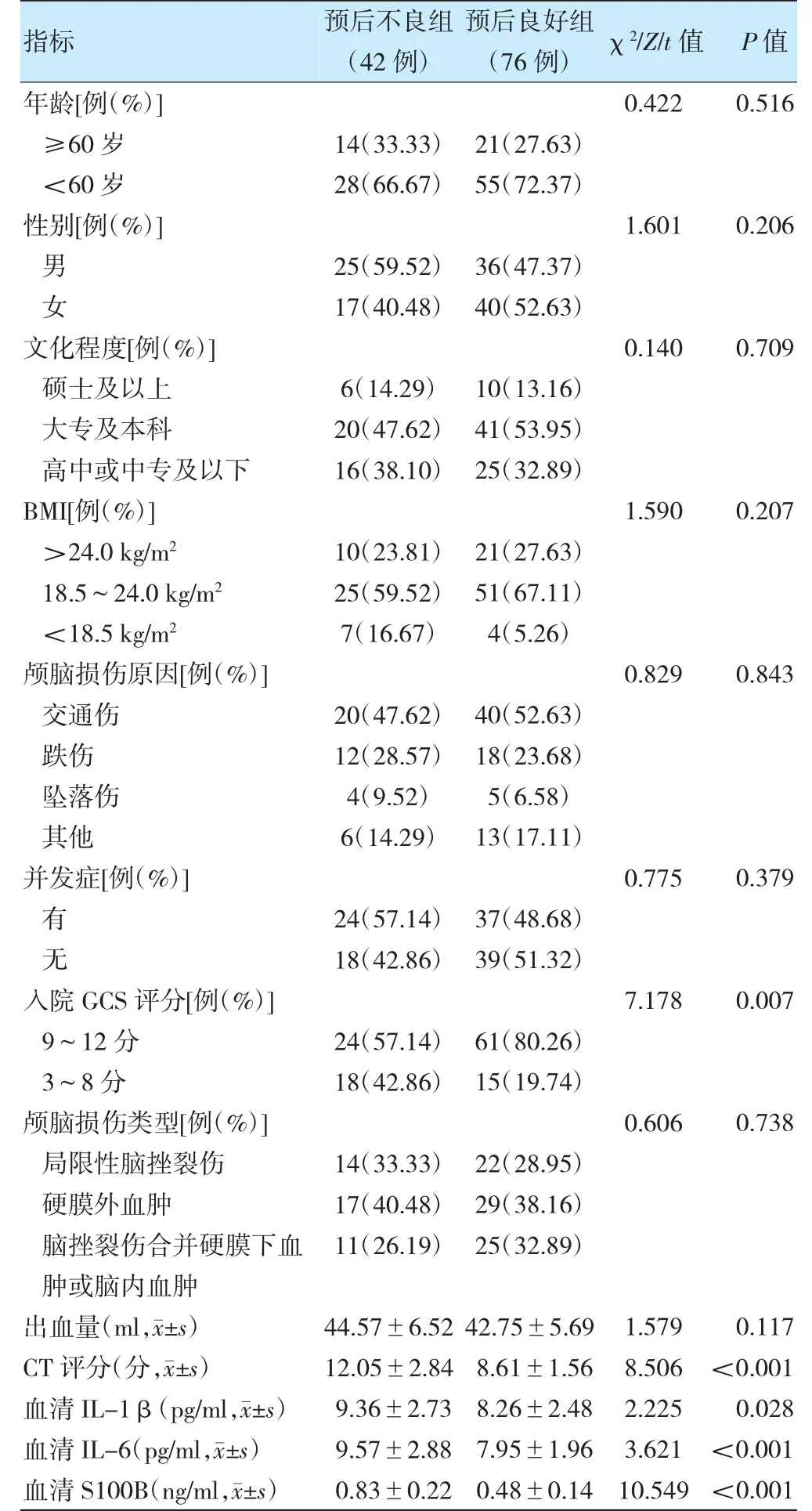
表1 两组基础资料、CT 评分及血清学指标比较
2.2 颅脑损伤患者早期预后不良的影响因素分析
以颅脑损伤患者早期预后(预后不良=1,预后良好=0)为因变量,GCS 评分(3~8 分=1,9~12 分=0)、CT 评分及血清IL-1β、IL-6、S100B 水平为自变量,进行多因素分析。结果显示,GCS 评分、CT 评分及血清IL-1β、IL-6、S100B 水平均为颅脑损伤患者早期预后不良的影响因素(P<0.05)。见表2。
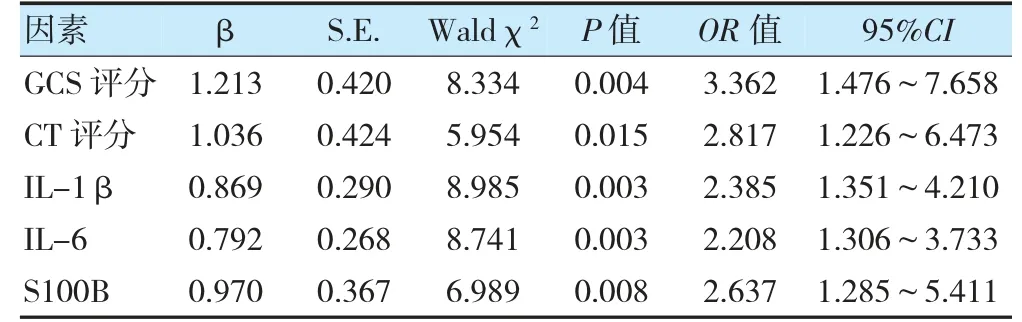
表2 颅脑损伤患者早期预后不良的影响因素分析
2.3 CT 评分及血清IL-1β、IL-6、S100B 水平预测颅脑损伤患者早期预后不良的价值分析
CT 评分、IL-1β、IL-6、S100B 单独及联合对颅脑损伤患者早期预后不良均有一定的预测价值(曲线下面积>0.5,P<0.05)。见图1、表3。

表3 CT 评分及血清IL-1β、IL-6、S100B 水平预测颅脑损伤患者早期预后不良的预测价值分析
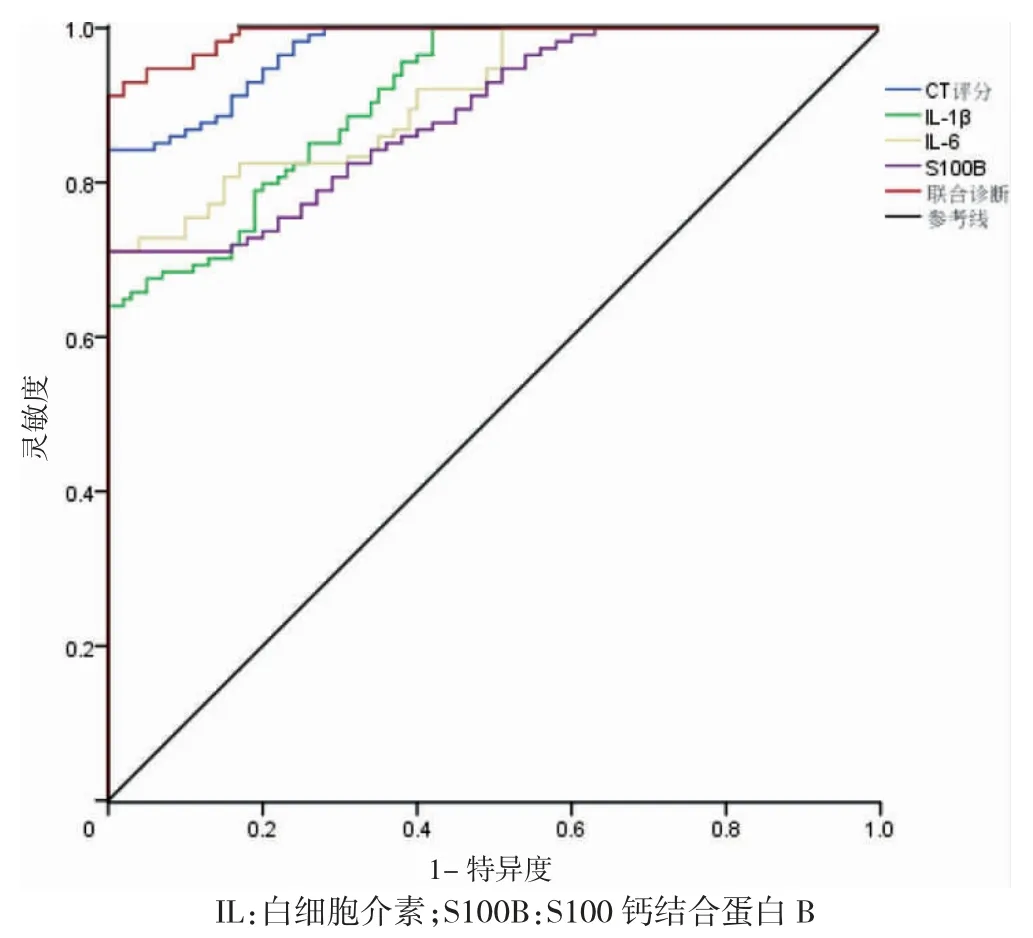
图1 CT 评分及血清IL-1β、IL-6、S100B 水平单独与联合预测颅脑损伤患者早期预后不良的受试者操作特征曲线
3 讨论
颅脑损伤通常具有瞳孔散大、呕吐、头痛、意识障碍等临床表现,并且病死和致残率均较高[8-9]。开颅手术是目前治疗颅脑损伤患者的有效手段,但也存在并发症较多、预后不理想等缺点[10-14]。CT 评分多用于评价分析颅内结构的病理变化情况,为临床治疗颅内损伤提供指导[15-17]。创伤性颅脑损伤患者的脑脊液中S100B 水平出现异常升高,炎症介导的脑损伤和继发性缺血损伤的病理过程中有IL-1β 及IL-6 参与[18-19]。
本研究结果显示,CT 评分较高,IL-1β、IL-6、S100B 水平较高可能是颅脑损伤患者早期预后不良的危险因素,考虑其原因如下。①作为钙结合蛋白超家族中的成员,S100B 在维持神经元自身稳定、调节细胞增殖分化、维持Ca2+水平稳定等生理过程中均有参与[20-21]。正常情况下,血液循环中的S100B 水平较低,一旦机体受到创伤性颅脑损伤,血脑屏障便会受损,S100B 从神经细胞中释放,并通过血脑屏障进入血液循环[22]。②患者一旦发生急性颅脑损伤,机体便可出现应激性炎症反应,这种炎症反应由炎症因子介导,对于清除有害物质具有一定效果,但如果炎症反应过度激活,则会导致原有的神经组织损伤加剧,从而引起脑组织水肿、继发性脑组织损害[23]。IL-1β、IL-6可诱导其他炎症因子聚集,造成血脑屏障受损。此外IL-1β 在急性颅脑损伤发生时被首先活化,并诱导IL-6 产生、释放,IL-6 能够诱导单核巨噬细胞产生并释放大量炎症介质,扩大炎症级联反应,从而导致继发性脑组织损伤[24-25]。另外,IL-6 还可通过其他机制促进继发性脑组织损伤,如促进氧自由基释放,造成神经元死亡[26]。③急性颅脑损伤后颅内结构的病理变化是CT 评分的依据,如脑池、脑室压迫造成的中线结构移位,基底池受压变形及整个脑室系统变小等[27]。CT 检查可以准确、快速地反映颅内结构变化,随着CT 技术的发展,小脑和后颅凹病变也可清晰显示,CT评分以颅内结构变化为评分基础,对颅内损伤的评估效果较好,也有利于对病情进行早期诊断,为疾病的治疗提供指导。本研究中预后良好患者的CT 评分较低,并且CT 评分单独或联合血清指标预测患者预后均有一定的价值,这与既往研究结果一致[28-29]。
本研究使用logistic 回归模型及受试者操作特征曲线进行分析,结果显示,GCS 评分3~8 分、高CT评分、高IL-1β、高IL-6、高S100B 水平是颅脑损伤患者早期预后不良的危险因素,临床应密切关注此类高风险人群。CT 评分和血清IL-1β、IL-6、S100B 水平单独预测颅脑损伤患者早期预后均有较高的灵敏度和特异度,联合诊断时,有利于提高预测的效能。
