硝苯地平缓释滴丸的制备及其质量评价
2022-02-16陈林林山西省肿瘤医院药学部太原03003山西医科大学药学院药剂教研室通讯作者maildulinhui00463com
杜 丽,陈林林,杜 艳(山西省肿瘤医院药学部,太原 03003;山西医科大学药学院药剂教研室;通讯作者,E-mail:dulinhui-004@63.com)
硝苯地平(nifedipine,NF)是第一代二氢吡啶类钙离子拮抗剂,具有舒张外周动脉、冠状动脉的作用,临床上主要用于高血压和心脑血管疾病的治疗。其不足之处是在水中溶解度低,半衰期短,给药次数频繁,血药浓度波动大,容易引起一些不良反应[1],将其制备成缓控释制剂,可以降低血药浓度波动,减少给药次数,降低毒副作用。市场上已有的剂型为硝苯地平的缓释胶囊和片剂,制备过程中,首先采用固体分散体技术或包合技术,然后再制成缓控释制剂,制备过程比较复杂[2,3]。
缓释滴丸是缓释材料与载体材料加热熔融后,将药物加入,熔融液滴入不相混溶的冷凝液中,收缩成滴丸。熔融法制备滴丸的药物可以是水溶性或难溶性,制备工艺简单易操作,为缓控释制剂的开发提供新的思路[4]。本研究通过筛选硝苯地平缓释滴丸的最优处方,制备硝苯地平缓释滴丸,并对其进行质量评价,旨在探讨治疗高血压药物硝苯地平适合患者使用的最佳剂型,为硝苯地平药物制剂的进一步研究和和开发使用提供研究基础。
1 仪器与试药
滴丸制备装置(自制);UV-1200紫外可见分光光度计(上海美谱达仪器有限公司);RC-8D溶出度测试仪(国铭医药设备有限公司);SB-5200DTDN超声波清洗机(宁波新芝生物科技股份有限公司);CP21电子天平(奥豪斯仪器有限公司)。
硝苯地平原料药(亚宝药厂提供);硝苯地平对照品(北京索莱宝科技有限公司,批号:111B021);聚乙二醇-6000、聚乙二醇-4000(天津市大茂化学试剂厂);硬脂酸(成都市科龙化工试剂厂)、十八醇(成都市科龙化工试剂厂);其他试剂均为分析纯。
2 方法与结果
2.1 含量测定方法的建立
2.1.1 吸收波长的选择 在200~500 nm范围内,分别对硝苯地平对照品溶液和载体材料溶液进行紫外扫描。结果表明,硝苯地平在320 nm波长处有稳定的紫外吸收峰,且空白辅料无干扰(见图1),故选择320 nm为测定波长。
2.1.2 NF标准曲线的绘制 精密称取硝苯地平对照品适量,置50 ml量瓶中,加入适量甲醇溶解,加0.35%十二烷基硫酸钠(SDS)溶液稀释至刻度摇匀,即得1.1 mg/L的储备液。精密量取储备液适量置于25 ml量瓶中,制成浓度为0.008 8,0.017 6,0.026 4,0.035 2,0.044 0 mg/L的系列标准溶液,在320 nm波长处测定吸光度Y。以吸光度Y为纵坐标,浓度C为横坐标(mg/L)绘制标准曲线。标准曲线方程为:Y=13.2C+0.024 5,硝苯地平在0.008 8~0.044 mg/L浓度范围内吸光度和浓度线性关系良好。

A.硝苯地平 B.载体材料图1 硝苯地平在0.35%SDS溶液中的紫外吸收光谱Figure 1 The UV absorption spectrum of nifedipine in 0.35% SDS solution
2.1.3 精密度 取低、中、高浓度(0.008 8,0.026 4,0.044 0 mg/L)的对照品溶液各1份,日内连续测定3次,连续测3 d,计算浓度的RSD,日内精密度为1.77%,0.38%和0.35%,日间精密度为1.75%,0.98%和1.13%,表明精密度良好。
2.1.4 稳定性 分别精密吸取硝苯地平储备液进行稀释,置于37 ℃恒温水浴中,分别于0,2,4,8,12 h取样,于320 nm处测定吸光度值。结果表明,硝苯地平在溶出介质中稳定性实验的RSD均<2.00%,稳定性良好。
2.1.5 回收率的测定 称取已知硝苯地平含量的供试品适量(约相当于硝苯地平3 mg)9份,精密称定,置25 ml棕色容量瓶中,分别加入硝苯地平对照品的量为80%,100%,120%各3份,用0.35%SDS溶液超声溶解,稀释至刻度,摇匀,精密吸取0.2 ml置于10 ml量瓶中,加0.35%SDS稀释至刻度,以相应介质为空白,于320 nm处测定吸光度值[5]。根据标准曲线方程计算回收率。结果表明,硝苯地平的平均回收率分别为98.01%,97.26%和96.54%,符合要求。
2.1.6 含量测定 取所制得的硝苯地平缓释滴丸10粒,用研钵研成粉末。精密称取缓释滴丸粉末5.0 mg,置于25 ml量瓶中,加入适量0.35%SDS溶液,超声10 min,加甲醇稀释至刻度,摇匀。在320 nm波长下,测定吸光度(A)值。根据标准曲线方程计算浓度,计算硝苯地平含量。结果样品中硝苯地平含量平均为(19.40±0.64)%。
2.2 释放度测定方法
按照新版药典二部附录,采用浆法测定硝苯地平缓释滴丸的体外释放度。取硝苯地平缓释滴丸6份,每份6粒,分别置600 ml溶出介质,溶出介质为0.35% SDS溶液,温度为(37.0±0.5)℃,转速为100 r/min,于1,2,4,6,8,10 h取样5 ml,同时补充同体积溶出介质,经0.45 μm微孔滤膜滤过,于320 nm波长处测定吸光度值,计算硝苯地平缓释滴丸的累积释放度Q(%)。
2.3 缓释滴丸的制备
将一定比例的3%硬脂酸、PEG4000和PEG6000(1 ∶2),于水浴锅中加热至熔融状态,将主药加入搅拌均匀,保持药液温度75 ℃,滴入冷凝高度为20 cm冷凝液中,冷凝收缩成丸,收集滴丸,擦丸,选丸,干燥即得。
采用单因素实验设计法筛选处方,分别考察缓释载体材料、硬脂酸用量、PEG4000和PEG 6000用量比例、载药量对硝苯地平缓释滴丸体外释放度的影响。
以综合评分K为评价指标,计算公式为:K=|Q2 h-20%|+|Q6 h-60%|+|Q10 h-80%|,其中Q2 h,Q6 h,Q10 h分别代表NF缓释滴丸在2,6,10 h的累积释放度。K值越小,表明缓释效果越好[6]。
2.3.1 缓释载体材料考察 固定PEG4000与PEG6000质量比为1 ∶2,缓释载体材料占载体材料质量比为3%,载药量25%,冷凝液高度20 cm,药液温度75 ℃,分别以硬脂酸、十八醇为缓释载体材料,制备硝苯地平缓释滴丸,进行体外释放试验,计算K值。
结果显示,以硬脂酸为缓释载体材料,所得滴丸K值较小(见表1)。以十八醇为载体材料的滴丸释药较快(见图2)。因此,确定以硬脂酸为缓释载体材料。

表1 缓释载体材料对释放度综合评分的影响 (%)
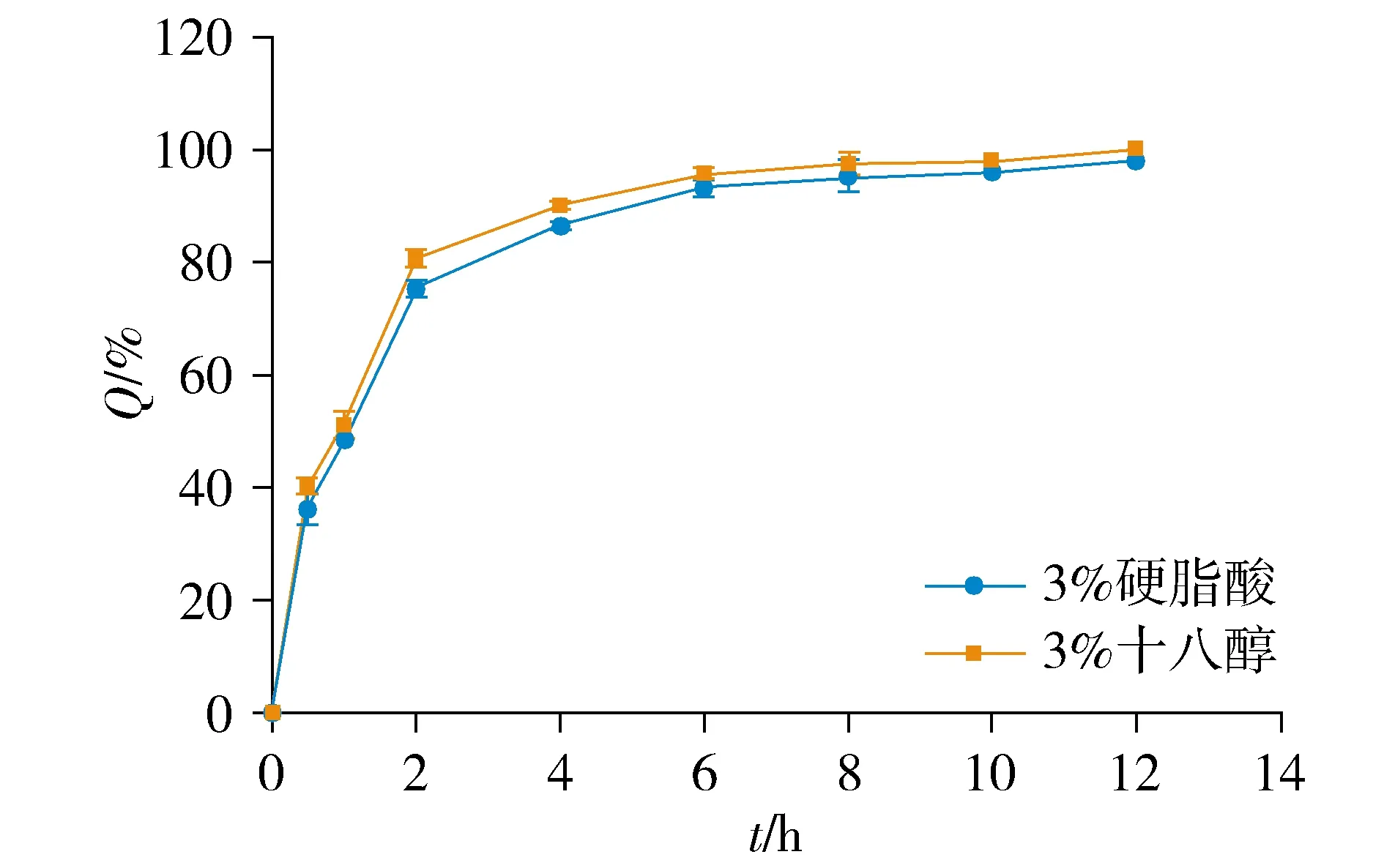
图2 不同缓释载体材料溶出曲线Figure 2 Dissolution curves of different sustained-release carrier materials
2.3.2 硬脂酸用量考察 固定冷凝液高度20 cm,药液温度75 ℃,PEG4000 ∶PEG6000比例1 ∶2,载药量25%,分别制备硬脂酸用量为6%,9%,12%的硝苯地平缓释滴丸,进行体外释放试验,计算K值。
结果显示,硬脂酸用量为9%时,所得滴丸K值最小(见表2)。硬脂酸用量为6%时滴丸6 h释放度为82.30%,释药速度过快;当硬脂酸用量为12%时,滴丸6 h释放度为24.26%,释放速度过慢(见图3)。所以,确定硬脂酸用量为9%。
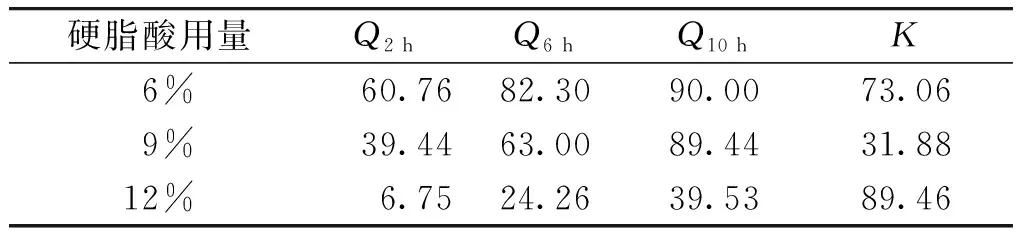
表2 硬脂酸比例对释放度综合评分的影响 (%)
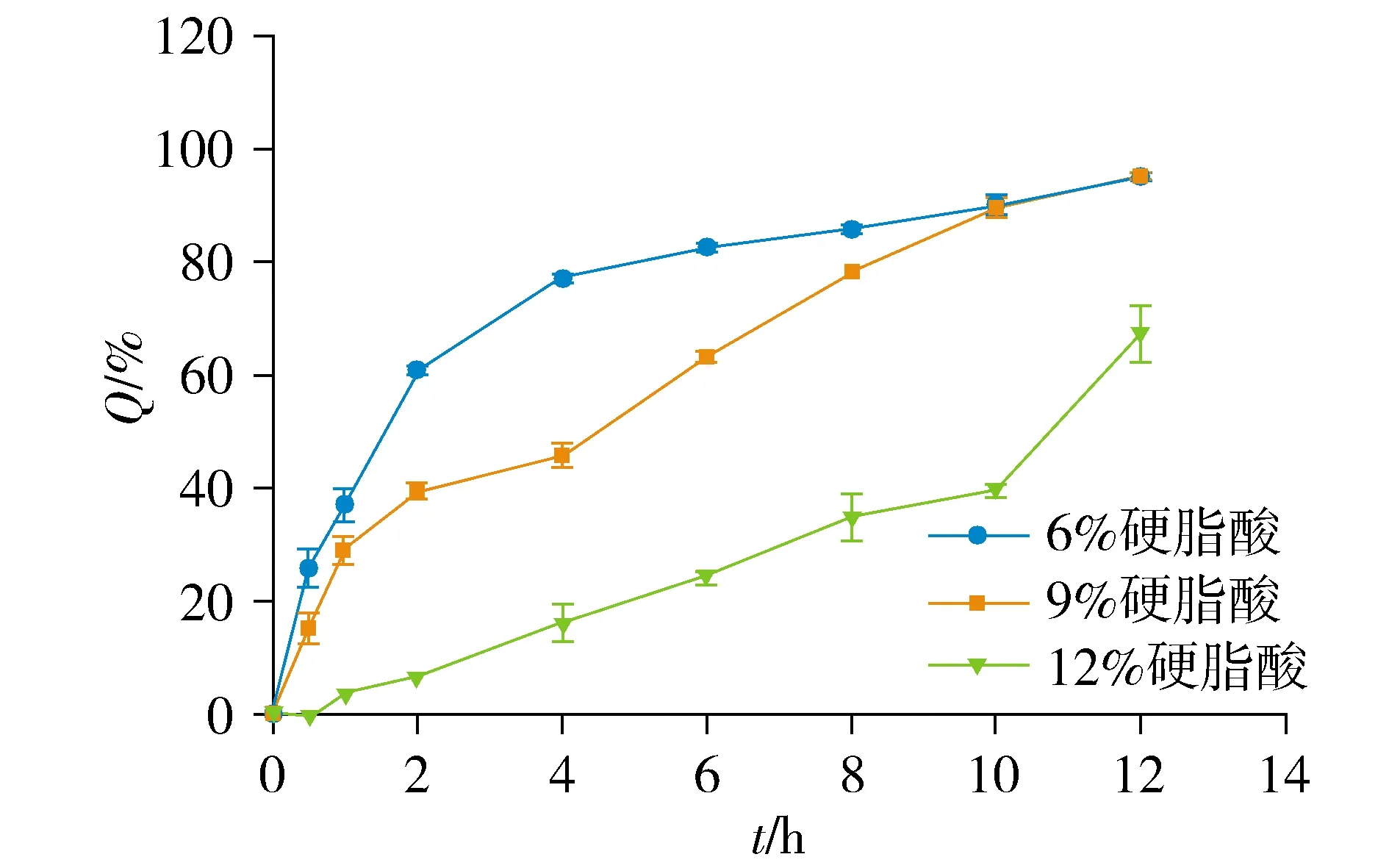
图3 不同比例硬脂酸溶出曲线Figure 3 Dissolution curves of stearic acid with different proportions
2.3.3 PEG4000与PEG6000比例考察 固定硬脂酸用量为9%,冷凝液高度20 cm,药液温度75 ℃,载药量25%,分别制备PEG4000与PEG6000比例为1 ∶1,1 ∶2的硝苯地平缓释滴丸,进行体外释放试验,计算K值。结果表明,随着PEG6000比例的增加,释放速度增加(见图4);PEG4000 ∶PEG6000=1 ∶2时,K值较小(见表3),所以选择PEG4000 ∶PEG6000比例为1 ∶2。
2.3.4 载药量考察 固定PEG4000 ∶PEG6000比例1 ∶2,冷凝液高度为20 cm,药液温度75 ℃,硬脂酸用量9%,分别制备载药量为25%,35%,45%的滴丸,进行体外释放试验,计算K值。结果发现,载药量为35%时,药物释放速度较快;载药量为45%时,滴制困难,所得滴丸成型差;载药量为25%时K值较小(见图5,表4),所以最终选择载药量为25%。
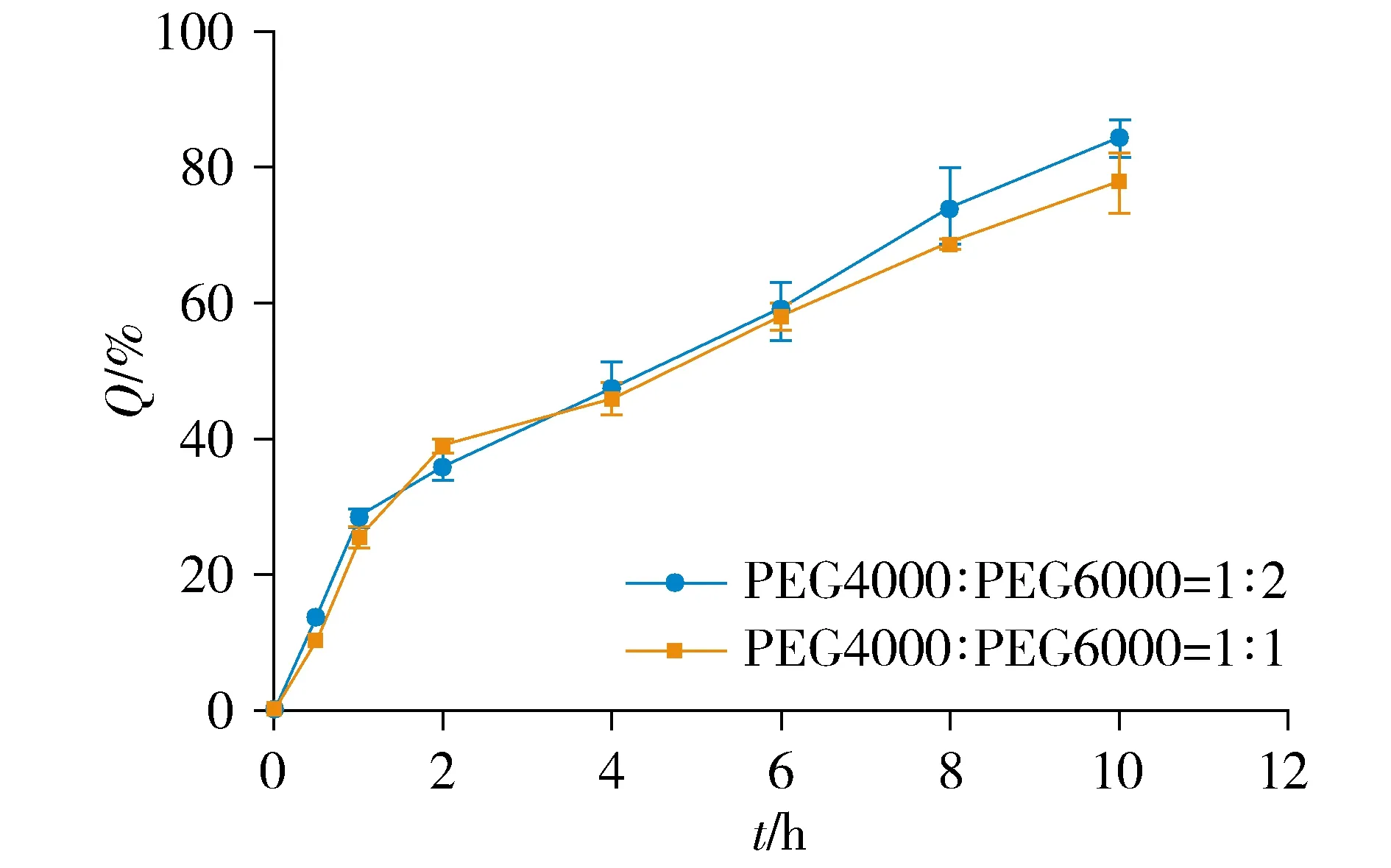
图4 PEG4000与PEG6000不同比例溶出曲线Figure 4 Dissolution curves of PEG4000 and PEG6000 in different proportions

表3 PEG4000与PEG6000不同比例对释放度综合评分的影响 (%)

图5 不同载药量溶出曲线Figure 5 Dissolution curves of different drug loading
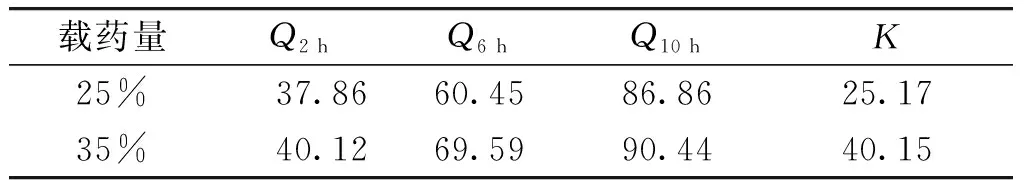
表4 载药量对释放度综合评分的影响 (%)
2.3.5 工艺验证 通过单因素试验表明,优化的处方为:硬脂酸为缓释载体材料,用量占载体材料总质量的9%,PEG4000 ∶PEG6000为1 ∶2,载药量为25%。制备3批滴丸,批号分别为:20210601,20210602,20210603,每批制备量均为20 g。滴丸呈球形,大小均一,粒径为(2.85±0.04)mm,每粒滴丸含硝苯地平9.70 mg。测定NF缓释滴丸的体外释放度,体外释药曲线见图6。结果表明硝苯地平缓释滴丸在12 h体外累计释放达到90%,符合缓慢释放的特征[7]。3批硝苯地平缓释滴丸体外释放度无明显差异,表明设计与优化的结果符合要求。

图6 硝苯地平缓释滴丸体外释放度曲线Figure 6 In vitro release curve of nifedipine sustained release dropping pills
2.4 体外释药方程拟合
用于描述缓释、控释制剂的主要数学模型有零级释药方程、一级释药方程、Higuchi平面扩散模式方程[8]。将图6中释放度和时间数据用上述释药模型进行拟合,结果见表5。
由表5可见,一级方程模型拟合的相关系数最大,说明滴丸的释药主要为一级动力学过程。Higuchi方程的相关系数为0.961,说明释药机制为药物扩散的作用。
2.5 质量评价
2.5.1 质量差异限度检查 按照2020版《中国药典》二部附录要求检查3批样品(每批20丸),结果3批滴丸的平均丸重分别为47.50,44.90,48.20 mg;平均丸重差异分别为5.77%,5.65%,5.70%,均在±10%范围内,符合规定。
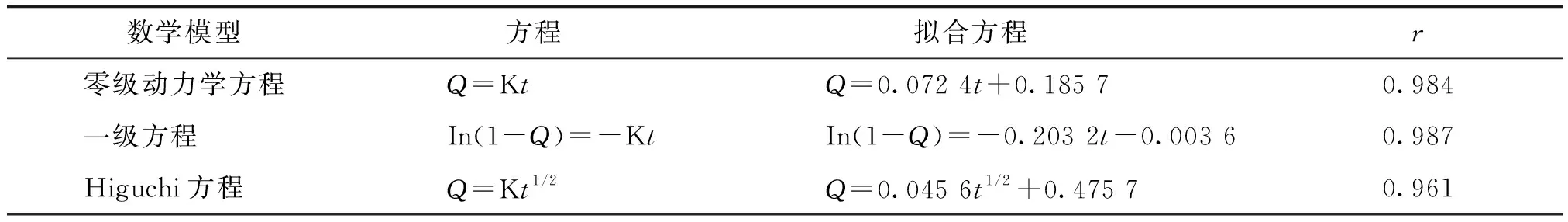
表5 释药模型的拟合
2.5.2 高温试验 将硝苯地平缓释滴丸置于表面皿,于40 ℃条件下放置10 d,于0,5,10 d取样,分别观察硝苯地平缓释滴丸的外观,测定其含量与释放度[9]。结果表明,在40 ℃条件下,硝苯地平缓释滴丸外观、含量、释放度基本无变化(见表6)。
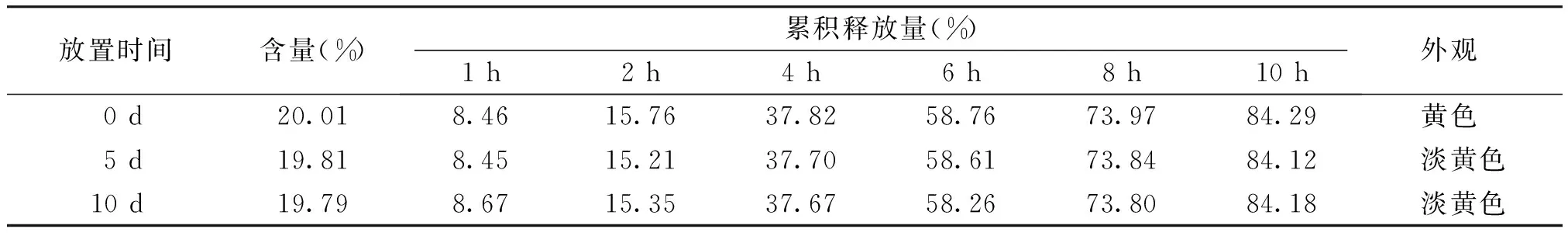
表6 硝苯地平缓释滴丸高温考察结果
2.5.3 高湿试验 将硝苯地平缓释滴丸置于表面皿,于25 ℃,相对湿度(RH)90%±5%(饱和KNO3水溶液)条件下放置10 d,于0,5,10 d取样,分别观察硝苯地平缓释滴丸的外观,测定其含量与释放度。结果表明,在高湿条件下,硝苯地平缓释滴丸含量、药物释放速率、累积释放度变化不明显,质量基本稳定(见表7)。
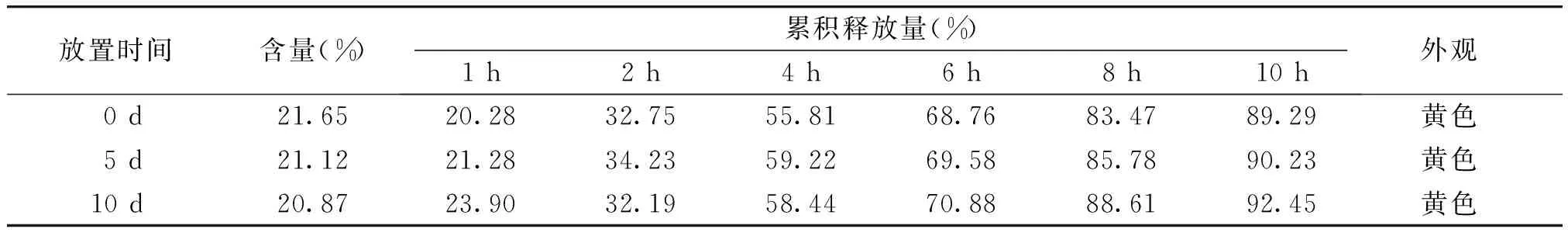
表7 硝苯地平缓释滴丸高湿考察结果
2.5.4 光照试验 将硝苯地平缓释滴丸置于表面皿,于(4 500±500)LX光照下放置10 d,于0,5,10 d取样,分别观察硝苯地平缓释滴丸的外观,测定其含量与释放度。结果表明,在光照条件下,硝苯地平缓释滴丸含量降低,药物释放速率、累积释放度均发生改变(见表8),表明硝苯地平缓释滴丸对光敏感,在光照下极不稳定。

表8 硝苯地平缓释滴丸光照稳定性考察结果
3 讨论
硝苯地平为难溶性药物,本实验将其制备成缓释滴丸,在载体材料中,添加水溶性载体材料,目的是将药物高度分散在载体材料中,使其溶解度增加;同时添加脂溶性载体材料,目的是延缓药物的溶出,能够缓慢释放。在实验中采用的水溶性载体材料为PEG4000和PEG6000,脂溶性载体材料为硬脂酸,同时实现增加药物溶出速度和控制药物释放的目的。
由于硝苯地平在水中的溶解度较低,因此在体外释放度实验中,考察了不同的溶出介质对其释放度的影响,主要比较了0.15%SDS溶液、0.25%SDS溶液、0.35% SDS溶液,结果表明硝苯地平在0.15%和0.25%SDS溶液中溶解度很低,因此选择溶出介质为0.35% SDS溶液。
本实验采用单因素试验设计法,进行NF缓释滴丸处方工艺考察,通过体外释放度试验,确定脂溶性载体材料种类为硬脂酸,并确定其用量,确定水溶性载体材料为PEG4000与PEG6000,并确定其用量,同时确定载药量。
通过对所制缓释滴丸的释放度和时间数据进行释药模型拟合,结果符合一级方程。通过进行质量差异限度、稳定性试验的研究,结果表明该缓释滴丸质量差异限度符合药典规定,并且在高温、高湿条件下,滴丸性质稳定,但对光敏感,在光照条件下极不稳定,因此整个实验过程需要避光进行。
本实验所制的滴丸可以同时满足长效和高效的用药要求,同时,制备工艺简单,将载体材料熔融,滴制即可得到,适合工业化生产。而且本实验制备的硝苯地平缓释滴丸,可以长期缓慢释放药物,减少患者服药次数,降低血药浓度波动,提高患者的顺应性。
