紫檀芪对前列腺癌骨转移PC-3细胞活力、凋亡及能量代谢的影响*
2022-02-16陈集业廖英强陈博丰刘兴漠
陈集业, 廖英强, 黄 帅, 陈博丰, 刘兴漠△
(1中山大学附属第六医院骨科,广东 广州 510655;2广州医科大学附属第二医院骨科,广东 广州 510260)
前列腺癌作为全世界男性最为常见的恶性肿瘤之一[1],在美国发病率高居首位,死亡率位居第二[2],近年来多种因素导致其发病率在我国也呈现逐渐上升趋势[3]。骨转移在前列腺癌转移中为最常见,也是造成患者死亡的主要原因,目前其治疗方法仍是临床需要攻克的难题之一[4-6]。肿瘤细胞的能量生成源自于糖酵解和线粒体的氧化磷酸化,研究表明,即使在有氧的情况下,肿瘤细胞仍选择糖酵解方式而不是氧化磷酸化来提供能量,即有氧糖酵解或War‑burg 效应[7]。鉴于肿瘤细胞这种独特的能量代谢方式,我们猜测抑制前列腺癌骨转移糖酵解途径很可能成为前列腺癌骨转移治疗的新策略。
紫檀芪(pterostilbene,PTE)是一种广泛存在于葡萄、蓝莓和花生等天然植物中的多酚化合物,现有证据发现其在多种恶性肿瘤中具有抗肿瘤作用,但其具体机制需进一步探讨[8]。既往有研究发现PTE的类似物白藜芦醇可通过调节肿瘤细胞的糖酵解、降低能量生成从而抑制肿瘤生长[9],但PTE在前列腺癌细胞糖酵解中的具体作用尚不明确。本研究拟探讨PTE 对人前列腺癌骨转移PC-3 细胞活力、细胞凋亡和能量代谢的影响,为前列腺癌骨转移药物治疗提供一种新的思路。
材料和方法
1 材料
人前列腺癌PC-3 细胞株(ATCC);胰蛋白酶、RPMI-1640培养基和胎牛血清(HyClone);Cell Counting Kit-8(CCK-8)和BCA 蛋白浓度测定试剂盒(上海碧云天生物技术有限公司);PTE、ATP 测定试剂盒、乳酸测定试剂盒和葡萄糖检测试剂盒(Sig‑ma);兔抗人乳酸脱氢酶A(lactate dehydrogenase A,LDHA)、AMP 活化蛋白激酶(AMP-activatied protein kinase,AMPK)、Bad、Bax和Bcl-2抗体(Abcam)。
2 细胞培养
PC-3 细胞用RPMI-1640 完全培养液(含10% 胎牛血清)于5% CO2、37℃的培养箱中培养。每2~3 d更换培养液,选取对数生长期的细胞用于本实验。
3 方法
3.1 CCK-8 法检测细胞活力取PC-3 细胞以每孔1.0×104个细胞密度接种于96 孔细胞培养板中。细胞贴壁后,用含不同浓度(5、10、20、40 和80 μmol/L)PTE 的完全培养液继续培养细胞48 h,各浓度均设3平行孔,另设不加药的空白对照孔。每孔中加入10 μL CCK-8溶液,5%CO2、37℃避光孵育4 h后,在酶标仪450 nm 波长处读取并记录吸光度(A)。运用统计软件SPSS 分析计算半数抑制浓度(50% inhibitiory concentration,IC50)为30 μmol/L,并用该浓度的PTE处理PC-3 细胞不同时间(0、24、48 和72 h)后,用同样的方法测定各A值。
3.2 流式细胞术检测细胞周期取PC-3 细胞以每孔1.0×104的密度接种于6 孔板,5%CO2、37℃培养箱过夜后,加入20 和40 μmol/L 的PTE 继续培养细胞48 h,每个浓度均设3 个平行孔,对照组加入同体积的PBS。分别将收集到的各组细胞离心,PBS 洗涤,70% 乙醇固定,4 ℃下保存过夜,次日再次离心及PBS 重悬细胞,加入PI-Rnase A 混合液,室温避光孵育30 min后,用流式细胞仪测定细胞周期情况。
3.3 流式细胞术检测细胞凋亡率取PC-3 细胞以每孔1.0×104的密度接种于6孔板,5%CO2、37 ℃培养箱过夜后,加入20和40 μmol/L的PTE继续培养细胞48 h,每个浓度均设3个平行孔,对照组加入同体积的PBS。将收集到的各组细胞用PBS 洗涤并调整细胞浓度至1.0×109/L,加入Annexin V-PI 混合液,室温避光孵育15 min 后,用流式细胞仪测定各组细胞凋亡情况。
3.4 葡萄糖摄取量、乳酸产生和ATP产生的检测分别用20 和40 μmol/L 的PTE 处理PC-3 细胞48 h,每个浓度均设3 个平行孔,另设新鲜培养基作为对照组,收集上清液,制备标准曲线。使用葡萄糖检测试剂盒测量葡萄糖摄取量,乳酸测定试剂盒测量乳酸生成量,ATP测定试剂盒测量ATP水平。
3.5 Western blot 法检测Bad、Bax、Bcl-2、LDHA 和AMPK 表达分别用20和40 μmol/L 的PTE 处理PC-3 细胞48 h 后,裂解细胞、提取蛋白。按BCA 法检测细胞总蛋白的浓度。蛋白上样(每孔60 μg),经12%SDS-PAGE 将蛋白进行分离并转移至PVDF 膜。加入5% 的脱脂奶粉进行封闭1 h。TBST 洗膜5 次,每次3 min,加入Ⅰ抗(兔抗人LDHA 和AMPK 抗体,1∶2 000;兔抗人Bad、Bax、Bcl-2和内参照GAPDH抗体,1∶1 000),4 ℃反应过夜。次日再次TBST 洗膜5 次,每次3 min。加入HRP 标记的羊抗兔IgG(1∶5 000)室温反应1.5 h。再用TBST 缓冲液洗膜5 次,每次3 min。ECL 试剂盒显影。实验重复3 次。采用Image-Pro Plus图像分析管理系统分析蛋白条带灰度值。
4 统计学处理
所有的数据均采用SPSS 25.0 软件处理。各组数据均以均数±标准差(mean±SD)表示。组间均数比较采用t检验或单因素方差分析。以P<0.05 为差异有统计学意义。
结 果
1 不同浓度的PTE对PC-3细胞活力的影响
与对照组相比,20、40 和80 μmol/L PTE 处理48 h 均可显著抑制PC-3 细胞活力(P<0.05 或P<0.01);PTE的IC50约为30 μmol/L,见图1。
2 PTE不同处理时间对PC-3细胞活力的影响
随着30 μmol/L PTE 作用时间(0、24、48 和72 h)的延长,其对PC-3 细胞活力的抑制作用越来越显著,且给药48 和72 h 后抑制作用差异均有统计学意义(P<0.01),见图2。
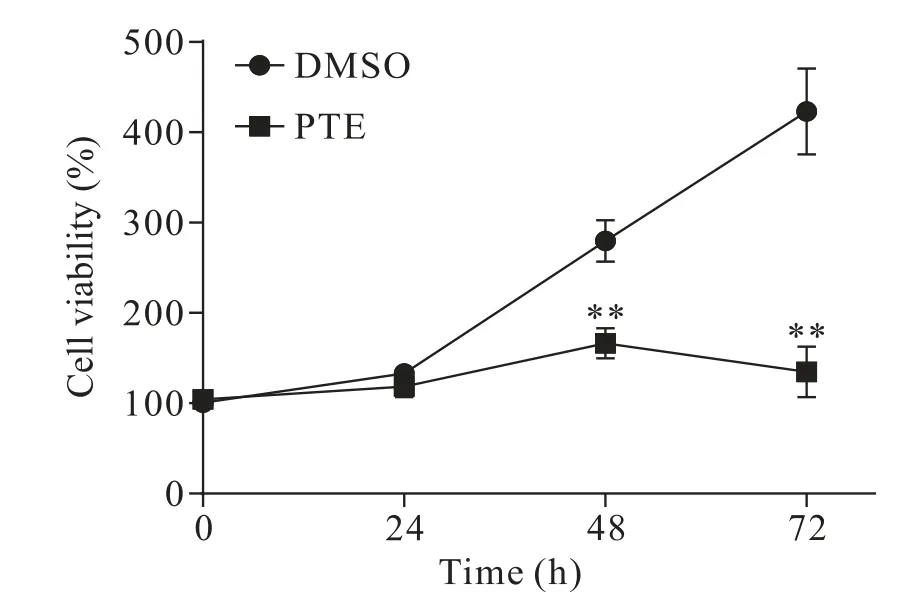
Figure 2.Effects of pterostilbene(PTE)treatment for different time on the viability of PC-3 cells measured by CCK-8 assay.Mean±SD. n=3.*P<0.05,**P<0.01 vs DMSO group.图2 紫檀芪不同处理时间对PC-3细胞活力的影响
3 PTE对PC-3细胞周期的影响
PTE 处理后PC-3细胞的细胞周期被明显阻滞在DNA 的合成期(S 期),而细胞静止期及DNA 合成前期(G0/G1期)的细胞相对减少,并呈剂量依赖性(P<0.01);与对照组相比,DNA 合成后期(G2期)和细胞分裂期(M 期)的细胞比例差异无统计学意义(P>0.05),见表1。

表1 紫檀芪对PC-3细胞周期的影响Table 1.Effect of pterostilbene(PTE)on PC-3 cell cycle mea‑sured by flow cytometry(%.Mean±SD. n=3)
4 PTE对PC-3细胞凋亡的影响
经过48 h 处理后,20 和40 μmol/L 的PTE 可明显促进PC-3 细胞凋亡,并呈明显的剂量依赖性,其差异有统计学意义(P<0.01),见表2。
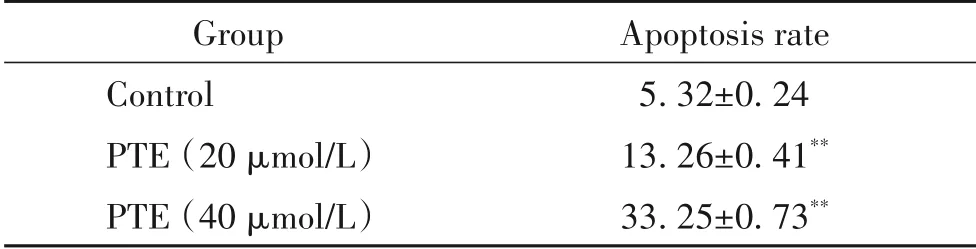
表2 紫檀芪对PC-3细胞凋亡的影响Table 2.Effect of pterostilbene(PTE)on the apoptosis of PC-3 cells measured by flow cytometry(%.Mean±SD. n=3)
5 PTE对PC-3细胞凋亡相关蛋白表达的影响
与对照组相比,20 和40 μmol/L 的PTE 可上调PC-3细胞中的促凋亡蛋白Bad和Bax的表达,并抑制抗凋亡蛋白Bcl-2 水平的表达,并呈剂量依赖性(P<0.01),见图3。
6 PTE对PC-3细胞能量代谢的影响
与对照组相比,20 和40 μmol/L 的PTE 均可降低PC-3 细胞中的葡萄糖摄取量以及乳酸产生水平(P<0.01),且呈剂量依赖性;而与之相对应的是,PC-3细胞中ATP 的生成趋势随着PTE 浓度的升高而逐渐下降(P<0.01),提示PTE 可抑制PC-3 细胞的有氧糖酵解,抑制肿瘤细胞的能量生成,见图4。
7 PTE对PC-3细胞LDHA和AMPK表达的影响
与对照组相比,20 和40 μmol/L 的PTE 处理可抑制PC-3 细胞中的LDHA 及AMPK 的表达水平,且随着PTE浓度的升高,降低越明显(P<0.01),见图5。
讨 论
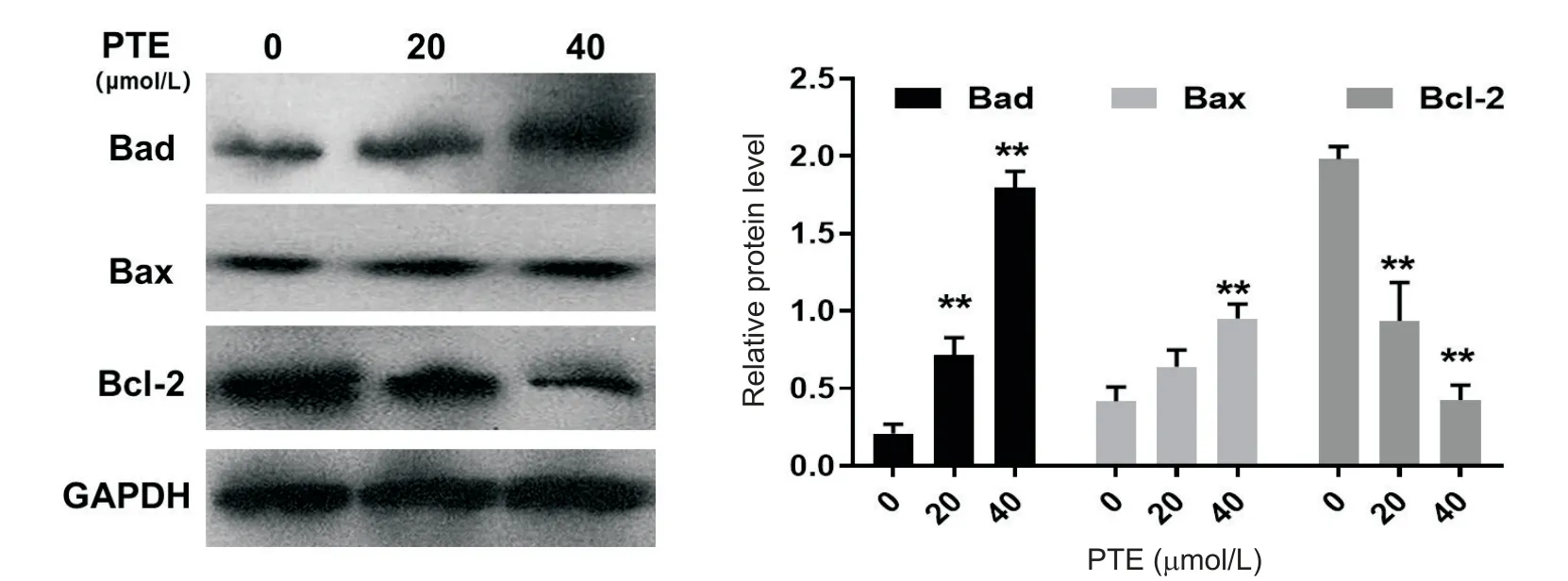
Figure 3.Effect of pterostilbene(PTE)on the expression of apoptosis-related proteins .Western blot was used to detect the expres‑sion of Bad,Bax and Bcl-2 in PC-3 cells cultured with different concentrations of PTE,and Image-Pro Plus software was used to analyze the gray value of protein bands.Mean±SD. n=3.*P<0.05,**P<0.01 vs 0 μmol/L group.图3 紫檀芪影响凋亡相关蛋白表达
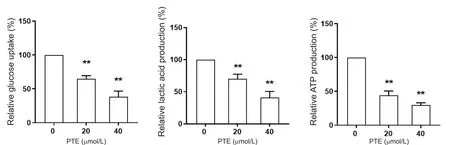
Figure 4.Effects of different concentrations of pterostilbene(PTE)on energy metabolism of PC-3 cells.The glucose uptake,lactic acid production and ATP level were measured by glucose detection kit,lactic acid determination kit and ATP assay kit,re‑spectively.Mean±SD. n=3.*P<0.05,**P<0.01 vs 0 μmol/L group.图4 不同浓度紫檀芪对PC-3细胞能量代谢的影响
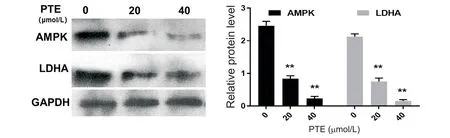
Figure 5.Effects of different concentrations of pterostilbene(PTE)on the expression of LDHA and AMPK in PC-3 cells.Western blot was used to detect the expression of AMPK and LDHA in PC-3 cells cultured with different concentrations of PTE,and Image-Pro Plus software was used to analyze the gray value of protein bands.Mean±SD. n=3.*P<0.05,**P<0.01 vs 0 μmol/L group.图5 不同浓度紫檀芪对PC-3细胞LDHA和AMPK表达的影响
前列腺癌骨转移治疗失败的因素复杂多样,而肿瘤的耐药性是主要原因之一,故近年来许多学者均致力于探寻新的安全有效的抗肿瘤药物,以期降低肿瘤的耐药风险并提高前列腺癌骨转移患者的生存率。许多临床前研究已证实一些天然植物化学物质的抗肿瘤作用联合癌症的传统化疗方法具有相加或协同效应[10]。研究发现,PTE 作为一种天然植物化合物对多种肿瘤等均具有明显抑制作用[11]。而在本研究中,我们证实了PTE 对人前列腺癌PC-3 细胞具有明显的抗肿瘤作用。
细胞周期的异常可导致肿瘤细胞进行无限制地增殖,因此对细胞周期的调控被认为是肿瘤治疗中很有吸引力的途径。研究发现PTE 可通过对细胞周期的阻滞抑制癌细胞的增殖。在研究PTE 对人胆管癌(cholangiocarcinoma,CCA)细胞的作用中发现,PTE 可以通过阻滞CCA 细胞的细胞周期于S 期从而抑制肿瘤细胞的增殖[12]。而在另一项研究中发现,PTE 是通过ERK 通路显著延迟细胞周期至G0/G1期从而抑制人乳腺癌细胞的增殖[13]。本研究中,根据CCK-8 实验结果,我们证实了PTE 对PC-3 细胞的活力具有抑制作用,且该抑制作用呈剂量和时间依赖性。此外,在检测PTE 对PC-3 细胞的细胞周期影响的实验中,我们发现细胞周期明显被阻滞在DNA 合成期S 期,由此我们推测PTE 可能通过影响DNA 的复制过程来抑制PC-3 细胞的生长。此外,多项实验发现PTE 还可以通过促进细胞凋亡来抑制肿瘤生长[14-15]。本研究中,我们发现随着PTE 浓度的增加,PC-3 细胞凋亡数目随之增加,同时促进凋亡的蛋白Bad 和Bax 表达相应增加,而抑制凋亡的蛋白Bcl-2表达相应减少,表明PTE 可呈剂量依赖性促进前列腺癌骨转移细胞的凋亡从而抑制肿瘤的发展。
肿瘤中有氧糖酵解增加的实验观察已被反复证实。有氧糖酵解是在肿瘤细胞中观察到的最具特征的代谢表型,与大多数正常细胞不同,即使在正常氧浓度下,肿瘤细胞也是主要通过糖酵解产生ATP 以获得大量能量,将大部分进入细胞的葡萄糖转化为乳酸,从而为肿瘤发生发展提供足够优势[16]。虽然糖酵解产生ATP 的速度比线粒体的氧化磷酸化更加快速,但就消耗每单位葡萄糖产生ATP 而言,它的效率要低得多。因此,这种转变需要肿瘤细胞实现异常高的葡萄糖摄取率,以满足其增加的能量、生化合成以及氧化还原需求[17-18]。而诸多实验表明,促进肿瘤细胞的糖酵解,可明显促进细胞代谢能量的生成从而促进肿瘤细胞的增殖,而糖酵解被抑制后可促进肿瘤细胞凋亡[19-21]。为确定PTE 对前列腺癌骨转移的能量代谢的影响,我们测量了PTE 作用PC-3 细胞后其萄糖摄取量和细胞内的乳酸生成量,结果显示,PTE 可明显抑制PC-3 细胞的葡萄糖摄取以及细胞内的乳酸生成水平,同时相对应的PC-3 细胞内ATP 的生成量同样呈下降趋势,这说明PTE 可通过减少细胞的葡萄糖摄取、抑制糖酵解从而抑制PC-3细胞能量的产生。这与PTE对PC-3细胞活力的抑制和促进细胞凋亡情况一致,提示PTE 导致的PC-3 细胞的活力抑制和促进细胞凋亡与抑制细胞的能量产生有关。
LDHA上调已在许多类型的肿瘤中被报道,并与不良预后显著相关[22-23]。LDHA 不仅能促进肿瘤细胞的迁移和侵袭,而且能促进肿瘤在体内外的生长[24]。在癌细胞的有氧糖酵解中,LDHA作为糖酵解过程的关键酶之一,将丙酮酸还原为乳酸,并产生少量ATP,从而维持肿瘤的高糖酵解率,即前述的War‑burg 效应。减少LDHA 的表达,丙酮酸无法还原为乳酸,肿瘤细胞依赖的糖酵解过程受到抑制,其增殖、转移及侵袭最终因能量来源限制而受到抑制。另有研究发现,抑制LDHA 的表达可导致乳酸减少而肿瘤微环境酸化受到破坏,肿瘤细胞因此生长减少,凋亡增加,侵袭能力减弱,从而显著减缓肿瘤的进展[25]。而AMPK 是哺乳动物组织中细胞能量代谢稳态的中心调节器。细胞能量状态下降时可激活AMPK,活化的AMPK 将进一步激活产生ATP的分解代谢途径(如葡萄糖的摄取、糖酵解),同时下调消耗ATP 的生物合成途径[26]。AMPK 的激活也可以通过调节细胞的代谢可塑性为癌细胞提供生长优势,从而为肿瘤细胞提供适应能量代谢应激的灵活性[27]。本研究中,随着PTE 浓度的增加,LDHA 和AMPK 的表达逐渐下降,这与PC-3 细胞内葡萄糖摄取、乳酸及ATP 生成量的减少相印证,且与PC-3 细胞活力抑制、促细胞凋亡的趋势一致,进一步说明PTE 可能通过抑制PC-3 细胞糖酵解途径、减少代谢能量的生成从而抑制前列腺癌骨转移PC-3 细胞的活力并促进凋亡。
综上所述,我们通过体外实验证实了PTE 可抑制前列腺癌细胞活力,促进细胞凋亡,从而抑制前列腺癌骨转移的进展,其作用可能是通过抑制肿瘤细胞的糖酵解、减少肿瘤细胞内能量的生成而实现。但PTE 对肿瘤细胞能量代谢影响的深层机制、体内实验是否与体外实验结果一致、联合化疗药物的作用等这些仍需进一步探讨。
