脓毒症心肌功能障碍关键基因的筛选及生物信息学分析
2022-02-16蒋万威杨国辉
蒋万威 杨国辉
贵州医科大学临床医学院,贵州贵阳 550004
脓毒症心肌功能障碍(sepsis-induced myocardial dysfunction,SIMD)是因脓毒症导致的心脏收缩或舒张功能下降,是脓毒症常见的器官功能障碍之一,与患者的生存风险显著相关[1-3]。超过10%的SIMD 患者可进一步发展为脓毒症性心肌病,长期影响患者心功能[4]。至今仍未完全阐明其具体的发病机制,多个潜在病理生理过程可能共同参与其中[5]。现阶段多使用超声多普勒、心肌标志物等辅助措施识别SIMD,但这些指标缺乏特异性,且尚无针对性的治疗措施[6-8]。本研究通过分析高通量基因表达数据库中的多个数据集,对差异表达的基因进行研究,以期发掘SIMD 潜在的研究方向。
1 资料与方法
1.1 基因表达数据集选择
在高通量基因表达数据库中检索脓毒症患者外周血转录组数据集及SIMD 小鼠心肌组织转录组数据集(表1),为匹配脓毒症患者外周血样本选择小鼠盲肠结扎穿孔术(cecal ligation and puncture,CLP)后24 h 的心肌转录组数据为研究对象。
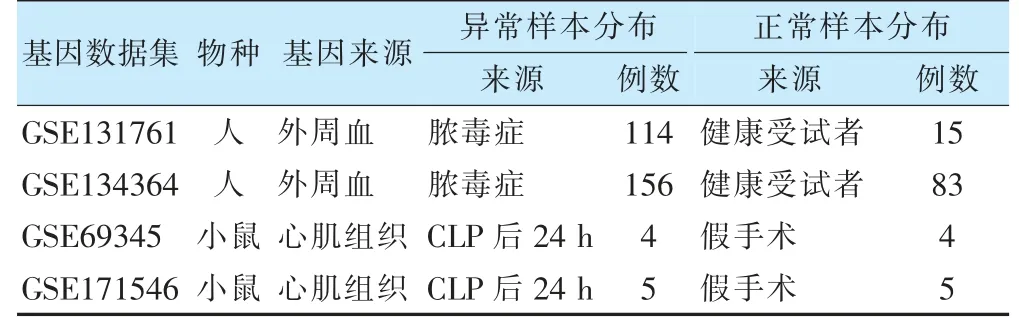
表1 脓毒症患者及脓毒症心肌功能障碍动物模型数据集
1.2 差异基因筛选
人体以脓毒症患者及健康受试者分组,小鼠以CLP 及假手术分组。使用R 软件对各组数据集进行分析,采用P-Value<0.05、Log2FC >1 为显著性筛选条件,对小鼠共同差异基因进行同源转换,提取脓毒症患者与动物模型共同差异基因。见图1。
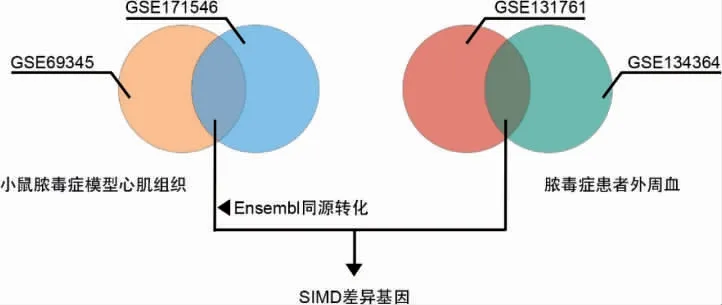
图1 脓毒症心肌功能障碍差异基因筛选流程
1.3 差异基因生物功能分析
对脓毒症外周血及SIMD 差异基因进行基因本体(gene ontology,GO)及京都基因和基因组数据库(Kyoto encyclopedia of genes and genomes,KEGG)富集分析。
1.4 筛选SIMD 关键基因
对脓毒症患者差异基因进行加权基因共表达网络分析(weighted correlation network analysis,WGCNA),以P <0.05 提取与临床性状显著相关的基因模块,筛选各基因模块的前50 核心基因,同时定位SIMD 相关基因。
1.5 绘制蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络
利用STRING 数据库对脓毒症患者差异基因进行蛋白转换,取中等置信度>0.400 绘制PPI 网络,筛选提取核心蛋白,并从中定位SIMD 相关蛋白。
2 结果
2.1 脓毒症心肌损伤差异基因筛选结果
脓毒症患者外周血及小鼠脓毒症心肌组织分别有318 个及143 个共同差异基因,SIMD 差异基因占84 个,其中下调基因54 个,上调基因30 个。见图2。
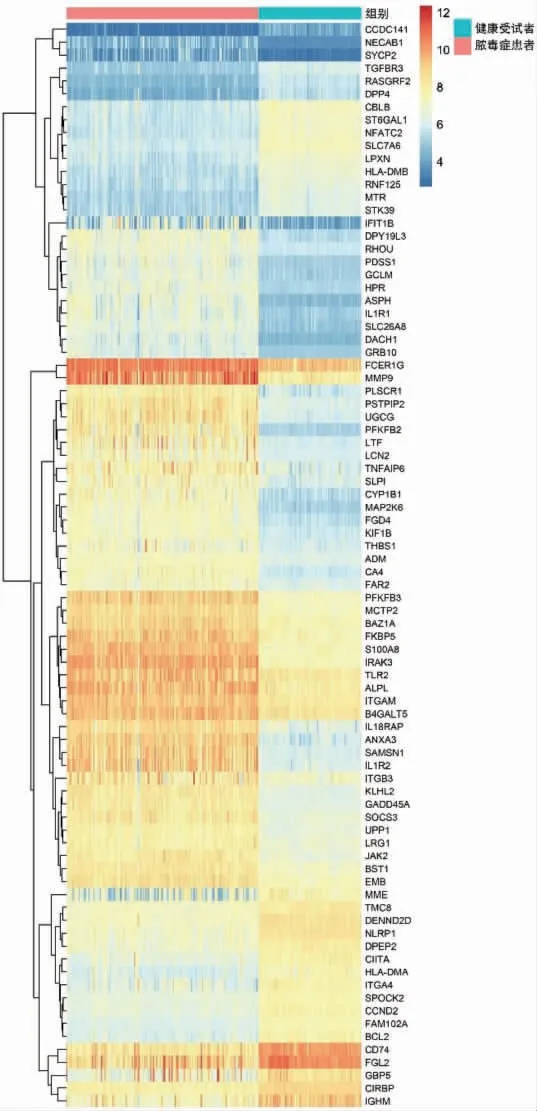
图2 脓毒症心肌功能障碍差异基因
2.2 脓毒症心肌损伤差异基因GO 及KEGG 富集分析
脓毒症及SIMD 差异基因集中在T 细胞、中性粒细胞、炎症反应等生物学过程;两者在细胞成分及分子功能中也有相似基因富集(图3~4)。脓毒症外周血与SIMD 差异基因在KEGG 富集分析中有较大差异(图5~6)。
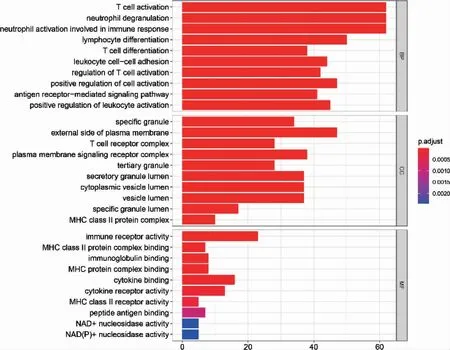
图3 脓毒症患者外周血差异基因基因本体富集分析

图4 脓毒症心肌功能障碍差异基因基因本体富集分析
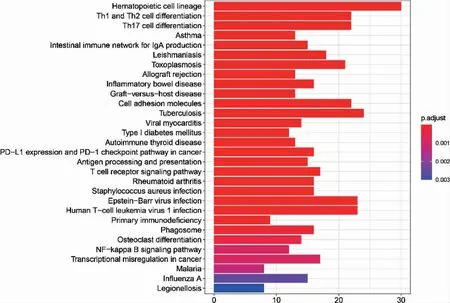
图5 脓毒症患者外周血差异基因京都基因和基因组数据库富集分析
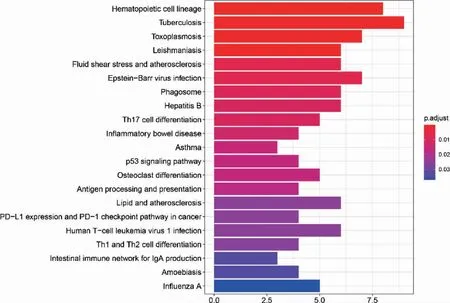
图6 脓毒症心肌功能障碍差异基因京都基因和基因组数据库富集分析
2.3 差异基因WGCNA 分析
休克、APPCHE Ⅳ评分、主要诊断与绿色及蓝色基因模块相关,28 d 存活率与棕色基因模块相关,见图7。IRAK3、ANXA3、S100A8、GADD45A、LCN2、MME、LTF、NLRP1、FGL2、GBP5、KLHL2、KIF1B 等 为SIMD的关键基因,见图8。
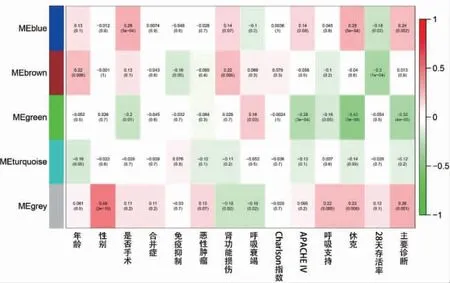
图7 脓毒症患者外周血差异基因与临床性状特征的关系
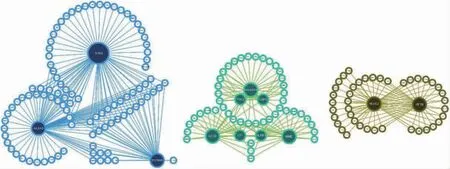
图8 脓毒症心肌功能障碍基因相互作用关系
2.5 SIMD 关键蛋白
共转化658 个蛋白,LTF、LCN2、SOCS3、ITGA4、TLR2、JAK2、FCER1G、ITGAM、IL1R1、CD74、CIITA、MMP9 为SIMD 的关键蛋白。见图9。

图9 脓毒症心肌功能障碍蛋白质-蛋白质相互作用网络
3 讨论
多个病理生理过程参与了脓毒症器官所致的损伤,免疫调节失衡是重要的机制之一[9-10]。通过基因富集分析发现,SIMD 差异基因同样集中在免疫的调控中,这些差异基因与患者的临床性状显著相关,提示免疫调节失衡是造成心肌损伤的主要原因[11-13]。
LCN2 和LTF 处于WGCNA 及PPI 网络的核心位置。LCN2 是脂质运载蛋白之一,其通过限制细菌增殖发挥先天性免疫作用,是巨噬细胞及中性粒细胞分化所必须的关键基因,具有调节免疫及预防器官功能损伤的作用[14-17]。LTF 在机体应激时可发挥免疫调节作用,其参与了NF-κB 和TLR4 等炎症信号通路的传导[18-20]。在脓毒症患者及动物模型中,LCN2 及LTF 在24 h 内显著升高,与脓毒症患者呼吸衰竭、APACH Ⅳ评分、休克等有着高度相关性,可能是SIMD 的关键标志物之一。ANXA3 及S100A8 同样参与炎症反应的调控,沉默前者可减轻炎症反应[21],而后者可改善脓毒症所导致的心肌重构,减轻心肌损伤[22-23]。KLHL2 则参与抗原加工呈递及先天性免疫系统过程[24-26]。
SOCS3 同样是调节免疫反应的重要基因之一,其接受多种细胞因子的刺激,发挥抑制免疫反应的作用[27-28]。一项死亡患者心肌组织的研究中发现,区别于扩张型心肌病及缺血性心肌病,SOCS3 在脓毒症患者心肌组织内呈高表达趋势,具有特异性[29]。而该基因在脓毒症外周血中具有同样趋势,可能有利于对SIMD的鉴别[30]。
综上所述,本研究联合研究多个SIMD 动物及脓毒症患者的转录组基因数据集,LCN2、LTF、ANXA3、S100A8、KLHL2、SOCS3 是SIMD 潜在的关键基因,在临床诊断、预后判断及治疗等方面具有重要意义。
