阿特匹林C生物合成与活性研究进展
2022-02-16李恩楷类成智朱登轩刘昱婷综述刘成伟审校
李恩楷,类成智,朱登轩,刘昱婷 综述 刘成伟 审校
东北林业大学生命科学学院,黑龙江 哈尔滨 150040
巴西绿蜂胶是蜜蜂从植物的树皮、芽等分泌液中收集到的一种类似树脂的营养物质,含有丰富的生物活性化合物[1],其中阿特匹林C(3,5-异戊烯基-4-羟基肉桂酸)是从巴西绿蜂胶中所提取出来的一种异戊烯基化香豆素类衍生物,具有抗肿瘤、免疫调节、促进脂肪代谢等多种生物活性。1998年KUMAZAWA等[2]通过观察巴西东南部卡瓦略波利斯市附近生活的蜜蜂行为,利用摄像设备,确定了蜜蜂采食的对象是酒神菊属的一种植物Baccharis dracunculifolia,并且通过液相色谱-质谱等方法验证了绿蜂胶和B.dracunculifolia的乙醇提取物色谱图高度相似,表明绿蜂胶的活性成分来自于蜜蜂所采食的植物。为阐明阿特匹林C的生物合成机制和生物活性,本文将对其相关研究结果进行综述。
1 生物合成
阿特匹林C的分子式为C19H24O3,相对分子质量为300.4 g/mol,分子结构如图1所示。目前,关于阿特匹林C的生物合成路径已经基本阐明[3-5]。其合成起始于葡萄糖,如图2所示,葡萄糖首先在体内通过糖酵解途径和磷酸戊糖途径分别合成磷酸烯醇式丙酮酸和赤藓糖-4-磷酸,之后在DAHP合成酶的作用下合成3-脱氧-D-阿拉伯庚酮糖酸-7-磷酸(DAHP),DAHP通过莽草酸途径合成酪氨酸和苯丙氨酸,前者可以在TAL基因编码的酪氨酸解氨酶的作用下直接脱去氨基合成对香豆酸。而后者则在PAL基因编码的苯丙氨酸解氨酶作用下发生消除反应,脱去氨基,形成肉桂酸。在C4H和CPR基因分别编码的香豆酸-4-羟化酶和细胞色素P450还原酶的协同下,在肉桂酸4号位发生羟基取代反应,合成对香豆酸。对香豆酸在AcPT1基因编码的异戊烯基转移酶的作用下,在碳3号位和5号位发生异戊烯基取代反应,生成阿特匹林C。其中只发生一次异戊烯基取代反应的化合物是Drupanin。异戊烯基供体的合成通常来自萜类化合物的合成途径,包括2-甲基赤藓醇磷酸途径和甲羟戊酸途径。阿特匹林C分子上的异戊烯基源于后者途径合成。2002年,UTO等[6]成功化学合成了阿特匹林C。2019年,MUNAKATA等[5]从菊科植物Artemisia capillaris中发现了异戊烯基化转移酶AcPT1,他们将编码该酶的AcPT1基因转入酵母,在加入底物对香豆酸的情况下,成功异源生产了阿特匹林C。
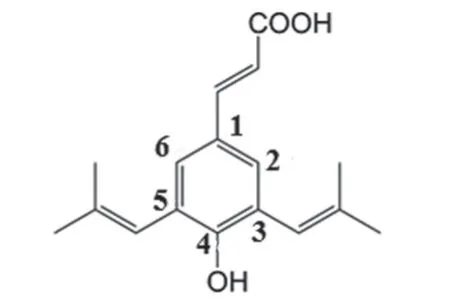
图1 阿替匹林C的分子结构

图2 阿特匹林C的生物合成途径
2 生物活性
2.1 抗肿瘤活性 众所周知,肿瘤是人类健康的最大杀手之一。世界卫生组织发布的世界癌症报告指出,2016年,全球有450万人死于肿瘤[7]。肿瘤能转移和存活的主要原因之一是通过诱导血管形成,进而从血液中获得生长所需的养分[8]。AHN等[9]在其研究中发现阿特匹林C可以通过减少VE-钙黏蛋白(VE-CAM)和血小板内皮细胞黏附分子(PECAM-1/CD31)的生成,抑制毛细血管的形成。同时,他们发现随着阿特匹林C浓度增大,人脐静脉内皮细胞的凋亡率依次升高,50µg/mL的阿特匹林C即可诱导53%人脐静脉内皮细胞凋亡,是对照组的2.8倍。Western Blot结果说明,阿特匹林C诱导抑制血管生成作用可能是阻断了细胞外调节蛋白激酶(ERK)信号转导通路,且激活了天冬氨酸特异性半胱氨酸蛋白酶-3(Caspase-3)来诱导人脐静脉内皮细胞凋亡。除了抑制血管形成,阿特匹林C对多种癌细胞有直接或间接的抑制作用。ENDO等[10]在研究中发现150µmol/L的阿特匹林C能够杀死75%以上的前列腺癌细胞,同时阿特匹林C可以显著的提高自噬活性物(LC3-Ⅱ)的表达水平,促进前列腺癌细胞自噬。阿特匹林C与自噬抑制剂联合作用将上调丝氨酸/苏氨酸蛋白激酶、受体相互作用蛋白激酶1(RIPK1)和3(RIPK3)的表达,诱导前列腺癌细胞坏死性凋亡。SHIMIZU等[11]通过对小鼠皮下注射氧化偶氮甲烷(AOM)诱导癌变,同时以10 mg/kg剂量饲喂小鼠阿特匹林C,培养28 d后进行检测,发现相比于对照组,癌前病变—结肠异常隐窝病灶(ACF)的发生率下降了43.4%。由于50%以上的结肠癌是由Rac蛋白突变引起,这种突变导致P21激活激酶1(PAK1)的异常激活[11]。MESSERLI等[12]进一步研究推测阿特匹林C抑制肿瘤生长的机制可能是通过阻止PAK1在141位丝氨酸的自动磷酸化,进而阻止Rac蛋白所诱导的PAK1活化,使肿瘤的生长受到抑制。除此之外,PAK1也在免疫抑制和肺纤维化中起作用[13],阿特匹林C对PAK1活化的抑制作用以及其抗炎活性可以让它有潜力用于冠状病毒引起的疾病如新型冠状病毒肺炎(COVID-19)的治疗[3]。KOBAL等[14]在研究中发现阿特匹林C对口咽癌细胞的生长有显著抑制作用,157µmol/L的浓度即可使50%的口咽癌细胞细胞生长受到抑制。其机理可能是由于阿特匹林C通过和二棕榈酰磷脂酰丝氨酸(DPPS)以及二棕榈酰磷脂酰胆碱(DPPC)相互作用,诱导巨型磷脂囊泡(GUV)的聚集,改变细胞膜的通透性,导致细胞坏死。PANG等[15]发现阿特匹林C对人口腔鳞癌细胞有显著抑制作用,50µmol/L阿特匹林C处理24 h,体系中生存素蛋白的含量下降超过55%,200µmol/L处理24 h,则体系中生存素蛋白的含量下降超过80%。他们还发现除了影响生存素含量外,阿特匹林C对癌细胞的抑制作用还与促进释放细胞凋亡的酶有关。SOUZA等[16]及其团队发现阿特匹林C对所有的宫颈癌细胞株都有明显的细胞毒性。细胞内源性凋亡存在两个明显现象:一是线粒体膜电位的降低,这将抑制凋亡因子从胞浆中降解;二是脂质过氧化的发生,这将导致细胞不饱和脂质结构的损伤。实验结果显示体系中存在阿特匹林C情况下,各个宫颈癌细胞株线粒体膜电位显著降低、脂质过氧化水平显著提高。海拉细胞系在72 h的处理下,仅9µmol/L的阿特匹林C处理即可抑制半数海拉细胞系(HeLa)的生长,证明阿特匹林C可以通过诱导细胞内源性凋亡的方式抑制宫颈癌细胞的生长。KIMOTO等[17]和AKAO等[18]发现阿特匹林C对T、B淋巴细胞、髓系、单核细胞等白血病细胞株有显著的细胞毒或诱导凋亡作用[17-18]。其中对粒细胞系和T淋巴细胞系的抑制作用显著,51.6µmol/L浓度的阿特匹林C处理即可抑制半数人急性早幼粒白血病细胞(HL-60)的生长[18]。在电镜下可以观测到各种肿瘤细胞出现凋亡小体和DNA片段化,而正常的T淋巴细胞则无此现象[17],这说明白血病细胞DNA合成受到明显抑制,而正常T淋巴细胞则受抑制有限,证明阿特匹林C对白血病细胞尤其是粒细胞系和T淋巴细胞系存在明显的生长抑制作用。综上所述,阿特匹林C可以通过不同机制对广谱癌细胞的生长产生抑制作用(表1),这为抗癌药物研发提供了候补天然产物。

表1 阿特匹林C的抗肿瘤活性
2.2 免疫调节活性 阿特匹林C在适应性免疫调节方面表现出良好的作用。CHEUNG等[19]通过羧基荧光素二醋酸盐琥珀酰亚胺酯染色法(CFSE)和流式细胞仪确定了阿特匹林C能抑制CD4阳性细胞的活化与增殖,并抑制释放白细胞介素(IL)、干扰素(IFN)等细胞因子,降低免疫排斥的发生。一旦清除体系中的阿特匹林C,抑制作用迅速消失,细胞重新开始活化增殖,这表明阿特匹林C的抑制作用是可逆的,可以利用其在器官移植方面单独或作为辅助药物以达到减少免疫排斥的目的。KIMOTO等[20]发现,通过阿特匹林C处理的体系CD4阳性与CD8阳性细胞数的比值和辅助T细胞总数也都有增加,这些发现表明阿特匹林C能调节适应性免疫。在固有性免疫调节方面,阿特匹林C也能发挥重要作用。研究采用角叉菜胶诱导的小鼠炎症模型,观察阿特匹林C的抗炎作用,角叉菜胶能诱导前列腺素E2的分泌,导致白细胞的聚集与炎症的发生[21-22]。在10 mg/kg的阿特匹林C剂量的预先注射下,再在小鼠足部注射角叉菜胶,结果显示,前列腺素E2的分泌下降了58%,白细胞数下降了近80%,这些结果说明了阿特匹林C有显著的固有性免疫调节活性。
2.3 脂肪代谢活性(图3) 肥胖是现代人常见的健康问题之一,1979—2016年,20岁以上的妇女肥胖数从0.7亿人增加到3.9亿,男性肥胖数从0.3亿增加到2.8亿[23]。肥胖是当人体摄入的热量大于消耗的热量时,多余的热量以脂肪尤其是甘油三酯的形式储存于体内的白色脂肪细胞中,使人体质量过度增长并有可能引起一系列生理疾病的过程。RICQUIER等[24]研究发现质子载体解偶联蛋白1(UCP1)是一种定位于米色脂肪细胞线粒体上的一种独特的膜蛋白,它在适应性产热中发挥作用。UCP1解开呼吸与ATP合成的偶联,使能量以热量形式耗散,促进脂肪酸的氧化水平的提高,增加机体的产热效应。除此之外,KAZAK等[25]发现了肌酸无效循环这一UCP1蛋白非依赖性的特殊产热方式,也有利于增加机体的产热。NISHIKAWA等[26]最初发现以10 mg/kg阿特匹林C的剂量饲喂小鼠后,小鼠的UCP1的mRNA表达量上升了近12倍,蛋白表达量也上升了近2.5倍,这说明阿特匹林C能促进脂肪代谢,增加机体产热效应。阿特匹林C还能延长PR结构域蛋白16(PRDM16)半衰期,这将诱导白色脂肪细胞转变为米色脂肪细胞。他们通过免疫印迹分析发现在10µmol/L阿特匹林C诱导分化的小鼠胚胎成纤维细胞(C3H10T1/2)中,PRDM16的含量明显上升,这说明阿特匹林C能诱导前体细胞向米色脂肪细胞分化。阿特匹林C还作为过氧化物酶体增殖物激活受体γ(PPARγ)的激动剂,可以通过提升PPARγ转录水平的方式上调其下游基因如脂联素的表达,增加细胞对胰岛素的敏感性从而促进细胞对脂肪酸以及甘油三酯的氧化,缓解因浸润脂肪组织的巨噬细胞释放肿瘤坏死因子-α(TNF-α)诱导的脂联素表达下调造成的脂肪细胞功能障碍[27-28]。NISHIKAWA等[29]的进一步研究也发现阿特匹林C还可以增加4种脂肪代谢相关蛋白的表达:一是胍基乙酸甲基转移酶(GATM),它是肌酸生物合成的限速酶,催化甘氨酸和精氨酸合成胍基乙酸;二是线粒体甘氨酸咪基转移酶(GAMT),它将胍基乙酸合成为肌酸;三是线粒体肌酸激酶2(CKMT2),它能磷酸化线粒体中的肌酸,增强肌酸无效循环的活性;四是肌酸转运蛋白(CrT),它能协助肌酸向线粒体内的转运。这4种蛋白的表达上调能加强米色脂肪细胞中的肌酸无效循环的产热作用,消耗过多的脂肪以治疗肥胖。

图3 阿特匹林C的脂肪代谢活性
2.4 其他生物学活性 利什曼原虫是一种严重损害人类健康的单细胞寄生生物,其寄生在巨噬细胞内[30]。若其侵犯内脏,则引起黑热病;若其侵犯皮肤,则引起皮肤利什曼病[31]。ARRUDA等[32]通过实验验证了阿特匹林C具有抗利什曼原虫活性。在浓度为17.46µmol/L时即可达到对50%利什曼原虫的抑制作用,并随着浓度的上升,抑制作用逐渐增强。同时,在200~400µmol/L的浓度下即可抑制大部分常见细菌的生长[22],这些说明阿特匹林C有显著抗菌抗利什曼原虫活性。胃溃疡是一种常见并且危害性大的疾病,它是由于各种攻击因子使胃黏膜受损害所致[32]。胃酸分泌异常、非甾体抗炎药、幽门螺杆菌感染等都是诱导胃溃疡发生的关键攻击因子[33]。目前PHILIPE等[34]通过实验证实了阿特匹林C的胃黏膜保护活性。乙醇-盐酸混合剂能削减胃黏膜的防御机制,诱发胃溃疡,此法通常作为研究胃溃疡的模型[35]。在喂食小鼠不同剂量阿特匹林C后,利用乙醇-盐酸混合剂处理小鼠,实验结果显示,在阿特匹林C剂量达到3 mg/kg时,与对照组相比胃溃疡面积下降近90%,超越了甘珀酸的疗效,这证明了阿特匹林C的良好抗溃疡活性。阿尔茨海默病和帕金森病是目前老年人的常见神经退行性疾病,GILGUN等[36]在2001年发现该疾病的产生与氧化应激有关。由于神经细胞外高浓度的谷氨酸或爱拉斯汀(erastin)会阻止胱氨酸的进入,使细胞内谷胱甘肽水平降低以及细胞内活性氧和脂质过氧化物的生成增加,导致神经元的凋亡[37]。而MADOKA等[38]在其研究中发现在分别使用高浓度谷氨酸和erastin的作用下,空白对照组的神经细胞存活率均低于25%,而加入10μmol/L的阿特匹林C的实验组神经细胞存活率则接近95%。神经细胞存活率的显著升高说明阿特匹林C有优秀的神经细胞保护作用。
3 结语
综上所述,阿特匹林C是一种非常多能的“明星分子”。其在抗肿瘤、免疫调节,脂肪代谢等多方面都体现了非常强大的活性,在各种药物研发上发挥了重要作用。同时,阿特匹林C也许还有更多的生物活性等待探明。但目前阿特匹林C的产量仍然很低,价格也极为昂贵,这限制阿特匹林C药理学研究和应用。大量生产阿特匹林C是解决此问题的重要方法。直接从巴西绿蜂胶中进行提取成本太高,而在酵母中的异源生产量仍然不理想,且副产物多,因此研究者正在通过基因工程的方法提高产量。倘若能大量生产,阿特匹林C在未来有望更广泛地应用于研究与临床,为人类的疾病治疗做出贡献。
