肾缺血再灌注损伤小鼠肾内纤维化和胆绿素还原酶阳性巨噬细胞增加
2022-02-15胡芝芝裴广畅曾锐徐钢
胡芝芝,裴广畅,曾锐*,徐钢
(华中科技大学同济医学院附属同济医院肾内科,武汉430030)
胆绿素还原酶(biliverdin reductase, BVR)是在亚铁血红素代谢途径中将胆绿素转化成胆红素的一种酶,分为BVR-A和BVR-B两个亚型。两个亚型都能够产生胆红素,只有BVR-A能够降低胆绿素转化成抗氧化分子胆红素[1]。BVR以二聚体形式结合在DNA上,核定位信号和核输出信号具备一致性,以便BVR将活化信号ERK1/2进行传递[2]。作为亮氨酸-拉链样转录因子,BVR结合到Ap-1位点,可以激活HO-1启动子转录,也可以抑制tlr4基因表达[3]。另外,BVR还具有丝氨酸/苏氨酸激酶和酪氨酸激酶活性,可以激活IGF-1和MARK途径[1]。在神经元中敲除BVR可以导致活性氧(reactive oxygen species,ROS)水平升高,降低神经元活性,增加caspase活性和促进凋亡[3]。我们的前期研究证实BVR能够利用酪氨酸蛋白激酶活性,激活PI3K/Akt信号途径,参与缺氧诱导的肾小管上皮细胞EMT过程[4]。
巨噬细胞既是免疫效应细胞也是抗原呈递细胞,具有连接天然免疫和获得性免疫的作用。巨噬细胞可以分为M1亚型(经典激活)和M2亚型(选择激活)巨噬细胞。在不同的环境中,巨噬细胞可以分化成不同亚型,呈现表型的异质性和多样性,发挥促炎和抗炎两种截然不同的作用。在急性肾损伤早期,巨噬细胞参与组织损伤,在随后的慢性修复期,巨噬细胞则呈现组织修复和促进纤维化的双重作用[5-7]。在缺血再灌注损伤模型中,通过注射氯膦酸盐脂质体清除巨噬细胞后,发现肾巨噬细胞浸润减少和纤维化减轻[8]。
肾小管间质纤维化是慢性肾病发生发展过程中重要病理特征,而肾间质巨噬细胞浸润与肾损伤密切相关[9]。在RAW264.7巨噬细胞中,胆绿素(biliverdin, BV)刺激可以抑制TLR4的表达和促炎因子的释放,稳定敲除BVR则导致TLR4和TNF-α表达升高[10],由此提示BVR阳性巨噬细胞可能调节肾脏纤维化,参与肾纤维化病变过程。本文利用肾缺血再灌注损伤模型,检测肾缺血再灌注损伤时肾组织中BVR的表达与巨噬细胞的关系。
材料与方法
1 动物及主要试剂
16只体重20~25 g C57BL/6雄性小鼠购于北京华阜康公司;兔抗小鼠BVR多克隆抗体购自美国Stressgen公司;兔抗小鼠α-SMA多克隆抗体、兔抗小鼠collagen I 多克隆抗体、大鼠抗小鼠F4/80多克隆抗体购自英国Abcam公司;兔抗小鼠 CD45-precp-cy5.5 抗体、兔抗小鼠 F4/80-PE 抗体、兔抗小鼠 CD11b-APC 抗体购自eBioscience公司;Alexa Fluor488标记的山羊抗兔IgG、Cy3标记的山羊抗大鼠IgG和DAPI染色剂均购自碧云天公司;RT-PCR引物由美国Invitrogen公司合成,Trizol试剂购于美国Invitrogen公司;免疫组织化学试剂盒、生物素标记二抗和DAB显色液购于上海基因科技公司;反转录试剂盒购于美国Promega公司,PCR试剂盒购于德国Qiagen公司。
2 主要仪器
正置显微镜(CX23,Olympus),激光扫描共聚焦显微镜(FV3000,Olympus),RT-PCR仪(Roche LightCycler 480),流式细胞仪(FACSCanto II,BD)。
3 动物分组与模型建立
16只 C57BL/6雄性小鼠随机分成假手术组(Sham组)和肾缺血再灌注模型组(IRI组)2组,每组8只小鼠。以1%戊巴比妥钠腹腔注射麻醉(0.2 mL/100g)模型组小鼠,背部备皮,消毒,行背部正中切口,暴露左侧肾脏,分离肾包膜,夹闭左侧肾蒂30 min。30 min后松开动脉夹,缝合皮肤及组织。
4 标本留取
Sham组、IRI组小鼠常规饲养5 d、10 d后,经小鼠眼内眦静脉取血,取手术侧肾脏称重,用生理盐水灌洗肾脏,至肾脏发白,留取1/4肾脏固定于4%多聚甲醛,用于制备石蜡切片,留取1/4肾脏行流式细胞术,其余组织-80 ℃保存。
5 组织化学染色
模型制作5 d和10 d后处死Sham组和IRI组小鼠,取新鲜肾,去除包膜,以4%多聚甲醛固定24 h,常规石蜡包埋,3 μm 切片,进行过苏木素-伊红(HE) 染色、Masson三色法染色和天狼星红(Sirius Red)染色。光镜下观察肾小球硬化及间质损害程度。
6 免疫组织化学染色
SABC法免疫组织化学染色:新鲜肾去除包膜后,以4%多聚甲醛固定24 h,常规石蜡包埋,3 μm切片,60 ℃烤片30 min,脱蜡、水化,PBS漂洗,0.3%过氧化氢-甲醇室温孵育15 min,PBS洗 3 次。将切片浸泡于含枸橼酸缓冲液的抗原修复盒中,微波炉高火5 min,中火15 min 后自然晾干,PBS 洗3次。以含10%胎牛血清的PBS 37 ℃封闭30 min。以兔抗鼠α-SMA(1∶ 200)、 兔抗鼠 PDGFR-β(1∶200)、兔抗鼠collagen IV(1∶200)4 ℃过夜,再37 ℃孵育30 min,PBS洗3次。加入生物素标记的二抗(1∶200)室温 1h ,用 PBS 洗5min;以辣根过氧化物酶标记链霉卵白素工作液 37℃孵育 30 min,PBS洗3次,DAB显色,蒸馏水洗3次。苏木素复染,中性树胶封片,显微镜下观察,照相。
免疫荧光双重染色:脱蜡、入水后的切片以含10%胎牛血清的PBS 37 ℃封闭30 min,分别以兔抗小鼠BVR抗体(1∶300稀释于封闭液中)、大鼠抗小鼠F4/80多克隆抗体(1∶50稀释于封闭液中)4℃过夜,再37℃孵育30 min,PBS洗3次。分别以Alexa Fluor488标记的山羊抗兔IgG抗体、Cy3标记的山羊抗大鼠IgG抗体37℃孵育30 min,PBS洗3次;滴加DAPI避光孵育5 min,进行核复染,用PBS浸洗多余的DAPI,荧光保护剂封片,共聚焦荧光显微镜下观察、拍照,Alexa Fluor488绿色荧光指示F4/80定位,Cy3红色荧光为BVR定位,蓝色荧光为细胞核。Alexa Fluor488 的吸收峰是495 nm,发射峰是519 nm,Cy3的吸收峰是550 nm,发射峰是570 nm。
7 定量 RT-PCR
按Trizol试剂说明书提取肾组织总RNA,用分光光度计检测RNA纯度与浓度,然后使用反转录试剂盒(美国Promega)进行逆转录,根据试剂说明书(德国Qiagen)及预实验确定的反应时间与温度进行RT-PCR扩增。总反应体系25 μL,PCR反应条件:多聚酶活化 95 ℃ 5 min,95 ℃10 s,60 ℃ 20 s,40个循环。循环结束后,建立熔解曲线,以检验扩增的特异性。循环阈值用内源性GAPDH来校正。目的基因mRNA的相对表达量=2△△Ct。Ct是荧光达到荧光阈值的循环数;△△Ct=(Ct目的基因-Ct管家基因)实验组- (Ct目的基因-Ct管家基因)对照组。引物序列见表1。

表1 RT-PCR引物序列Tab.1 RT-PCR primer sequences
8 流式细胞术
手术后5 d、10 d分别取小鼠的眼部内眦静脉血液100 μL,取小鼠手术侧肾脏,剪碎;加入胶原酶,37 ℃ 消化 60 min; 将悬液依次通过 70 μm 和40 μm 尼龙筛滤过;2000 r/min 离心5 min,去上清;剪开股骨和胫骨的骨骺,暴露髓腔,5 mL注射器吸取PBS,冲洗骨髓腔,直至骨骼颜色变为苍白;收集悬液,充分吹打混匀以吹散细胞团块,200目过滤,1000 r/min×10 min,弃上清;用无菌红细胞裂解液3 mL裂解3 min,PBS洗2遍,细胞离心弃上清,100 μL PBS重悬细胞。BVR流式细胞学需用间接荧光法标记,先用兔抗小鼠的BVR抗体37 ℃孵育1 h,PBS洗2遍离心去上清,100 μL PBS重悬,然后加入兔抗小鼠的FITC二抗孵育30 min;CD45, F4/8,CD11b流式细胞学使用直接标记法,直接在PBS重悬细胞中加入抗小鼠CD45-precp-cy5.5抗体、抗小鼠F4/80-PE抗体、抗小鼠CD11b-APC孵育30 min,上机检测。细胞先以FSC和SSC的散点图圈定细胞大小,再从CD45的散点图中把F4/80和CD11b细胞圈出,随后继续在F4/80和CD11b的散点图中把BVR阳性的细胞团圈出,确定CD45+F4/80+CD11b+BVR+细胞占全部细胞的百分比。
9 统计学分析
应用SPSS18.0统计软件进行分析,计数资料数据以百分数表示,采用卡方检验;计量资料数据以均数±标准差(±s)表示,采用t检验,P<0.05为有统计学意义。
结 果
1 缺血再灌注损伤肾组织纤维化明显
HE染色结果显示,与Sham组相比,IRI组肾组织损伤明显,肾小球硬化明显,系膜细胞增生,肾小管管腔扩张,小管上皮细胞肿胀或发生空泡变性、细胞脱落、基膜裸露;Masson染色显示IRI组肾间质胶原染色范围明显增大;天狼星红染色显示,IRI组显示肾间质胶原明显增加(图1)。

图1 肾缺血再灌注小鼠肾组织病理学改变的HE、Masson和天狼星红染色检测。比例尺,100 μmFig.1 HE, Masson and Sirius Red staining examination of pathological changes in the mouse kidneys with renal ischemia/reperfusion.Scale bar, 100 μm
2 缺血再灌注损伤肾组织内纤维化蛋白免疫反应性增强
免疫组织化学染色显示,α-SMA主要表达于肾小管间质中,肾小管上皮细胞胞质中也有少许表达;PDGFR-β和collagen IV主要表达于肾小管间质中。与Sham组相比,缺血再灌注小鼠肾组织中α-SMA、PDGFR-β和collagen IV等纤维化蛋白免疫反应性明显增强(图2)。
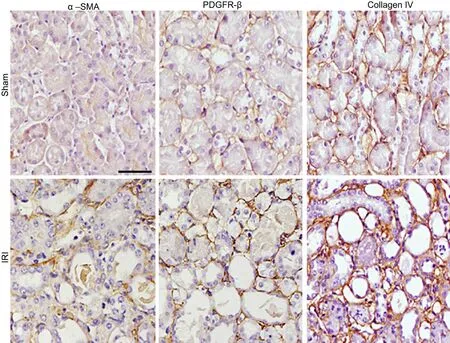
图2 肾缺血再灌注小鼠肾脏组织α-SMA、PDGFR-β和collagen IV表达变化的免疫组织化学检测。比例尺,100 μmFig.2 Immunohistochemical examination for expression changes of α-SMA, PDGFR-β and collagen IV in the mouse kidneys with renal ischemia/reperfusion.Scale bar, 100 µm
3 缺血再灌注损伤小鼠肾组织内纤维化蛋白和肾损伤蛋白mRNA表达增加
荧光定量RT-PCR检测显示,在缺血再灌注模型中,α-SMA、fibronectin、collagen I和KIM-1的mRNA表达明显增加,其中,α-SMA mRNA水平是对照组的8倍,fibronectin mRNA水平是对照组的40倍,collagen I mRNA水平是对照组的43倍,反映肾损伤的蛋白KIM-1 的mRNA水平是对照组的2000倍(图3)。

图3 肾缺血再灌注小鼠肾组织α-SMA、Fibronectin(FN)、collagen I、KIM-1 mRNA表达变化的定量RT-PCR检测。*P<0.05,**P<0.01,***P<0.001;n=8Fig.3 qRT-PCR analysis for the mRNA expression of α-SMA, fibronectin, collagen I and KIM-1 in the mouse kidneys with renal ischemia/reperfusion.*P<0.05,**P<0.01,***P<0.001;n=8
4 肾缺血再灌注损伤小鼠BVR阳性的巨噬细胞表达增加
手术后第5 d和第10 d取小鼠内眦静脉血、小鼠手术侧肾脏、小鼠股骨和胫骨骨髓进行流式细胞术分析显示,Sham组血液中BVR阳性巨噬细胞(CD45+F4/80+CD11b+BVR+)占 4.79%±0.65%,IRI手术组术后5 d血液中BVR阳性巨噬细胞(CD45+F4/80+CD11b+BVR+) 占 6.73%±0.55%,IRI手术组术后10 d血液中BVR阳性巨噬细胞(CD45+F4/80+CD11b+BVR+)占 11.92%±1.05%,即缺血再灌注小鼠血液中BVR阳性巨噬细胞(CD45+F4/80+CD11b+BVR+)表达明显增加。Sham组肾脏组织中BVR阳性巨噬细胞(CD45+F4/80+CD-11b+BVR+)占1.05%±0.1%,IRI手术组术后5 d肾脏组织中BVR阳性巨噬细胞(CD45+F4/80+CD11b+BVR+)占1.17%±0.21%;IRI手术组术后10 d肾脏组织中BVR阳性巨噬细胞(CD45+F4/80+CD11b+B-VR+)占4.81%±0.55%,即缺血再灌注小鼠肾脏中BVR阳性巨噬细胞(CD45+F4/80+CD11b+BVR+)表达明显增加;Sham组骨髓中BVR阳性巨噬细胞 (CD45+F4/80+CD11b+BVR+)占 29.2%±0.78%,IRI手术组术后5 d骨髓中BVR阳性巨噬细胞(CD45+F4/80+CD11b+BVR+)占 33.76%±1.77%,IRI手术组术后10 d骨髓中BVR阳性巨噬细胞(CD45+F4/80+CD11b+BVR+)占 21.14%±0.32%,即缺血再灌注小鼠骨髓中BVR阳性巨噬细胞(CD45+F4/80+CD11b+BVR+)表达明显增加。
5 缺血再灌注损伤肾组织中BVR阳性巨噬细胞增加
免疫荧光双标监测显示:Sham组肾组织中BVR+F4/80+细胞(BVR阳性巨噬细胞)极少,而缺血再灌注损伤5 d小鼠肾组织中BVR+F4/80+细胞明显增加(图5)。

图5 免疫双染荧光检测肾缺血再灌注损伤小鼠肾组织BVR阳性巨噬细胞表达。IRI,缺血再灌注损伤5 d小鼠肾组织;绿色荧光,F4/80阳性免疫染色;红色荧光示BVR阳性免疫染色;箭头,BVR+F4/80+双标细胞。比例尺,100 μmFig.5 Double immunofluorescence staining for detection of expression of BVR positive macrophages in the kidney tissues of the mice with renal ischemia/reperfusion injury.IRI,renal tissue of mice with ischemia reperfusion injury for 5 days; green, F4/80 positive immunostaining; red, BVR positive immuniostaining; arrow head, BVR+F4/80+ double staining cell.Scale bar, 100 μm
讨 论
缺血再灌注损伤是指组织或者器官在缺血后重获血流灌注或氧供后造成的损伤[11]。肾脏是血液供应非常丰富的器官,对缺血再灌注损伤尤其敏感,是影响急性肾功能损伤恢复程度的重要因素。因此如何保护肾脏免受缺血再灌注损伤具有重要的临床意义。近年的研究表明,肾脏间质病变较肾小球病变与慢性肾功能衰竭进展关系更为密切。目前发现肾脏纤维化的过程主要包括:①单核/巨噬细胞等炎症细胞浸润;②致纤维化的细胞因子表达上调;③由于基质蛋白合成增加和基质降解受到抑制的综合作用导致纤维化形成。多数学者认为,肾小管间质纤维化程度决定着慢性肾脏病患者的预后[12]。胆绿素还原酶(BVR)是胆红素抗氧化系统的重要组分,对氧化应激介导的疾病如自身免疫性脑脊髓炎和脑缺血,BVR能够上调,对抗氧自由基的损害[13-15]。
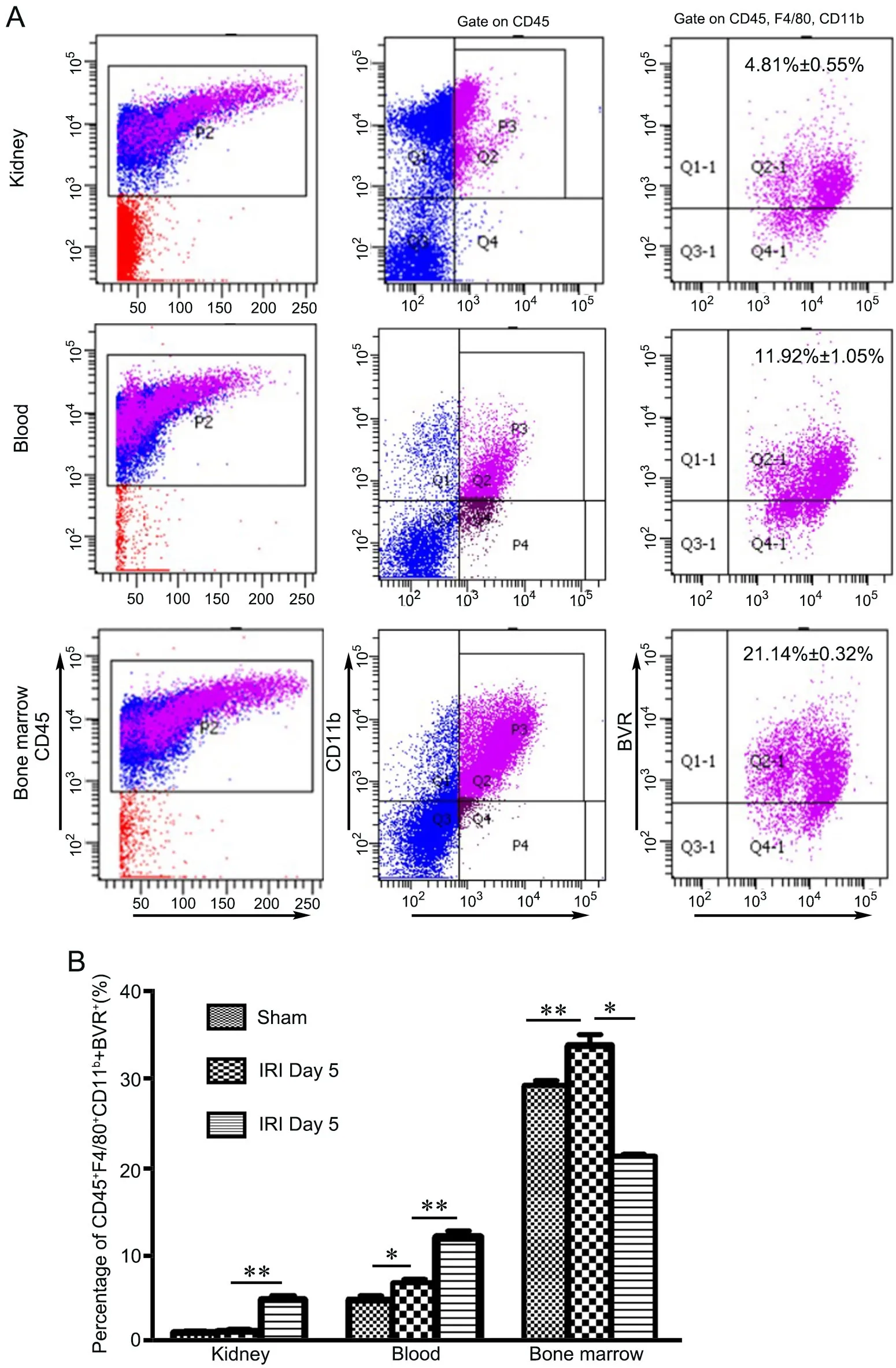
图4 肾缺血再灌注损伤小鼠肾、血液、骨髓中CD45+F4/80+CD11b+BVR+细胞变化的流式细胞术分析。*P<0.05,**P<0.01;n=4Fig.4 Flow cytometry analysis for the change of CD45+F4/80+CD11b+BVR+ cells in the kidney, blood, and bone marrow of the mice with renal ischemia/reperfusion.*P<0.05, **P<0.01; n=4
巨噬细胞在肾脏发育,各种急慢性肾损伤和修复以及肾移植排斥反应中都具有重要作用[16]。随着肾脏纤维化的加重,肾间质巨噬细胞浸润增加[17]。我们以前的研究表明,BVR主要表达在肾小管细胞胞质中[18],随着肾脏纤维化加重,肾小管中BVR表达增加[19,20];BVR通过GM-CSF,M-CSF和LPS刺激巨噬细胞参与调节IL-10的分泌[21]。在本研究中发现,在肾缺血再灌注模型中,肾组织内α-SMA、fibronectin、collagen I、PDGFR-β、collagen IV、BVR和KIM-1的表达明显升高,说明急性肾损伤时,肾脏纤维化和损伤都明显加重,BVR参与肾脏损伤的过程。同时,在小鼠血液、骨髓和肾脏组织中BVR免疫反应阳性巨噬细胞明显增多,说明在急性肾损伤时,血液、骨髓和肾脏组织中BVR免疫反应阳性巨噬细胞数量随着肾脏纤维化的加重而明显增加。因此,BVR阳性巨噬细胞广泛存在于肾、血液、骨髓等组织中,并积极参与肾脏纤维化的过程。本研究为进一步研究肾脏纤维化过程中巨噬细胞和BVR的作用及探索肾纤维化的治疗方法提供了重要思路。
