连香树花芽发育过程中的生理生化特性研究
2022-02-15段秋笛卢丽晶崔秀伟梁宏伟
段秋笛,杨 旭,赵 焱,卢丽晶,崔秀伟,梁宏伟,4
(1.三峡大学生物与制药学院,湖北 宜昌 443002;2.山东省济南市林业局,济南 250000;3.山东省济南农业科学院,济南 250000;4.三峡区域植物遗传与种质创新重点实验室(三峡大学)/三峡大学生物技术研究中心,湖北 宜昌 443002)
连香树(Cercidiphyllum japonicum)为温带落叶乔木,属连香树科连香树属。连香树为第三纪孑遗植物,间断分布在中国和日本等亚洲地区,对于研究第三纪植物区系起源以及中国与日本植物区系的关系有十分重要的科研价值[1]。连香树雌雄异株,植株结实率低,幼苗脆弱,容易受外界环境危害,难以生存,因此,在野外环境中种群年龄结构不稳定,资源稀少,濒临灭绝,是中国的二级保护植物[2]。连香树高大雄伟,叶形奇特似心形,春季新发嫩叶和秋季叶色彩绚丽,是具有高观赏价值的园林绿化树种[3]。
连香树的研究受到国内外学者的广泛关注。廖兴利等[4]研究了连香树对不同海拔梯度环境的适应能力。有外国学者研究发现连香树的物种多样性与海拔呈二次相关和负相关[5]。相关学者对连香树群落功能多样性的调查揭示了其功能多样性可作为濒危物种连香树保护效率的一个指标[6]。黄雪梅等[7]发现连香树叶片C、N、P 化学计量特征已呈现出一定的性别二态性,这可能与其物种濒危有关。马文宝等[8]调查了天然连香树种群性比并比较其雌、雄株之间的形态、光合能力、水分和养分利用效率差异,发现连香树种群性比显著偏雌,且该特性明显影响了连香树的天然繁殖。陈香波[3]对连香树野生群实地调查发现连香树群体年龄结构不合理,种群更新不良、面临退化的风险。皮琪[9]对连香树的适应性和繁殖特性研究表明,野生连香树呈零星分布且相距较远加剧了物种濒危程度。
现有相关研究表明,造成连香树天然繁殖困难的原因主要是其资源稀少、雌雄异株、结实较少。花器官是被子植物特有的在繁殖过程中产生的生殖器官,花芽分化发育是高等植物个体发育的中心环节,也是植物从营养生长转向生殖生长、繁衍后代的关键步骤[10]。植物的雌雄花芽发育是植物有性生殖过程的重要阶段,其发育好坏直接影响植物的授粉、受精和坐果[11]。可溶性糖和可溶性蛋白质等营养物质对植物花芽发育分化有重要作用[12],过氧化物酶(POD)和超氧化物歧化酶(SOD)是植物防止膜脂过氧化酶促防御体系中重要的保护酶[13]。同时POD、SOD 等酶的活性也是影响花芽发育分化的重要指标[14],而丙二醛则与植株抗逆性有关[15]。
本研究通过测量并分析连香树花芽发育过程中相关生理生化指标的变化和雌雄株之间生理生化指标差异,探究其在花芽发育过程中的生物学功能和意义,从而为连香树的有性繁殖提供有效的理论依据,对保护好这一珍稀濒危树种、保护生物多样性及连香树的可持续开发利用具有重要的现实意义。
1 材料与方法
1.1 材料
试验材料为采集于神农架地区7月末、10月中旬、12月末、次年3月初及3月末不同时期的连香树雌株和雄株的花芽,即分别对应连香树花芽发育的分化发育初期、分化完成期、休眠期、春季快速发育期及开花期,依次标记性别及时期,分别为S1、S2、S3、S4、S5,于-70 ℃条件下保存备用。
1.2 方法
试验于2020年7月至次年3月末进行,于野外采集连香树雌、雄花芽并立即液氮速冻保存。开展生理生化指标分析时,取等量的不同月份、不同性别的连香树花芽,分别置于预冷的研钵中,加入1 mL预冷pH 7.0 的0.05 mol/L PBS 缓冲液(0.05 mol/L 磷酸二氢钠40 mL+0.05 mol/L 磷酸二氢钾60 mL),在冰浴中充分研磨成匀浆。将匀浆液全部转入离心管中,12 000 r/min离心15 min。取上清液分装于1.5 mL带盖塑料离心管中,置于-20 ℃条件下保存备用。过氧化物酶活性采用愈创木酚法测定,超氧化物歧化酶活性采用氮蓝四唑法测定,可溶性蛋白质含量采用考马斯亮蓝G-250 法测定,可溶性糖含量采用蒽酮法测定,丙二醛含量测定采用2-硫代巴比妥酸(TBA)法[16,17]。
1.3 数据分析
使用分光光度计测定吸光度,利用Excel 2010、Origin 2018、SPSS Statistics 17.0 软件对数据进行分析处理。
2 结果与分析
2.1 连香树花芽发育过程中过氧化物酶活性的变化
由图1 可知,POD 活性在花芽发育过程中呈先上升再下降的趋势,各阶段差异显著,变化幅度较大。雌、雄花芽从S1 时期到S4 时期POD 活性整体增高,雄性花芽在S4 时期达到最高,POD 活性为44.23 U/(g·min·FW),参与植物体内多个代谢过程。雌性花芽的POD 活性在S3、S4 时期没有显著差异,花芽处于休眠期,POD 含量达到最高。S4 到S5 时期温度逐渐升高,雌、雄花芽代谢活动加强,POD 活性显著下降。

图1 连香树花芽发育过程中POD 活性变化
由单因素方差分析可得,雄性花芽POD 活性显著高于雌性花芽POD 活性。POD 能更好地保护花芽,有利于使繁殖水平处于较高水平,推测连香树雄花芽的分化比雌花芽分化需要更多的POD。
2.2 连香树花芽发育过程中超氧化物歧化酶活性的变化
由图2 可知,SOD 的活性在花芽发育过程中变化幅度较小,总体呈先缓慢下降再缓慢升高的趋势,含量均处于较高水平。其中,S3 时期雄性花芽和雌性花芽SOD 活性最低,雄性花芽SOD 活性仅为541.03 U/(g·h·FW),S3 时期花芽处于休眠状态,此时花芽细胞代谢作用较弱,自由基产生较少,SOD 活性较低。S1 到S2 时期,雌性花芽SOD 活性升高,花芽此时处于分化时期,代谢能力较强。S4 到S5 时期雌、雄花芽SOD 活性均明显上升,花芽度过休眠期,进入春季快速发育期和开花期,细胞代谢能力强,SOD 活性升高。

图2 花芽发育过程中SOD 活性变化
由单因素方差分析可知,雌、雄花芽的SOD 活性在S1 到S4 时期均有显著差异,在S5 时期没有显著差异,总体雌性花芽SOD 活性高于雄性花芽,推测雌性花芽代谢能力较强,连香树雌花芽的分化比雄花芽分化需要更多的SOD。
2.3 连香树花芽发育过程中可溶性蛋白质含量的变化
由图3 可知,在连香树雌、雄花芽形成过程中,可溶性蛋白质含量呈先轻微下降再上升再下降的变化过程。分化发育初期、分化完成期和休眠期花芽内可溶性蛋白质含量逐渐波动升高,雌、雄花芽中可溶性蛋白质含量在休眠期积累至最大值,分别为144.86、132.54 mg/g。表明该段时期连香树花芽中可溶性蛋白质合成活跃并逐渐积累,到休眠期含量积累达最大值,花芽准备越冬;而春季快速发育期和开花期花芽内可溶性蛋白质含量急剧下降,说明高含量的蛋白质可能有利于花芽的分化与形成。

图3 连香树花芽发育过程中可溶性蛋白质含量的变化
由单因素方差分析可知,分化发育初期和分化完成期雌株和雄株间可溶性蛋白质含量无显著性差异,而休眠期、春季快速发育期及开花期雌性花芽的可溶性蛋白质含量显著高于雄性,这可能与雌株和雄株间对环境适应的差异以及连香树天然繁殖困难的原因有关。
2.4 连香树花芽发育过程中可溶性糖含量的变化
由图4 可知,在连香树雌、雄花芽的形成过程中,可溶性糖含量在分化过程中均呈先上升再下降的趋势。连香树花芽分化发育初期及快速完成期可溶性糖合成活跃并逐渐积累,S3 时期可溶性糖含量达到最大值,在雌、雄花芽中分别为17.82、21.19 mg/g,花芽进入休眠期;而从休眠期到春季快速发育期及开花期花芽内可溶性糖含量急剧下降,说明连香树花芽在春季快速发育期和开花期可溶性糖的消耗量较大。

图4 连香树花芽发育过程中可溶性糖含量的变化
由单因素方差分析可知,分化发育初期及快速完成期连香树雌株可溶性糖含量显著高于雄株,而休眠期、春季快速发育期和开花期表明连香树可溶性糖含量雌株却显著低于雄株,表明在连香树春季快速发育期和开花期雌株可溶性糖的消耗高于雄株。
2.5 连香树花芽发育过程中丙二醛含量的变化
由图5 可知,连香树雌、雄花芽发育过程中丙二醛含量呈先增加再减少的趋势,雌性花芽丙二醛含量在S3 时期达到最大,为1.66 μmol/(g·FW),雄性花芽在S4 时期达到最大,为1.27 μmol/(g·FW),而在S5 时期雌、雄花芽丙二醛含量分别下降到1.40、0.93 μmol/(g·FW)。这可能是随着时间进入冬季,连香树花芽逐渐进入休眠期,丙二醛含量增加,进入3月,连香树花芽发育完成并进入开花期,丙二醛含量下降。表明丙二醛含量的变化可能与连香树的花芽分化过程的抗逆性有关。
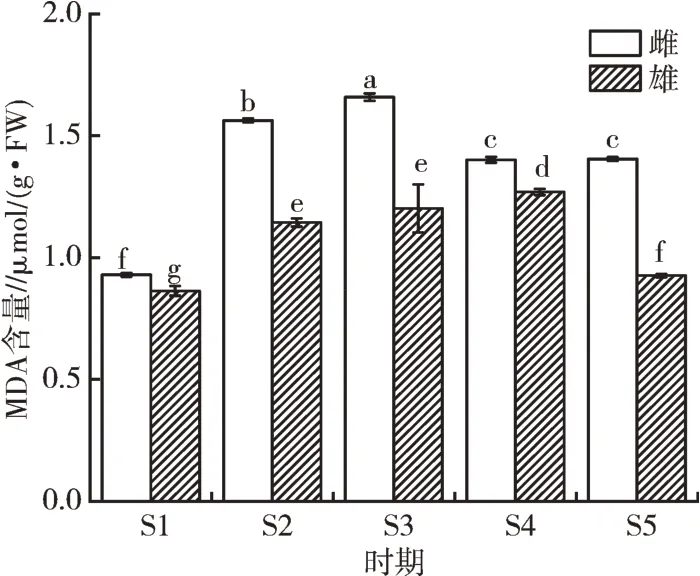
图5 连香树花芽发育过程中丙二醛含量的变化
由单因素方差分析可知,同一时期,连香树雌、雄花芽的丙二醛含量均有显著性差异,且雌性花芽丙二醛含量显著高于雄性花芽。出现这一现象的原因可能是在连香树雌、雄花芽发育过程中出现性别偏移,表明连香树雌、雄花芽在发育过程中对环境的抗逆性不同,推测连香树雌花芽分化比雄花芽分化需要更多的丙二醛。
3 小结与讨论
过氧化物酶与呼吸作用、光合作用等有关,其活性的不断变化,反映其水解过氧化物的程度[18]。雄性花芽POD 活性要高于雌性花芽POD 活性,这与温伟庆等[19]对银杏花芽研究相符。陶应时等[20]研究发现,连香树雌、雄个体的光合特性在生理和生态方面可能不同,雄性花芽的光合作用与呼吸作用可能强于雌性花芽。POD 被认为参与成花信号诱导因子乙烯的生物合成[21],POD 活性高时,参与雌、雄花芽的分化相关代谢,有助于花芽分化,并且高活性的POD 能有效清除过氧化物,维持细胞内氧自由基平衡,避免连香树花芽受到伤害[18]。
超氧化物歧化酶能够清除植物体内因代谢或其他行为而产生的自由基和活性氧,是一种重要的抗氧化剂,可清除细胞内产生的O2-生成H2O2,保护暴露在氧气中的细胞。雌性花芽SOD 活性高于雄性花芽SOD 活性,但是对于银杏与栝楼的研究中雄株的SOD 和POD 活性高于雌株[19,22]。高活性的SOD可维持细胞内氧自由基水平,保护花芽免受活性氧的毒害作用,有利于花蕊原基的分化[14]。
可溶性蛋白质在植物的生命活动中发挥着供能、免疫、控制生长分化等功能[23]。蛋白质影响着细胞的生长、分裂和分化,决定着植物的生长发育[24]。本试验中,连香树花芽分化发育初期、分化完成期可溶性蛋白质合成活跃并逐渐积累,当其含量达到最高值后花芽休眠,准备越冬并进行春化作用,表明高含量的可溶性蛋白质有利于花芽分化。连香树花芽在春季快速发育期及开花期可溶性蛋白质的消耗量大,表明可溶性蛋白质对细胞的分化与形成有重要作用。胡静等[14]对西红花花芽研究结果也验证了此观点。雌株花芽的可溶性蛋白质含量高于雄株,这可能与雌株和雄株对环境适应的差异有关。雌、雄异株植物种群性别间的偏倚可能直接影响种群的繁育[25],这可能与造成连香树天然繁殖困难的原因有关。
花芽内贮藏的营养物质可转化为花芽发育生长所需要的养分和能量[26]。可溶性糖是植物生长发育及性别分化的主要营养基础[27,28]。在本试验中,可溶性糖在连香树花芽中的含量呈先轻微下降再上升再下降的变化过程,表明在连香树花芽分化发育初期及分化完成期可溶性糖消耗与合成基本持平,随花芽的进一步发育,花芽中可溶性糖合成加快并逐渐积累,从而支持连香树花芽在春季快速发育期及开花期可溶性糖的大量消耗。与胡静等[14]对西红花研究中得出的可溶性糖含量可能限制花芽形成的结论相同。
丙二醛可对直接影响细胞膜上的各结合酶的数目比例和活性强弱,加剧膜脂过氧化,通常过量的丙二醛会使代谢失去调节作用,细胞则会失去正常的调节功能,因而会对细胞产生巨大的伤害[15,29]。陈丽丽等[30]对5 种植物进行升温处理发现,其叶片在升温过程中丙二醛含量均有所降低。李玉舒等[31]研究表明低温胁迫下木槿丙二醛含量上升。连香树雌性花芽在分化阶段丙二醛含量上升并在休眠期达到最高,其变化可能与温度降低有关,此时正值寒冬,连香树花芽受低温胁迫,故丙二醛含量上升。之后,丙二醛含量下降,可能与温度回升有关。
花芽分化是一个复杂的过程,分为形态分化和生理分化[31,32]。总体来看,连香树雌性花芽的超氧化物歧化酶活性、可溶性蛋白质和丙二醛含量显著高于雄性,表明连香树雌、雄花芽分化过程中出现性别偏移,这可能与连香树濒危有关。研究连香树雌、雄花芽分化过程中抗逆性指标的变化,可对连香树花芽分化过程有更好的了解,对于指导濒危物种的保护具有重要意义。
通过对连香树生理生化指标的综合分析,发现连香树花芽分化过程中雄性花芽总体POD 活性要高于雌性花芽总体POD 活性。花芽分化过程中POD 活性的变化可能是连香树花芽为了维持细胞中氧自由基浓度的平衡,保护花芽免受活性氧的毒害作用的一种响应。花芽发育过程中可溶性糖与可溶性蛋白质含量总是在花芽分化期前积累到最高值并在花芽分化期急剧下降,表明其含量可能与连香树花芽的发育形成具有密切相关性。不同时期雌性花芽的可溶性蛋白质、丙二醛含量均高于雄性花芽,这可能与连香树雌、雄花芽性别分化以及雌株和雄株间对环境适应的差异有关。
