采用体外染色体畸变试验检测锐钛型纳米二氧化钛的遗传毒性
2022-02-15杜秀明洪丽玲徐灵芝周庆云
杜秀明,洪丽玲,徐灵芝,周庆云,*
(1.上海化工研究院有限公司,上海 200062;2.上海化工院检测有限公司,上海 200062)
纳米二氧化钛亦称钛白粉,直径通常在100 nm以下,主要有两种结晶形态:锐钛型(anatase)和金红石型(rutile)。金红石型二氧化钛具有较高的硬度、密度、介电常数及折射率,其遮盖力和着色力也较高。锐钛型二氧化钛在可见光短波部分的反射率较高,并且对紫外线的吸收能力比金红石型低。在一定条件下,锐钛型二氧化钛可转化为金红石型二氧化钛。因其具有独特的物理化学性质而被广泛用于各种领域,包括油漆、化妆品和医药产品等,但其安全性一直是讨论的焦点[1]。在Ames试验、彗星试验、微核试验、染色体畸变试验和基因突变试验等系列遗传毒性试验中,它们的遗传毒性试验结果各不相同[2-3],体外和体内试验均有阳性和阴性结果的报道[4-5]。
一项体内研究表明,纳米二氧化钛在彗星试验和微核试验中可以诱导细胞微核的产生,并引起体细胞DNA缺失[6];而另一项体内研究却给出了阴性结果,原因可能是后者采用吸入染毒方式,导致内暴露浓度比前者低很多[7]。Shukla和Petkovic等[8-9]的体外研究表明,纳米二氧化钛可以诱导体外培养的细胞微核率升高,并引起体外培养细胞的DNA损伤。Guichard等[10]的体外研究则表明纳米二氧化钛不能引起叙利亚金仓鼠胚胎细胞微核率的升高。Wang等[11]的研究表明,在体外彗星试验和Hprt基因突变试验中,纳米二氧化钛未引起体外培养细胞的DNA损伤。
根据《OECD化学品测试准则473:体外哺乳动物染色体畸变测试》,采用中国仓鼠肺(Chinese hamster lung,CHL)细胞进行体外哺乳动物细胞染色体畸变试验是常用的生物测试体系之一,也是遗传毒性组合策略试验之一[12]。该试验可以确定和评价化学品引起体外培养的哺乳动物细胞染色体畸变的能力,从而判断受试物是否属于致突变物。染色体结构畸变可分为两种类型:一种是染色体类型畸变,表现为同一位点的两条染色单体的断裂或断裂重组;另一种是染色单体类型畸变,表现为染色单体的断裂或断裂重组。
我们前期的研究表明,锐钛型纳米二氧化钛未引起小鼠淋巴瘤细胞基因突变频率的升高,在基因突变试验中呈阴性结果[13]。此外,尚未见锐钛型纳米二氧化钛(40 nm)能否引起中国仓鼠肺细胞染色体畸变的相关报道。为了进一步验证锐钛型纳米二氧化钛的安全性,本研究通过体外染色体畸变试验来检测锐钛型纳米二氧化钛诱发遗传毒性的可能性,为纳米二氧化钛在化妆品及食品领域的安全使用提供依据。
1 材料与方法
1.1 主要试剂
锐钛型纳米二氧化钛购买于上海麦克林生物化学有限公司;ZEISS Merlin扫描电子显微镜用于表征纳米二氧化钛的颗粒;秋水仙碱、丝裂霉素C和环磷酰胺均购自Sigma公司;NADP-Na2和G-6-P-Na2购自北京阳光生物科技有限公司。
1.2 细胞培养
中国仓鼠肺细胞购于中国科学院上海生命科学研究所细胞库。采用RPMI-1640培养液,细胞培养于37℃、CO2体积分数为5%的培养箱中。
1.3 受试物浓度的选择
锐钛型纳米二氧化钛不溶于去离子水、二甲亚砜或其他溶剂,因此选择RPMI-1640(不含胎牛血清)作为制备混悬液的溶剂。将5个浓度(0.007 8、0.031 2、0.125、0.5和2 mg/mL)的锐钛型纳米二氧化钛混悬液超声处理10 min,然后用于测试细胞毒性。染毒24 h后根据各组细胞浓度计算细胞相对增殖率(relative increase in cell counts,RICC),确定体外染色体畸变试验的染毒浓度。
细胞相对增殖率=(处理组收获时的细胞总数-接种时细胞总数)/(溶剂对照组收获时的细胞总数-接种时细胞总数)×100%
细胞抑制率=1-细胞相对增殖率
1.4 染毒处理
将细胞悬液分别加入新的培养瓶内,每瓶CHL细胞数约为10×105个,再分别加入不同浓度(0.007 8、0.031 2、0.125、0.5和2 mg/mL)的锐钛型纳米二氧化钛混悬液或阳性参照物(丝裂霉素C或环磷酰胺)及0.5 mL的S9混合液(不加S9时,用培养基补足),补加完全培养基(含10%胎牛血清的培养液)至10 mL。
试验分为有代谢活化系统短时处理组(+S9,4 h)、无代谢活化系统短时处理组(-S9,4 h)和无代谢活化系统连续处理组(-S9,24 h)3种处理方式,每种处理方式均设溶剂对照组和阳性对照组,溶剂对照组加同体积的样品溶剂(RPMI-1640),阳性对照组加同体积的阳性物,所有组别均设2个平行。
1.5 染色体制备和镜检
收获细胞前,加入适量秋水仙素,培养大约3 h。然后弃上清液,用少量灭菌生理盐水洗涤2次,再用胰酶消化,离心,弃上清。细胞经低渗、预固定、固定后,每组制片2张。玻片经染色、封片后,进行镜检。每个浓度组观察300个背景清晰、分散良好、染色体收缩适中的中期分裂相细胞,镜检结束后进行数据汇总并统计分析。

1.6 统计分析
数据采用卡方检验对各组染色体畸变率进行统计学分析,P<0.05表示组间比较的差异具有统计学意义。
2 结果
2.1 纳米二氧化钛的粒径和细胞毒性
ZEISS Merlin扫描电子显微镜下锐钛型纳米二氧化钛的粒径约40 nm,如图1所示。

图1 锐钛型纳米二氧化钛粒径由ZEISS Merlin扫描电子显微镜表征
预试验确定锐钛型纳米二氧化钛在浓度为2 mg/mL时对CHL细胞的细胞毒性小于50%。依据OECD指导原则473,选择2 mg/mL作为最高测试浓度[14]。
细胞相对增殖率用于评估锐钛型纳米二氧化钛的细胞毒性,CHL细胞相对增殖率随锐钛型纳米二氧化钛浓度的升高而降低。锐钛型纳米二氧化钛在最高浓度为2 mg/mL时,(-S9,4 h)、(+S9,4 h)和(-S9,24 h)3种处理方式下的细胞相对增殖率分别为70.32%、72.33%和64.80%,具体见表1。所有染毒浓度组的细胞相对增殖率均超过50%,表明各组细胞抑制率低于50%。依据OECD指导原则473,试验选用的浓度适用于本研究。

表1 锐钛型纳米二氧化钛的细胞毒性试验结果
2.2 纳米二氧化钛的遗传毒性
各浓度组染色体畸变频率见表2。
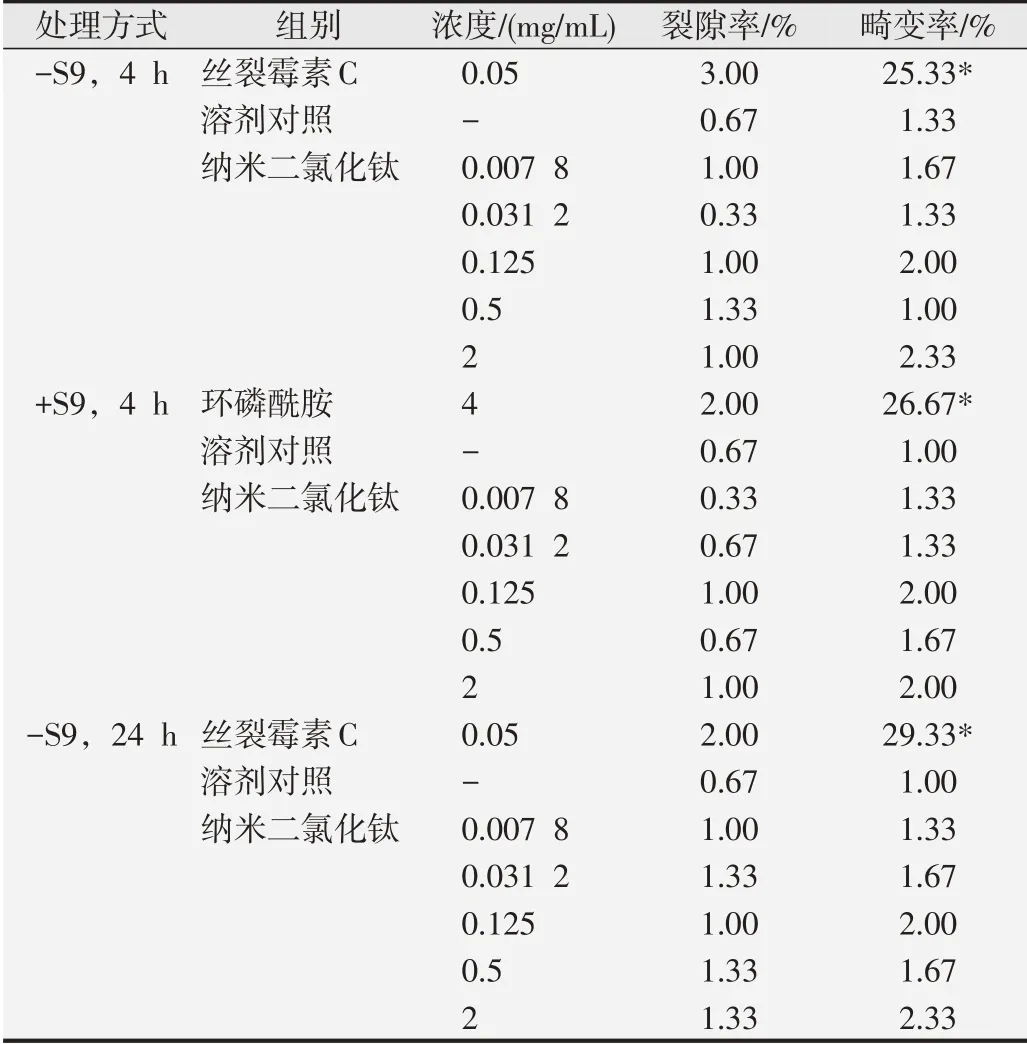
表2 锐钛型纳米二氧化钛的染色体畸变试验结果
试验样品在0.007 8、0.031 2、0.125、0.5和2 mg/mL浓度下,无代谢活化系统短时处理组(-S9,4 h)不含裂隙的染色体畸变率分别为1.67%、1.33%、2.00%、1.00%和2.33%,有代谢活化系统短时处理组(+S9,4 h)不含裂隙的染色体畸变率分别为1.33%、1.33%、2.00%、1.67%和2.00%,无代谢活化系统连续处理组(-S9,24 h)不含裂隙的染色体畸变率分别为1.33%、1.67%、2.00%、1.67%和2.33%,与溶剂对照组相比,差异均无统计学意义(P>0.05)。阳性对照组(-S9,4 h)、(+S9,4 h)和(-S9,24 h)3种处理方式下观察到不含裂隙的染色体畸变率分别为25.33%、26.67%及29.33%,与溶剂对照组相比差异有统计学意义(P<0.05)。油镜下观察的中期分裂相染色体形态如图2。

图2 油镜下观察的中期分裂相染色体形态
3 讨论
在有和无代谢活化系统处理条件下,各染毒浓度组锐钛型纳米二氧化钛在体外染色体畸变试验中均为阴性结果,表明锐钛型纳米二氧化钛在本测试浓度范围内,对CHL细胞染色体无致畸作用。
本研究结果与我们先前基因突变试验的研究结果一致[13]。Woodruff等[15]的研究也表明锐钛型纳米二氧化钛不会引起TK杂合子细胞DNA断裂或氧化性DNA损伤,也不会引起沙门氏菌菌株TA102、TA100、TA1537、TA98和TA1535明显的细菌回复突变。Warheit等[16]的研究也表明纳米二氧化钛在细菌回复突变试验和中国仓鼠卵巢细胞的体外哺乳动物细胞染色体畸变试验中呈阴性结果。一项长期致突变试验表明,即使纳米二氧化钛颗粒(80%锐钛型和20%金红石型的混合物)在肝脏中停留很长时间,对肝脏细胞仍无致突变作用[17]。Theogaraj等[18]的研究也表明锐钛型纳米二氧化钛和金红石型纳米二氧化钛对中国仓鼠卵巢细胞均无光遗传毒性,在接收紫外照射下也没有引起细胞染色体畸变频率的增加。马茂才等[19]的研究也表明锐钛型纳米二氧化钛不会引起沙门氏菌菌株TA97、TA198、TA100和TA102明显的细菌回复突变。然而,一些其他研究表明纳米二氧化钛具有遗传毒性,包括Di Virgilio等[20]发现中国仓鼠卵巢K1细胞中微核频率呈浓度依赖性增加。Lu等[21]也发现纳米二氧化钛可以引发同一细胞系中微核频率的增加。另一项研究表明,锐钛型纳米二氧化钛对大鼠有血液毒性,能够诱发体细胞遗传毒性并引起免疫毒性改变[22]。造成上述结果差异的原因可能有研究用生物测试体系不同、纳米二氧化钛晶体类型不同、纳米二氧化钛粒径大小不同以及染毒方式不同等。
综上所述,结合我们之前的研究,从基因和染色体水平分析,锐钛型纳米二氧化钛(40 nm)不能诱发体外培养的哺乳动物细胞染色体畸变和基因突变,不属于致突变物。此外,因判断物质是否属于致突变物的复杂性以及体外测试系统的局限性,还需进一步进行体内遗传毒性测试以确定锐钛型纳米二氧化钛是否具有遗传毒性。
