前处理对饮用水中隐孢子虫和贾第鞭毛虫检测回收率的影响
2022-02-14杨红力李洋
杨红力 李洋
(北京中职安康科技有限公司环境实验室 北京 101399)
隐孢子虫和贾第鞭毛虫(简称“两虫”)是一类寄生于人和动物体内的肠道原虫,是一类致病性原生寄生虫[1],主要通过饮用水和食物等途径传播[2]。人类饮用了含有这些原虫孢囊或卵囊的饮用水,有可能造成严重的肠胃疾病[1-3],且无特殊临床症状,无预防疫苗,绝大多数抗生素无效,治疗依赖于人体自身的抵抗力[1,4],严重影响公众的健康生活。美国早在1996 年就将“两虫”感染分别列入国家必须申报的传染病名单,并给出相应的检测方法[3-5]。我国在2006 年颁布的《生活饮用水卫生标准》(GB 5749-2006)中,也新增加了“两虫”的检测指标,并推荐了检测方法[6-7]。
目前,检测饮用水中的“两虫”主要采用免疫磁分离(IMS,Immunomagnetic Separation)技术,由美国环保总局(USEPA)发布推荐使用,是目前国际上最为常用的标准检测方法,即利用标记有与“两虫”孢囊和卵囊表面抗原特异性结合的抗体的磁珠与卵囊和孢囊相结合,从而实现“两虫”与杂质分离[8-9]。在检测过程中,有一个非常重要的质控指标——回收率[10-12],即定量的“两虫”孢囊和卵囊在经过整个检测流程后能够回收的孢囊和卵囊所占的百分率。回收率的高低是判断检测结果是否可信的重要指标,是水中“两虫”检测过程中主要的质控手段[13]。已有的研究表明,回收率的损耗主要在样品的前处理阶段[7,12-14]。水样的前处理包括定量抽滤、洗脱淘洗、离心浓缩、免疫磁分离等过程,不同的前处理阶段对回收率的影响有所差异[14]。以往的研究只是在整体上提出回收率主要损失在前处理阶段,如水质杂质、颗粒物、浑浊度、水温等[15-17],或者在分子层面另辟蹊径[18],并没有对前处理具体阶段的损失程度进行定量评估。本实验通过在各前处理阶段定量加标,分析回收率在不同前处理阶段对的损耗程度及所占比例,并提出“损失率”的概念,进而对回收率在各处理阶段的损耗进行定量化分析,以期为优化前处理过程、提高实验质量和检测结果可信度提供一定的实验基础。
1 材料与方法
1.1 仪器和设备
蠕动泵(Easyload 美国Masterflex);Filta-Max Xpress快速淘洗装置(美国IDEXX);离心机(DDSM 湘仪);样品混旋器(Dynabeads MX Mixer 美国invitrogen);磁极(MPC-1/MPC-S 挪威Dynal);荧光显微镜(BX53日本Olympus)。
1.2 试剂和耗材
免疫磁分离试剂盒(Dynabeads GC-Combo 挪威Dynal);免疫荧光染色试剂盒(EasyStain 澳大利亚BTF);质控标样(澳大利亚BTF);NaOH 溶液(1.0mol/L);HCl 溶液(0.1mol/L);PETT 淘洗缓冲液(现用现配);磷酸盐缓冲液(现用现配);DAPI 溶液(德国Sigma);Filta-Max Xpress滤器(美国IDEXX);锥形离心管(500mL);L型试管(10mL)。
1.3 加标微生物
“两虫”标样由澳大利亚Easyseed 提供,单次加标一剂,含有贾第鞭毛虫孢囊(100±1.7)个、隐孢子虫卵囊(100±1.6)个。
1.4 实验水样
样品来源:实验室超纯水(20L)。
1.5 实验方法
实验前处理方法采用目前《生活饮用水检测标准微生物指标》(GB/T 5750.12-2006)推荐的Filta-Max Xpress快速法,分析步骤如下。
(1)抽滤:蠕动泵抽滤水样,流速3L/min,样品量20L。
(2)淘洗:将压力淘洗装置准备就绪,缓冲液槽中加入足量淘洗缓冲液,将缓冲液槽与淘洗装置连接完毕,启动Filta-Max Xpress 快速淘洗装置,开始自动淘洗,取得淘洗液约450mL。
(3)离心:将取得的淘洗液放入低速离心机,2000G离心力离心15min,自然减速,虹吸法弃上清液,留取沉淀物约10mL,以超细玻璃吸管反复多次转移沉淀物至L型试管。
(4)免疫磁分离:在L 型试管中加入bufferA、bufferB、“两虫”特异性磁珠抗体,旋转结合至少1h,后以MPC-1 磁极收集磁珠,盐酸酸化,以MPC-S 磁极分离磁珠与样品;染色计数,EasyStain 试剂盒染色、DAPI溶液染色,封片,于荧光显微镜下观察计数。
为了定量分析前处理具体阶段的损失程度,进行以下实验处理。
实验1:全程序实验,20L实验室超纯水加标一剂,经过整个实验步骤,得出回收率,算出损失率,重复3次,空白对照1次。
实验2:去除抽滤富集步骤,直接在滤芯中加标一剂,继续剩余步骤,得出回收率,算出损失率,重复3次,空白对照1次。
实验3:去除抽滤和洗脱步骤,直接在锥形离心管中加标一剂,继续剩余步骤,得出回收率,算出损失率,重复3次,空白对照1次。
实验4:去除抽滤、洗脱、离心步骤,直接在L 型试管中加标一剂,继续剩余步骤,得出回收率,算出损失率,重复3次,空白对照1次。
实验5:直接一剂标样直接滴入载玻片内,染色镜检,得出回收率,算出损失率,重复3 次,空白对照2次。
实验过程中所用滤芯、载玻片均为一次性使用,使用锥形离心管和L 型试管为高压灭菌后使用。
2 结果
2.1 不同实验处理所得回收率检测结果
各实验均做3次平行及空白,结果见表1。
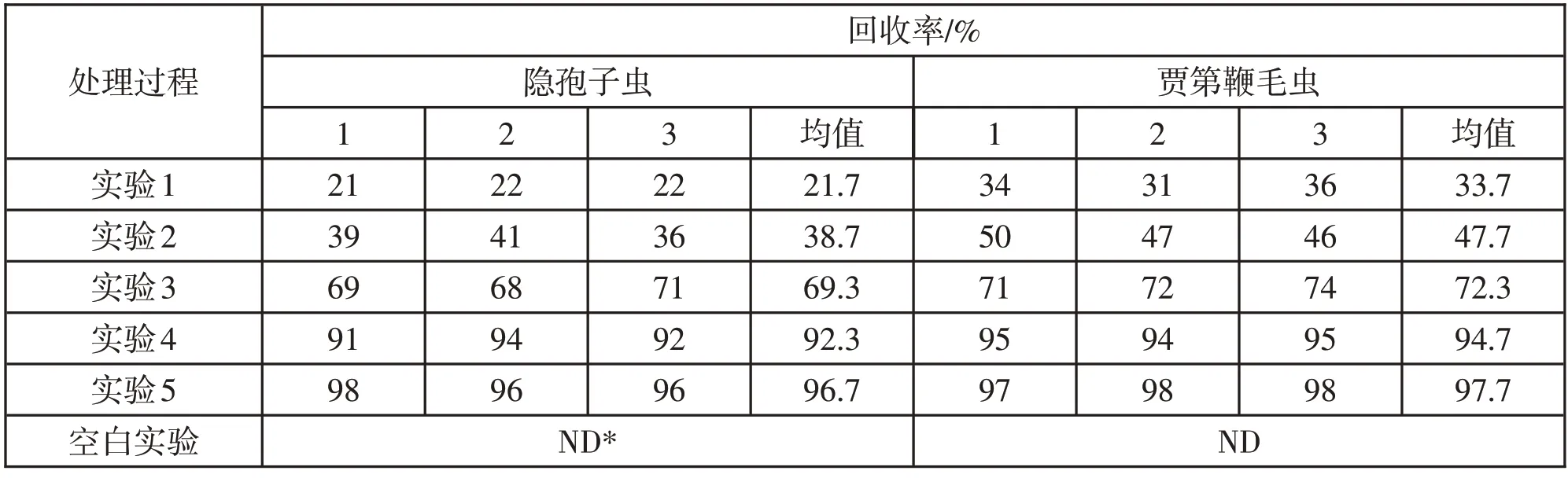
表1 实验各阶段“两虫”回收率结果
由实验结果可知,实验5 的回收率在所有处理中最高,达96.7%,其影响主要发生在染色镜检阶段;而实验4 的回收率为92.3%,其对应影响是免疫磁分离(IMS)阶段和染色镜检阶段,计算得知,此两步处理对回收率的影响较小,在5%以下;将实验4 与实验1 对比,即去除抽滤、洗脱、离心之后,可知,其回收率为69.3%,由超过30%的“两虫”孢囊和卵囊损失于这3个阶段。
2.2 不同实验处理所得损失率检测结果
为了更好地观察各处理阶段对隐孢子虫卵囊和贾第鞭毛虫孢囊回收的影响,本实验提出了一个新的统计指标——损失率,即不计实验偶然误差及过程偏差、以理想实验条件下的回收率100%,减去实际的回收率,得出损失率,以“两虫”实验损失率表示。
在已知回收率的基础上,测得各实验处理的“两虫”损失率,结果见表2、表3。
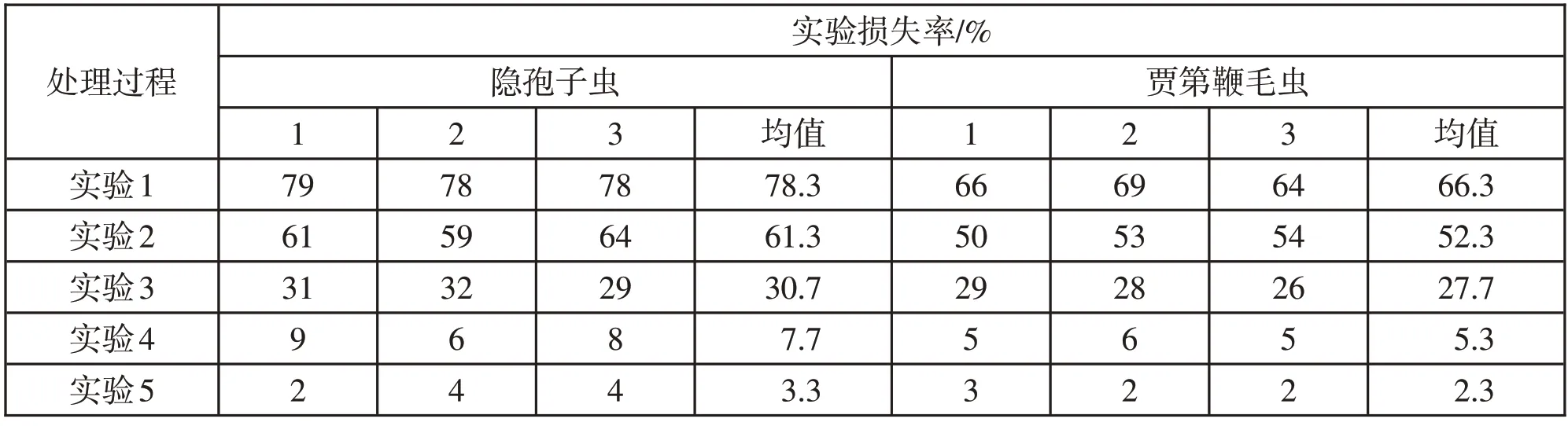
表2 实验各阶段“两虫”实验损失率结果

表3 实验各阶段“两虫”实验损失率所占比例
由结果可知,无论是隐孢子虫还是贾第鞭毛虫,实验损失率均集中在抽滤、洗脱、离心阶段,其中洗脱阶段最高,分别为30.7%、24.7%,其次是离心阶段,分别为23.0%、22.3%,然后是抽滤阶段,分别为17.0%、14.0%,所占比例见图1。
分析得出,实验各处理阶段对饮用水中“两虫”回收率的影响各不相同,其中洗脱处理阶段的影响最大所占比例最高。损失率主要集中在洗脱、离心、抽滤阶段。具体来讲,隐孢子虫在各处理阶段的损失率依次为:30.7%(洗脱淘洗);23.0%(离心浓缩);17.0%(定量抽滤);4.3%(免疫磁分离);3.3%(染色镜检)。贾第鞭毛虫的损失率依次为:24.7%(洗脱淘洗);22.3%(离心浓缩);14.0%(定量抽滤);3.0%(免疫磁分离);2.3%(染色镜检)。
3 讨论
结果表明,在实验室检测“两虫”时,为了提高实验质量和检测结果可信度,必须优化前处理过程,严格把控洗脱、离心、抽滤3个前处理阶段的质量。洗脱阶段的损失率最高,表明大部分的隐孢子虫孢囊和贾第鞭毛虫卵囊洗脱环节被遗漏或者未被洗脱出来,洗脱阶段将是至关重要的一环。这就要求在洗脱液的配制、振荡频率的设置、振荡时间的控制、振荡方式的优化等方面做深入研究,如超声波洗脱。离心阶段的损失,主要在转移过程,一般实验室常用的转移手段是虹吸法,操作不当轻则搅动“两虫”沉淀物,重则将沉淀物吸出,对检测结果及质量有很大影响,可以在离心时间、离心动力、离心管的设计及超细虹吸设备等做深入研究。抽滤阶段的损失率主要原因涉及抽滤量、抽滤速率、抽滤方式的不同等,可以在改变抽滤量、优化抽滤速率等方面作有益尝试,从而降低“两虫”检测损失率,提高实验质量。
