探讨新发T1DM并DKA儿童免疫功能状态分析
2022-02-14周斌杨玉刘志强谢理玲杨利徐晗
周斌,杨玉,刘志强,谢理玲,杨利,徐晗
(江西省儿童医院,南昌医学院附属儿童医院1.内分泌遗传代谢科;2.检验科;3.儿内科,南昌 330006;4.南昌大学江西医学院医学部,南昌 330000)
儿童1型糖尿病 (Type 1Diabetes Mellitus,T1DM)是儿童期最常见的慢性疾病之一,其发病率有逐年增加趋势,已成为全球最重要的公共卫生问题之一。2021年国际糖尿病联合会IDF发布了第十版《糖尿病地图》显示全球约有261万年轻T1DM患者(<20岁),其数量为2015年的4倍[1]。T1DM是一种慢性免疫介导性疾病,是由于产生胰岛素的胰岛β细胞遭到破坏引起胰岛素缺乏而导致,但其具体发病机制尚未完全阐明[2]。尤其是对于新发T1DM合并DKA患者的免疫状态的临床研究尚不多。因此,本研究通过观察新诊断的T1DM合并DKA患者体液免疫、炎症细胞因子及淋巴细胞亚群水平,探讨其免疫功能状态变化,为其进一步的诊疗提供一定的理论依据。
1 资料与方法
1.1 一般资料 收集2021年01月至2022年1月江西省儿童医院收治的40例新发T1DM合并DKA患儿为观察组,其中男16例,女24例,平均年龄8.9岁。入组标准:根据世界卫生组织(WHO)指南及中国共识中的T1DM诊断标准[3-4],并且排除器质性疾病,如心脏、肝脏、肾脏及结缔组织疾病者等情况。DKA的诊断标准采用2020年中华医学会儿科学分会内分泌遗传代谢学组发布的最新的儿童DKA诊疗标准[4]:符合糖尿病诊断标准者,血酮体或尿酮体阳性,同时血气分析PH值<7.3或者HCO3-<15 mmol/L者纳入观察组。本研究经医院伦理委员会批准(SKJP220202151),并得到所有受试者家属知情同意。同时选择同期来我院儿保科体检的健康儿童20例作为对照组,其中男8例,女12例,平均年龄8.8岁。两组儿童的性别、年龄比较差异无统计学意义(P>0.05),具有可比性。
1.2 实验室检查 观察组与对照组儿童均抽取清晨空腹外周静脉血5ml.(1)通过免疫比浊法使用全自动生化分析仪检测两组儿童的外周血中的免疫球蛋白(IgM、IgE、IgA、IgG)的浓度。仪器及试剂使用FACS CantoⅡ流式细胞仪(美国BD公司),TD5AWS离心机,美国赛默飞酶标仪,洗板机(安图实验仪器有限公司),恒温孵育箱,PE anti-human TCRγδ(,Alexa Fluor488偶联anti-human IL-17A McAb,PerCP anti-human CD3、CD8、CD4、CD16、CD56、CD19 McAb,Human IL-1B、IL2R、IL6、IL8、IL10、IL17、TNFα、IFN-γELISA Kit。留取静脉血1ml放入普通管采集、离心并分离后得到血清,放-80℃冰箱保存后,采用酶联免疫吸附法检测血清IL-1B、IL2R、IL6、IL8、IL10、IL17、TNFα、IFN-γ的OD值,并根据试剂盒步骤制作标准曲线,得到公式后,将OD值转化为的浓度值后汇总进行数据统计。使用淋巴细胞分离液从肝素抗凝的2 mL外周血标本中提取单个核细胞(PBMCs)悬浮液后[5],再使用胎牛血清培养液将细胞密度调整为2×106/mL,取其中细胞悬液加入豆蔻酰佛波醇乙酯、离子霉素及莫能菌素吹打混匀细胞培养箱内培养5 h。收集培养后细胞于流式上样管中离心洗涤后再悬浮后待检测。设立阴性对照并同时设立阳性对照组后,分别加入Per-CP anti-human CD19、CD3、CD8、CD4、CD16、CD56等淋巴细胞表面抗体并染色后进行流式细胞仪检测;最后得到原始数据导入FACSDiva软件进行数据分析。
1.3 统计学分析 数据整理核对后采用SPSS 23.0统计软件进行统计分析。计数资料采用X2检验。计量资料采用(±s)表示,Kolmogorov-Smirnov检验符合正态性分布,组间采用独立样本t检验,α=0.05为检验水准。
2 结果
2.1 观察组体液免疫水平 观察组IgA水平高于对照组,差异有统计学意义(P<0.05);观察组IgE、IgG、IgM水平与对照组比较无统计学差异(P>0.05)。见表1。
表1 观察组与对照组免疫球蛋白水平的比较(±s)
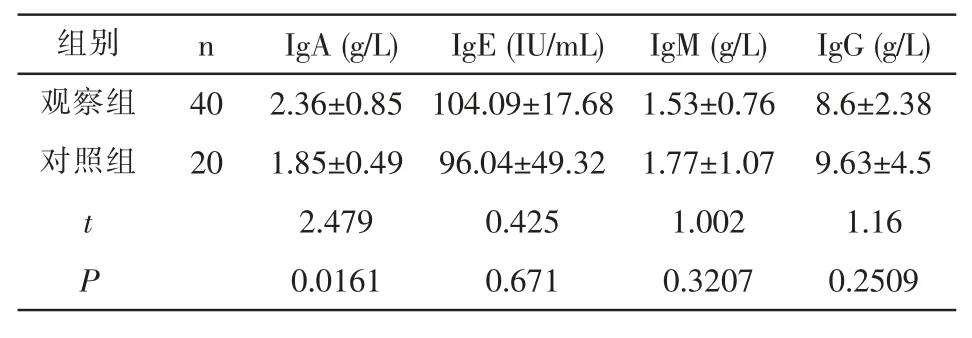
表1 观察组与对照组免疫球蛋白水平的比较(±s)
?
2.2 观察组细胞因子水平 观察组IL-1B、IL8、IFNγ水平均高于对照组,差异有统计学意义(P<0.05),观察组IL2R、IL6、IL10、IL17、TNFα水平与对照组比较,差异无统计学意义(P>0.05)。见表2。
表2 观察组与对照组细胞因子水平的比较(±s)
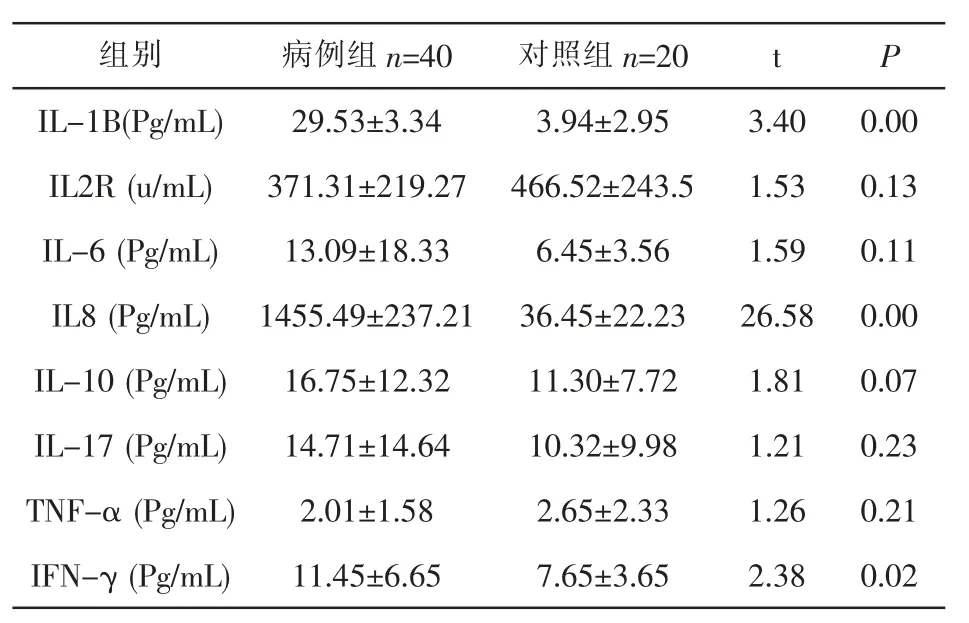
表2 观察组与对照组细胞因子水平的比较(±s)
?
2.3 观察组淋巴细胞亚群水平 观察组B淋巴细胞数、B淋巴细胞百分数、CD4+CD8+双阳性T淋巴细胞数、CD4+CD8+双阳性T淋巴细胞百分数、NK细胞数、NK细胞百分数与对照组比较差异有统计学意义(P<0.05),其中观察组B淋巴细胞数、B淋巴细胞百分数、CD4+CD8+双阳性T淋巴细胞数、CD4+CD8+双阳性T淋巴细胞百分数为增高表现,NK细胞数、NK细胞百分数为降低表现;观察组的总T淋巴细胞数、总T淋巴细胞数百分数、T4淋巴细胞数、T4淋巴细胞数百分数、T8淋巴细胞数、T8淋巴细胞数百分数及T4/T8与对照组比较差异无统计学意义(P>0.05)。见表3。
表3 观察组与对照组淋巴细胞亚群水平的比较(±s)
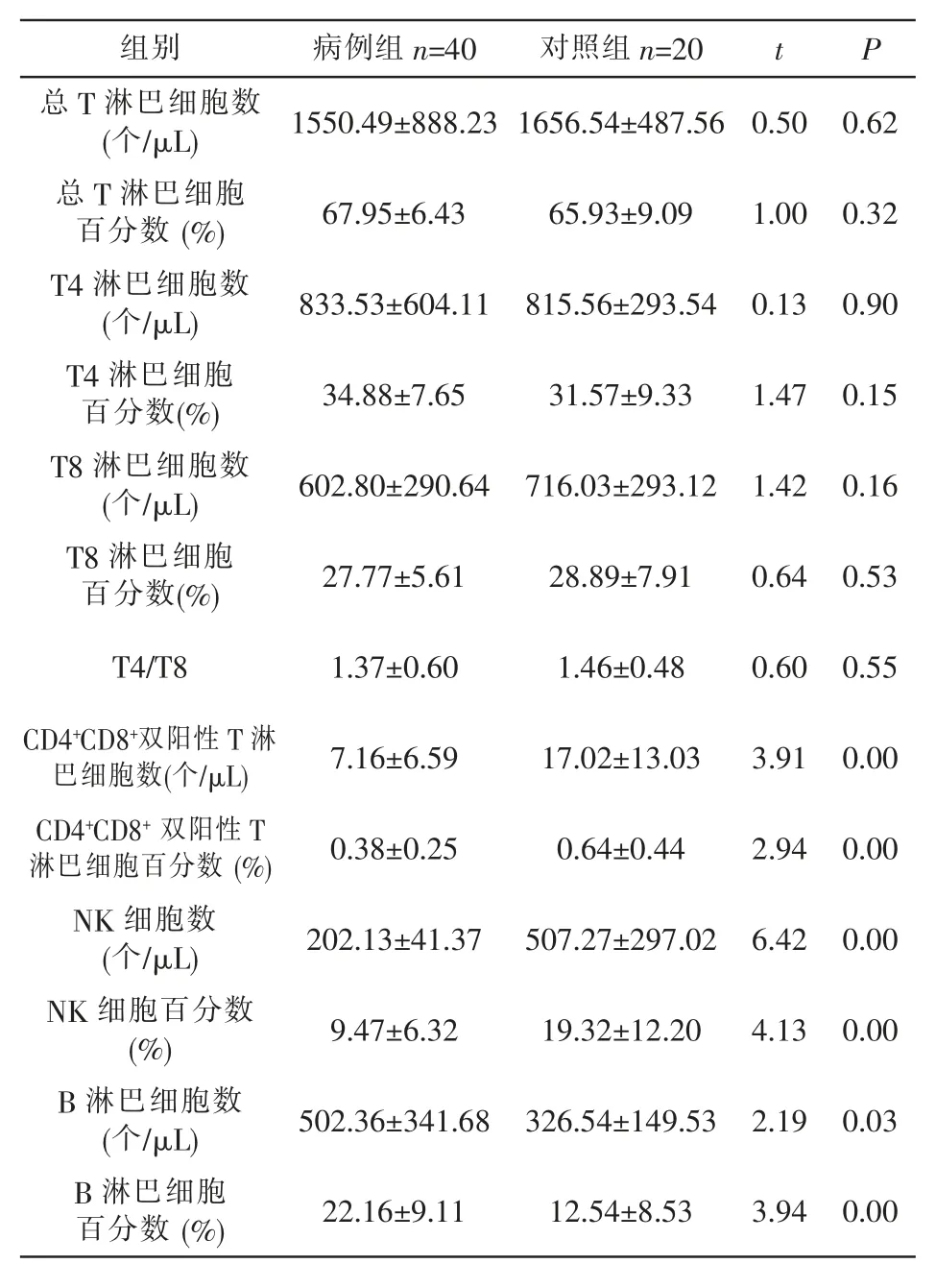
表3 观察组与对照组淋巴细胞亚群水平的比较(±s)
?
3 讨论
传统上,1型糖尿病(T1DM)被认为是T细胞介导的自身免疫性疾病。是由于分泌胰岛素的胰腺β细胞损伤所致。有研究表明其损伤机制可能与其自反应T细胞的直接相互作用有关。因此,大多数关于1型糖尿病(T1DM)免疫学的研究都集中在T细胞的功能上。这并不奇怪,因为在疾病后期,自反应T细胞介导了产生胰腺β细胞的胰岛素破坏[2]。但是,许多研究表明,如抗CD20(利妥昔单抗)疗法通过广泛消耗B细胞治疗T1DM的成功,可以延缓非肥胖糖尿病(NOD)小鼠和新发患者的疾病进展[6-7]。因此表明B细胞免疫耐受性的破坏也是T1DM的主要因素。
本研究结果显示:儿童新发T1DM并DKA患者体内B淋巴细胞水平及IgA水平显著增高,提示此类患者体内存在体液免疫的过度激活及功能紊乱。B细胞参与人类T1DM发展的具体机制尚未完全明了。有人认为,与NOD一样,B细胞通过抗原呈现促进发病机制。HLA II类基因的DR3/4-DQ2/8等位基因对T1D疾病发生的风险最大,表明抗原呈现给CD4 T细胞至关重要[8]。HLA I类等位基因在风险等位基因中排名第二。有趣的是,在新诊断的T1DM患者的胰腺淋巴细胞中,B细胞的频率仅次于CD8 T细胞[9]。人们很容易猜测,这些B细胞是CD8 T细胞的主要抗原呈递细胞(Antigen-presenting cells,APC),这在NOD小鼠中已经证明了这一点。这些B细胞必须逃脱正常的沉默机制,并对抗原有反应。这在与对照组相比,T1DM和SLE患者在λ+B细胞中的重组序列(RS)重组都减少了,表明这些自身免疫患者减少了受体编辑[10]。这些研究表明,自身免疫患者在开始RS重新排列时可能具有更高的自反应阈值,可能允许更多的自反应B细胞进入外周。在这方面,最近研究表明,Ptpn22 T1D风险等位基因以B细胞的内在方式发挥作用,允许自反应B细胞进入外周[11]。因此,间接证据表明,在人类T1DM胰岛中,抗原反应B细胞有可能逃脱耐受并进入外周,通过向CD4和CD8 T细胞呈现抗原来促进疾病的胰腺定位。
本研究结果显示:儿童新发T1DM并DKA患者体内IL-1B、IL8、IFN-γ水平显著性增高,提示此类患者体内存在炎症相关因子水平的激活。在对一项134名新发的T1DM患儿的2年随访研究中发现,与T1DM未缓解的患者相比,缓解者中的IL-8(P=0.042)浓度显著升高。但也有研究表明,外周血的IL-8水平显著升高与T1DM代谢控制不佳有关[12]。NOD小鼠作为T1DM的动物模型,通过转基因杂交技术,得到IL-17和/或IFN-γ双缺陷的NOD小鼠,发现IL-17/IFN-γ受体双缺陷NOD小鼠的长期糖尿病发病率明显下降,但胰岛自身炎症没有改变,这些结果表明IL-17/Th17参与了胰岛炎的发展,并且IL-17和IFN-γ信号传导可能协同促进NOD小鼠糖尿病的发展[13]。已有多个研究显示T1DM患者IL-1水平显著增高,并有IL1受体拮抗剂的治疗,如糖尿病行动 (AIDA)和TrialNet Canakinumab(TN-14)试验中的抗白介素-1治疗或者卡那单抗的治疗,尽管治疗改善T1DM患者炎症因子水平,但是并不能改善C肽释放试验的C肽水平[14]。因此,T1DM存在细胞炎症因子水平紊乱,但其机制有待进一步研究。
NK细胞(natural killer cell,NK)是一种不表达T细胞(CD3)和B细胞(CD19)的大颗粒淋巴细胞,广泛分布于外周各组织器官及血液循环系统,无须抗原的预先刺激与活化即可直接激活并通过分泌细胞因子及趋化因子发挥免疫调节功能,因此在机体的免疫调节、抗感染及抗肿瘤等多方面有着不可或缺的作用[15]。虽然有研究在动物模型和糖尿病患者发现NK细胞与T1DM的发病相关,但并无或益或损的定论。且在临床T1DM患者中,外周血NK细胞活性和数量的变化研究也无最终的结论。临床NK细胞研究未能深达胰腺的病理与其相互验证,动物实验研究亦未能完全模拟人体的病理状态[16]。本研究显示,T1DM合并DKA组的NK细胞数量及百分比均有统计学意义上的减少。通过已有的数据及文献线索推导,T1DM患者外周血NK细胞的降低可能与NK细胞聚集在胰腺或淋巴结中的数量增加有关[17]。其次,动物中的NK细胞功能实验研究中亦发现,NK细胞可能下调IFN-γ分泌并同时下调自身反应性细胞毒性T淋巴细胞(CTL),从而达到保护T1DM患者,减轻其自身免疫反应[18,19]。这个机制恰好也可以解释本研究NK细胞降低与IFN-γ增高这两个结果的联系。
T淋巴细胞的分化,根据CD4和CD8的表达,可以将其分为双阴性(double-negative,DN)、双阳性(double-positive,DP)和单阳性(single positive,SP)三个主要阶段[20]。DN细胞通过“β-选择”转化为DP细胞,DP再通过阳性选择(positive selection)分别与MHC I类分子结合则转化为CD4-CD8+的单阳性T细胞,与MHCⅡ类分子结合则转化为CD4+CD8-的单阳性T细胞。其意义在于使DP细胞分化为具有MHC限制性的SP细胞达到免疫作用保护机体。最后不能结合的SP细胞通过阴性选择(negative selection)发育为成熟T细胞进入外周免疫器官,清除自身反应性T细胞,从而避免发生如T1DM类的自身免疫性疾病[21-22]。本研究为新发T1DM合并DKA患者,其存在T淋巴细胞分化的不畅,但T4淋巴细胞、T8淋巴细胞无显著性改变,其CD4+CD8+双阳性T淋巴细胞数增高可能与T1DM处于早期阶段有关,其后续变化仍有待进一步研究。
综上所述,儿童新发T1DM合并DKA患者存在体液免疫功能异常,B细胞数量及IgA的增高,并且儿童新发T1DM并DKA患者体内多种炎症因子水平增高,存在CD4+CD8+双阳性T淋巴细胞数增高及NK细胞的降低,提示儿童新发T1DM并DKA患者存在B淋巴细胞与T淋巴细胞的双重功能异常,淋巴细胞亚群功能紊乱可能为导致儿童T1DM的关键病因之一。
