中老年小鼠通过长期运动改善Aβ1-42诱导的认知功能障碍
2022-02-14张卫国杨娜杨静刘雪芹赵云鹤
张卫国,杨娜,杨静,刘雪芹,赵云鹤*
山西医科大学人体解剖学教研室,太原 030001
当今世界阿尔茨海默症(Alzheimer's disease,AD)患者人数呈上升趋势,其表现为进行性记忆功能障碍和认知能力下降,严重危害老年人的身体健康,成为困扰家庭和社会的重大问题[1]。预防和治疗AD的药物和方法亟待研发[2]。AD患者脑内β-淀粉样蛋白(amyloidβpeptide,Aβ)沉积,是其众多病理性指标中最具特征性的标志之一[3]。有效清除Aβ成为研究AD的方向之一。Lopez等[4]使用皮层神经元和星形胶质细胞原代培养研究泛素-蛋白酶体通路对Aβ降解的影响,发现当乳酸菌素抑制26S蛋白酶体的蛋白水解活性时,Aβ1-42的降解显著降低,Aβ异常累积增多,提示Aβ在星形胶质细胞和神经元中都可能是泛素蛋白酶体复合物的底物。Keck等[5]分析发现,AD患者端脑直回中的蛋白酶体活性水平较健康对照组降低56%。动物实验发现,成年小鼠短期运动可上调海马蛋白酶体活性而提高其学习能力[6]。Choi等[7]及Lopez等[8]发现淀粉样前体蛋白转基因小鼠通过运动可以减少小鼠脑内的淀粉样斑块沉积,从而提高小鼠的空间记忆能力。那么,中老年小鼠可否通过坚持长期运动而清除Aβ沉积,减轻Aβ的毒性作用,进而抑制AD的发生与发展呢?为此,课题组随机选取12月龄小鼠建立长期自主跑轮运动模型及AD模型,观察长期运动对Aβ1-42所致认知功能障碍的影响。
1 材料与方法
1.1 材料
1.1.1 动物与分组 山西医科大学实验动物中心提供12月龄SPF级BALB/c雄性小鼠,(SCXK(晋)2015-0001。随机分为4组,①溶剂对照静坐组(Veh+sedentary,VS),②Aβ1-42静坐组(Aβ1-42+sedentary,AS),③溶剂对照长期自主跑轮运动组(Veh+runner,VR),④Aβ1-42长期自主跑轮运动组(Aβ1-42+runner,AR)。自主跑轮或静坐6个月,AS及AR组小鼠海马立体定位注射Aβ1-42,VS及VR组小鼠注射等量溶剂对照。
1.2.1 试剂 人源Aβ1-42寡聚体(英国Abcam公司),小鼠抗β-amyloid单克隆抗体(美国Biolegend公司),DAB染色试剂盒(美国life technologies公司),实验组制备1μg/μl的寡聚体Aβ1-42。对照溶剂为等量DMSO溶于1×PBS溶液。
1.2 实验方法
1.2.1 海马立体定位注射Aβ1-42小鼠以2.5%异氟烷气体持续麻醉,前囟为零点,向后2 mm,旁开1.5 mm,深2 mm[9],海马立体定位注射1μl Aβ1-42或对照溶剂。
1.2.2 蛋白免疫印迹法 提取小鼠脑蛋白样品,兔抗鼠泛素单克隆抗体(1:3000),兔抗鼠β-actin单克隆抗体(1:1000),辣根过氧化物酶偶联抗兔二抗(1:4000),参照文献[6]孵育,曝光显影,Image J软件分析。
1.2.3 新物体识别实验和Y迷宫自发交替实验 小鼠记忆能力的行为学检测方法参照课题组前期研究[6]。
1.2.4 蛋白酶体活性检测 参照课题组前期研究[6,10],提取小鼠新鲜海马组织,BCA法测定蛋白浓度。检测荧光酶标仪380 nm(激发波长)/460 nm(发射波长)处蛋白酶体活性水平。
1.2.5 免疫组织化学染色 收集前囟-1.34 mm,至-2.30 mm的脑冠状切片,厚16μm。参照文献[6,10],兔抗鼠Aβ一抗(1:200),4℃孵育过夜;DAB显色,用Olympus显微镜观察染色结果并拍照。
1.2.6 免疫组化结果分析 每组观察4只小鼠,双侧海马DG区,在400倍光镜视野下选取8个不重复视野,Image-Pro Plus 6.0图像分析系统测量平均光密度值(integrated option density,IOD)。
1.3 统计学分析
2 结果
2.1 长期运动降低海马泛素化蛋白堆积
12月龄小鼠自主跑轮6个月后取海马组织,提蛋白,Western blot检测,泛素化蛋白堆积水平较静坐组下降0.2倍(P<0.05,图1),提示长期运动可促进海马泛素化蛋白质降解,有效降低泛素化蛋白堆积。
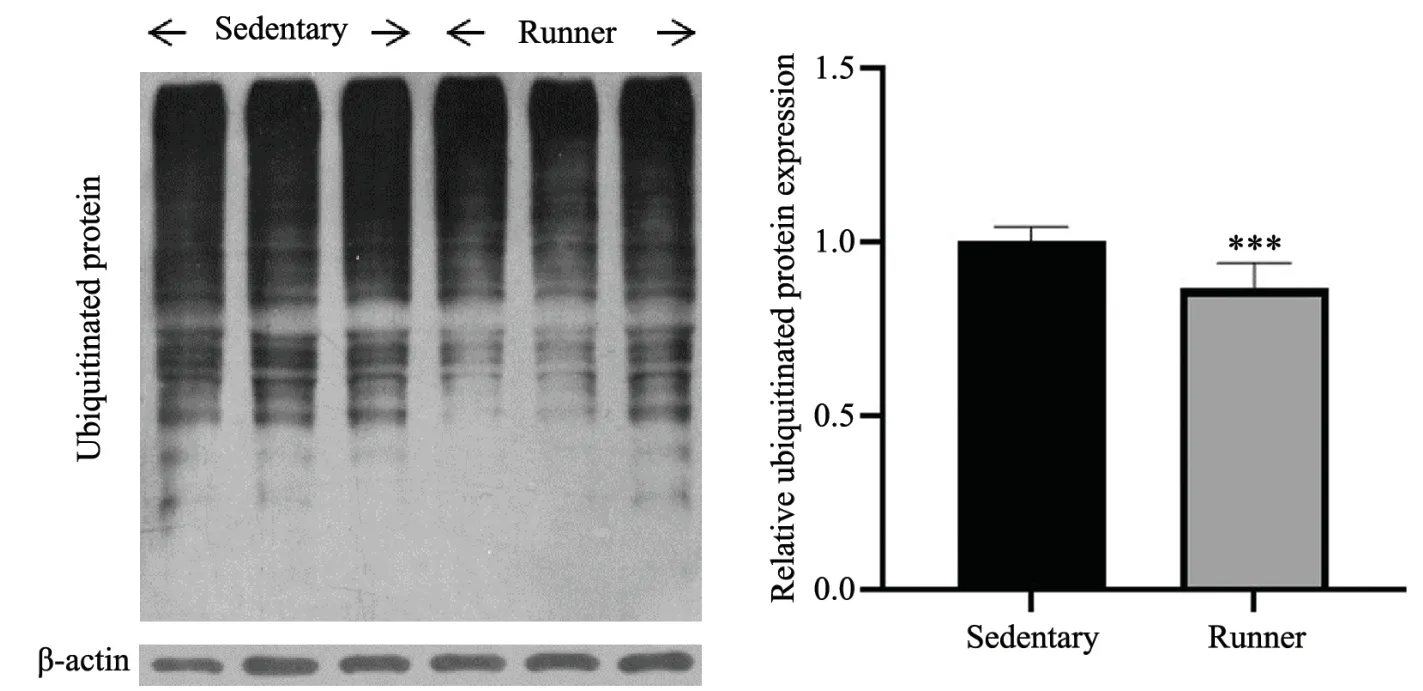
图1 长期运动降低海马泛素化蛋白堆积***P<0.001,静息组,n=6Fig.1 Long-term exercise reduced the accumulation of ubiquitinated protein in hippocampus***P<0.001,vs sedentary group,n=6
2.2 长期运动对Aβ1-42所致认知功能障碍的影响
2.2.1 新物体识别实验 小鼠的活动距离无显著差异,提示各组小鼠的活动能力相似。VR组小鼠新物体识别指数(66.4±1.5)%与VS组小鼠(59.1±1.4)%相比,提高0.12倍(P<0.05),AS组小鼠新物体识别指数(44.8±3.7)%较对照组(59.1±3.7)%下降0.24倍(P<0.01),表明Aβ1-42损伤小鼠的认知学习能力,但AR组小鼠新物体识别指数(63.6±3.6)%较AS组小鼠(44.8±3.7)%升高0.42倍(P<0.05),提示长期运动可拮抗Aβ1-42导致中老年小鼠出现的认知功能障碍,见图2。
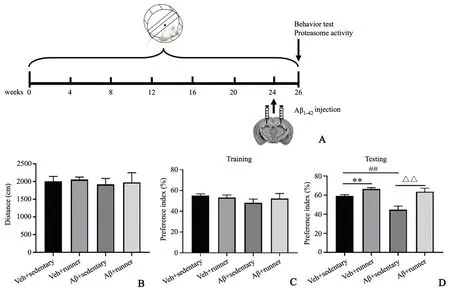
图2 新物体识别检测长期运动改善Aβ1-42诱导的小鼠记忆障碍A:实验流程图 B:组间小鼠运动距离比较 C:训练期小鼠物体识别指数 D:测验期小鼠新物体识别指数*P<0.01 vs VS组,P=0.0032,#P<0.01 vs VS组,P=0.0025,△△P<0.01 vs AS组,n=8Fig.2 Novel object recognition detected thelong-term exercise antagonizes Aβ1-42-induced spatial memory dysfunction in miceA:Experimental flow chart;B:Comparison of the distance in NORtest between groups;C:Comparison of the preference index of mice in training among all groups;D:Comparison of the preference index of mice in testing among all groups**P<0.01 vs VS group,P=0.0032,#P<0.01 vs VS group,P=0.0025,△△P<0.01 vs ASgroup,n=8
2.2.2 Y迷宫自发交替实验 各组小鼠总进臂次数相近,提示各组小鼠活动能力无明显差异(P>0.05)。与VS组小鼠入臂正确率(66.7±0.9)%相比,VR组小鼠(73.8±2.2)%提高0.1倍(P<0.05),AS组小鼠(56.1±1.7)%下降0.16倍(P<0.05),表明Aβ1-42损伤小鼠的认知学习能力。但AR组小鼠入臂正确率(67.7±2.4)%较AS组小鼠升高0.21倍(P<0.05),表明长期运动可拮抗Aβ1-42导致中老年小鼠出现的认知功能障碍,见图3。
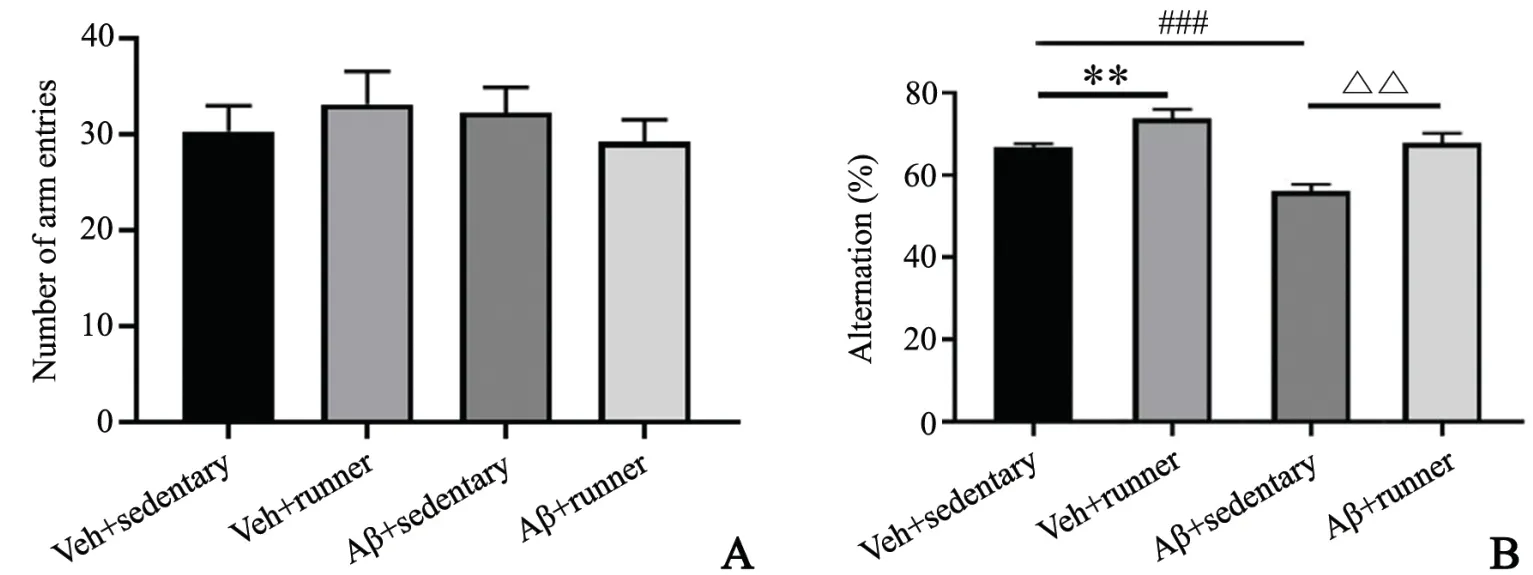
图3 自发交替实验检测长期运动改善Aβ1-42导致的空间记忆能力障碍A:入臂总次数比较 B:入臂正确率比较 **P<0.01 vs VS组,###P<0.001 vs VS组,△△P<0.01 vs AS组,n=8Fig.3 Spontaneous alternating detection long-term exercise antagonizes Aβ1-42-induced spatial memory dysfunction in miceA:Comparison of the total number of arm entry in mice among all the groups;B:Comparison of the accuracy of arm entry in micebetween groups;**P<0.01 vs VSgroup,###P<0.001 vs VSgroup,△△P<0.01 vs ASgroup,n=8
2.3 长期运动对小鼠注射Aβ1-42后海马蛋白酶体活性及泛素化蛋白沉积的影响
与VS组比较,VR组蛋白酶体活性升高0.33倍(P<0.01),AS组蛋白酶体活性下降约0.21倍(P<0.01)。同时,AR组蛋白酶体活性较AS组升高0.18倍(P<0.01),提示Aβ1-42抑制海马蛋白酶体活性,而长期运动可维持海马蛋白酶体活性(图4A)。
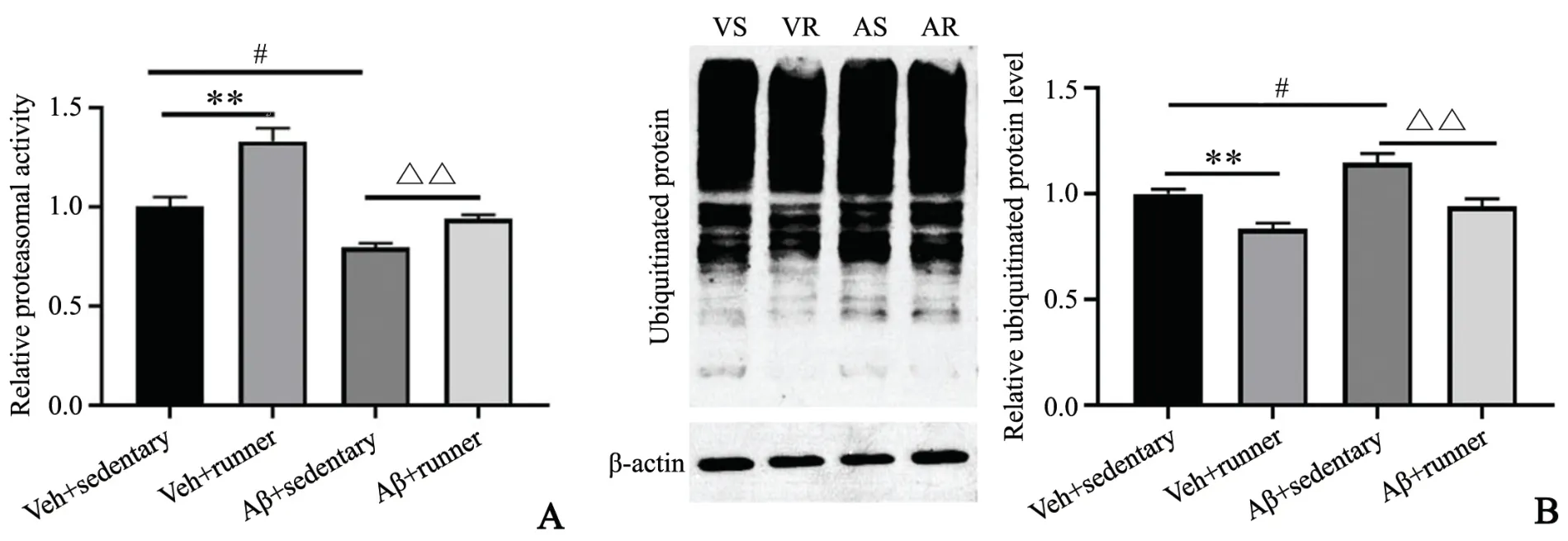
图4 长期运动对海马蛋白酶体和泛素化蛋白的影响A:海马蛋白酶体活性 B:免疫印迹检测海马泛素化蛋白积累 **P<0.01,与VS组比较#P<0.05,与VS组比较△△P<0.01,与AS组比较n=6Fig.4 Effect of long-term exercise on the activity of hippocampal proteasome activity and the ubiquitinated protein level in miceA:The proteasome activity in hippocampus;B:The accumulation of ubiquitinated protein in mice hippocampus detected by Western blotting;**P<0.01 vs VSgroup,#P<0.05 vs VSgroup,△△P<0.01 vs ASgroup,n=6
免疫印迹检测结果显示,VR组小鼠海马泛素化蛋白(0.83±0.06)较VS组小鼠(1.00±0.05)减少0.17倍(P<0.01),提示长期自主跑轮运动可促进泛素化蛋白沉积减少。AS组小鼠海马泛素化蛋白(1.15±0.10)较VS组小鼠(1.00±0.05)升高0.15倍(P<0.01),而AR组小鼠海马泛素化蛋白沉积(0.94±0.08)较AS组小鼠(1.15±0.10)下降0.21倍(P<0.01),提示长期运动可拮抗Aβ1-42导致的泛素化蛋白堆积,促进泛素化蛋白质清除(图4B~C)。
2.4 免疫组化染色观察海马Aβ1-42沉积情况
镜下可见Aβ1-42为棕黄色颗粒物(图5A)。溶剂对照组(VS组和VR组)未见Aβ1-42阳性染色团块,Aβ 1-42注射组(AS组和AR组)可见Aβ1-42染色阳性棕色团块。AR组Aβ1-42免疫组化着色较浅,阳性表达(0.76±0.07)较AS组显著减少(1.00±0.09)(P<0.01),提示长期运动组Aβ1-42沉积率下降(图5B)。
3 讨论
长期的适宜运动能提高脑认知和学习记忆能力,降低AD发病率,预防或缓解AD病人以记忆功能障碍和认知能力下降为主的临床表现,其机制可能与运动调控脑的Aβ堆积、神经元的退行性变相关[11,12]。课题组的研究结果证明成年鼠短期自主跑轮运动可上调海马蛋白酶体活性从而促进神经发生[6]。本研究通过建立中老年小鼠长期运动及其对照模型,给予海马立体定位Aβ1-42注射,2周后分别检测小鼠海马蛋白酶体活性、Aβ沉积水平,认知学习能力等,结果发现,中老年小鼠长期自主跑轮运动可维持其海马蛋白酶体活性,减少海马泛素化蛋白堆积,降低Aβ沉积[11],改善Aβ1-42所致的认知功能障碍,预防或缓解AD病理。
淀粉样蛋白级联假说认为AD其根本原因是Aβ在神经元胞体外的异常沉积[13],最终导致神经细胞功能受损,神经细胞数量进行性减少,患者端脑皮质萎缩[14]。全基因组关联研究、通路分析和蛋白质组学研究发现,蛋白质泛素化是AD的关键调节因子之一。线虫过表达19S蛋白酶体亚单位可降低Aβ的毒性反应,延缓AD进程[15]。阿波吗啡(APO)可激活蛋白酶体活性。Hemino等[16]在6月龄的三转基因AD模型小鼠(3xTg-AD小鼠)皮下注射APO,发现通过APO治疗,3xTg-AD小鼠的记忆功能得到改善,神经元内Aβ和p-tau水平下降,这强烈表明,神经元内Aβ是AD一个重要的治疗靶点。此外,APO可提高SHSY-5Y(人神经母细胞瘤细胞)蛋白酶体活性,促进Aβ降解,降低p53蛋白水平[17]。同样,亚甲蓝可以激活3xTg-AD小鼠脑内蛋白酶体活性,降低Aβ沉积水平,改善AD小鼠的认知功能[18]。白藜芦醇,一种主要存在于葡萄中的天然多酚,可诱导Aβ水平下降,且该现象可被选择性蛋白酶体抑制剂和RNAi定向沉默蛋白酶体亚基β5来阻止,提示白藜芦醇可通过蛋白酶体途径显著降低细胞内的Aβ水平[19],可见,维持蛋白酶体活性有利于改善认知障碍。
综上推测,中老年小鼠长期自主跑轮运动可上调海马蛋白酶体活性从而改善Aβ沉积导致的认知障碍,该研究结果为“倡导体育运动,提高人民体质”提供了理论和实验基础,但是其涉及的分子机制复杂,具体作用靶点有待进一步阐明。