不同玫瑰品种叶绿素荧光参数对比研究
2022-02-14李向义鲁艳张爱林
李向义 鲁艳 张爱林

摘要 [目的] 比较不同玫瑰品种光系统Ⅱ(PSⅡ)对和田地区光照环境的适应能力。[方法]以和田玫瑰、白玫瑰和云南玫瑰3个不同玫瑰品种和不同种植年限的和田玫瑰为研究对象,测定不同品种玫瑰叶片的叶绿素荧光动力学曲线和荧光参数。[结果]白玫瑰的荧光参数值均小于和田玫瑰和云南玫瑰,白玫瑰的反应中心能量流动变化的日变化量大于和田玫瑰和云南玫瑰,其中和田玫瑰的日变化最稳定。不同种植年限的和田玫瑰中3年生的荧光参数日变化幅度最大,反应中心能量流动的日变化量大于1年生和4年生,随光照强度的变化3年生和田玫瑰的PSⅡ結构最不稳定。在叶绿素荧光动力学曲线中,云南玫瑰在I点和P点的荧光强度明显小于其他品种的玫瑰。[结论]和田玫瑰最适应和田的光照强度,对光照强度变化反应最小,其中3年生和田玫瑰的PSⅡ结构对光照变化更敏感,更易受到环境光照强度的影响。
关键词 玫瑰;叶绿素荧光;光系统Ⅱ;光照;日变化
中图分类号 S685.12 文献标识码 A 文章编号 0517-6611(2022)01-0050-05
doi:10.3969/j.issn.0517-6611.2022.01.014
Comparision of Chlorophyll Fluorescence Parameters among Different Rosa rugosa Varieties
LI Xiang-yi1,2,3,4,LU Yan1,2,3,ZHANG Ai-lin1,4
(1.Xinjiang Key Laboratory of Desert Plant Roots Ecology and Vegetation Restoration,Xinjiang Institute of Ecology and Geography,Chinese Academy of Sciences,Urumqi,Xinjiang 830011;2.State Key Laboratory of Desert and Oasis Ecology,Xinjiang Institute of Ecology and Geography,Chinese Academy of Sciences,Urumqi,Xinjiang 830011;3.Cele National Station of Observation and Research for Desert-Grassland Ecosystems,Cele,Xinjiang 848300;4.University of Chinese Academy of Sciences, Beijing 100049)
Abstract [Objective]To compare the PSⅡ adaptive ability of different R.rugosa to Hotan sunlight environment.[Method] Using Hotan Rosa rugosa,white R.rugosa,Yunnan R.rugosa and different growing years Hotan R.rugosa as the experimental materials,we measured the chlorophyll fluorescence transients and chlorophyll fluorescence parameters in leaves of different varieties and different growing years of Hotan R.rugosa.[Result]Chlorophyll fluorescence parameters in leaves of white R.rugosa were lower than Hotan R.rugosa and Yunnan R.rugosa.Diurnal variation of energy flow distribution in PSⅡ reaction center in leaves of white R.rugosa was higher than Hotan R.rugosa and Yunnan R.rugosa,and the variation in leaves of Hotan R.rugosa was the most stable.Diurnal variation of chlorophyll fluorescence parameters in leaves of 3 years old Hotan R.rugosa was highest,and diurnal variation of energy flow distribution in PSⅡ reaction center was higher than 1 and 4 years old Hotan R.rugosa,indicating the structure of PSⅡ reaction center in leaves of 3 years old R.rugosa was the most unstable.Chlorophyll fluorescence transients indicated that fluorescence intensities at I and P point in leaves of Yunnan R.rugosa were significant lower than other varieties.[Conclusion]Hotan R.rugosa was most adaptive to Hotan sunlight environment owing to the lowest response activities to sunlight diurnal variation.PSⅡ reaction center in leaves of 3 years old R.rugosa was the most sensitive to sunlight diurnal variation,and was more easily affected by sunlight diurnal variation.
Key words Rosa rugosa;Chlorophyll fluorescence;PSⅡ;Sunlight;Diurnal variation
基金项目 中国科学院科技扶贫项目(KFJ-FP-201903);中国科学院西部之光项目(2019-FPGGRC)。
作者简介 李向义(1969—),男,河南清丰人,研究员,博士,从事植被恢复重建研究。通信作者,副研究员,博士,从事植物逆境生理生态学研究。
收稿日期 2021-04-14
叶绿素荧光分析技术是一种以光合作用理论为基础、利用体内叶绿素作为天然探针,研究和探测植物光合生理状况及各种外界因子对其细微影响的新型植物活体测定和诊断技术[1]。其在测定过程中对光能的吸收、传递、耗散以及分配方面具有独特的作用,而叶绿素荧光参数所反映的叶绿素荧光动力学技术被称为叶片光合功能快速、无损伤的探针[2-3]。叶绿素荧光与光合作用效率密切相关,任何环境因素对光合作用的影响都可以通过叶绿素荧光反映出来[4]。光系统Ⅱ(PSⅡ)的机构及功能与叶绿素荧光参数存在极强的相关性且极易受到外界胁迫的影响,环境的胁迫能够导致PSⅡ结构和功能发生改变甚至损伤[5-6]。另外植物叶片叶绿素荧光强度的变化情况可以在一定程度上反映外界环境对植物的影响,可以用于作物抗性指标的筛选和评价,如抗旱性以及抗盐碱性等[7-8]。
玫瑰(Rosa rugosa) 属蔷薇科(Rosaceae)蔷薇属落叶灌木,花色豐富,香气浓郁,不仅是优良的园林绿化材料,而且是珍贵的中药材和香料工业、食品工业的重要原料。玫瑰花有众多品种,如墨红、大马士革、鸡心玫、苦水玫瑰等,其中不乏栽培变种、栽培变异、杂交后繁育出来的品种。从产地来看,我国北方地区是玫瑰花的原产地和主产区,主要有山东的平阴、定陶及烟台、甘肃苦水、新疆和田等地[9]。而和田玫瑰在和田地区栽培有2 000多年历史,是和田地方特色经济作物,主要种植在田县、和田市、墨玉县等地[10]。笔者以3种玫瑰品种和不同种植年限的和田玫瑰为试验材料,比较它们的叶绿素荧光特性,以期为选择适合在和田地区种植的优质玫瑰品种和科学的种植技术提供理论依据。
1 材料与方法
1.1 研究区概况
玫瑰种植地在新疆维吾尔自治区西南部的墨玉县(80°51′ E,36°36′ N,海拔1 500 m),位于塔克拉玛干沙漠南缘,属于温带荒漠气候,年平均气温11.3 ℃,年平均降水量37 mm,蒸发量2 239 mm,水分亏值较大,春、夏多大风,风沙灾害频繁,8级以上大风年均3~9次,年均风速1.9 m/s,无霜期177 d,年日照时数为2 655 h。土壤以风沙土、灌淤土、棕漠土和盐土为主,土壤沙化严重,有机质含量低,养分缺乏。
1.2 试验材料 试验以和田玫瑰、白玫瑰和云南玫瑰3个不同品种的玫瑰和种植1年、3年和4年的和田玫瑰为研究对象,不同品种和不同种植年限玫瑰采取的灌溉和施肥措施均一致,在开花期选取长势良好的健康植株为测定目标植株进行叶绿素荧光的测定,不同品种和种植年限玫瑰取4个重复。
叶绿素荧光动力学参数测定采用连续激发式荧光仪PEA(Hansatech Ltd.,King’s Lynn,Northfolk,UK),于2019年8月上旬选取长势良好的玫瑰叶片测定叶绿素荧光参数的日变化。为提高田间测定速度,先测定自然光下的荧光参数,然后再测定暗适应下的荧光参数,具体方法:自然光下,用叶夹夹住待测叶片,先照射检测光[2 μmol/(m2·s)],测定作用光存在时的稳态荧光Fs ,再用饱和脉冲光[4 000 μmol/(m2·s)]照射0.8 s,测得最大荧光F′m,然后用黑布盖住叶夹,立即用远红光[1.67 μmol/(m2·s)]照射3 s,测得初始荧光F′o,关闭叶夹,进行暗适应处理15 min,然后再次打开检测光,稳定后可测得初始荧光Fo,接着再照射饱和脉冲光,可测得最大荧光Fm。叶片暗适应20 min后,用3 000 μmol/(m2·s)饱和红闪光照射记录荧光信号,测得快速叶绿素荧光动力学曲线及其参数。
根据以上荧光参数,按 Genty等[2]的公式计算:PSⅡ最大光化学效率Fv/Fm=(Fm-Fo )/Fm,单位反应中心吸收的能量ABS/RC=Mo/VJ/(Fv/Fm),单位反应中心捕获的能量TRo/RC=Mo/VJ,单位反应中心耗散的能量DIo/RC=ABS/RC-TRo/RC,单位面积反应中心的数量RC/CSo=(Fv/Fm)×(VJ/Mo)×Fo,单位反应中心电子传递的能量 ETo/RC= (Mo/VJ)×(1-VJ),原初光化学反应的最大光化学效率φPo=TRo/ABS,电子传递的量子产额φEo=ETo/ABS,捕获的激子能导致电子传递的比率ψo=ETo/TRo,荧光曲线初始斜率Mo=4×(F300μs-F50μs )/(Fm-F50μs)。上述公式中,Fv为可变荧光,Fm为最大荧光,Fo为初始荧光,VJ为在J点的相对可变荧光强度,F300μs为暗适应后照光300 μs时的荧光强度,F50μs为暗适应后照光50 μs时的荧光强度。
1.3 数据分析 用SPSS统计分析软件进行数据处理和分析,用Origin 19、R软件作图。
2 结果与分析
2.1 不同品种玫瑰和不同生长年限和田玫瑰PSⅡ原初光化学效率和初始荧光参数日变化
从图1可以看出,在不同玫瑰品种中,暗适应下初始荧光Fo的日变化不同。在16:00时,白玫瑰与和田玫瑰的Fo达到最大,云南玫瑰的Fo达到最小。但在20:00时,3个玫瑰品种都基本恢复到初始08:00时的测量值。3个品种的玫瑰最大荧光Fm和Fo变化趋势相反,但和田玫瑰的Fm大于云南玫瑰和白玫瑰。3种品种的最大光化学效率(Fv/Fm)日变化较小,且不同品种的变化基本一致。3个品种的玫瑰潜在活性(Fv/Fo)日变化较大,白玫瑰的Fv/Fo日变化波动较大,在16:00达到最低,和田玫瑰和云南玫瑰在14:00时达到最低。
在不同种植年限的和田玫瑰中,Fo的日变化较为一致,且变化较小,但3年的和田玫瑰Fo最大。3年的和田玫瑰Fm的日变化和1年、4年的和田玫瑰变化趋势基本一致,且在20:00时小于初始08:00的测量值。不同年限的和田玫瑰Fv/Fm的日变化较小,也具有一致性。不同年限的和田玫瑰Fv/Fo日变化都呈先下降后增加的趋势,且3年的和田玫瑰Fv/Fo小于其他年限的和田玫瑰。
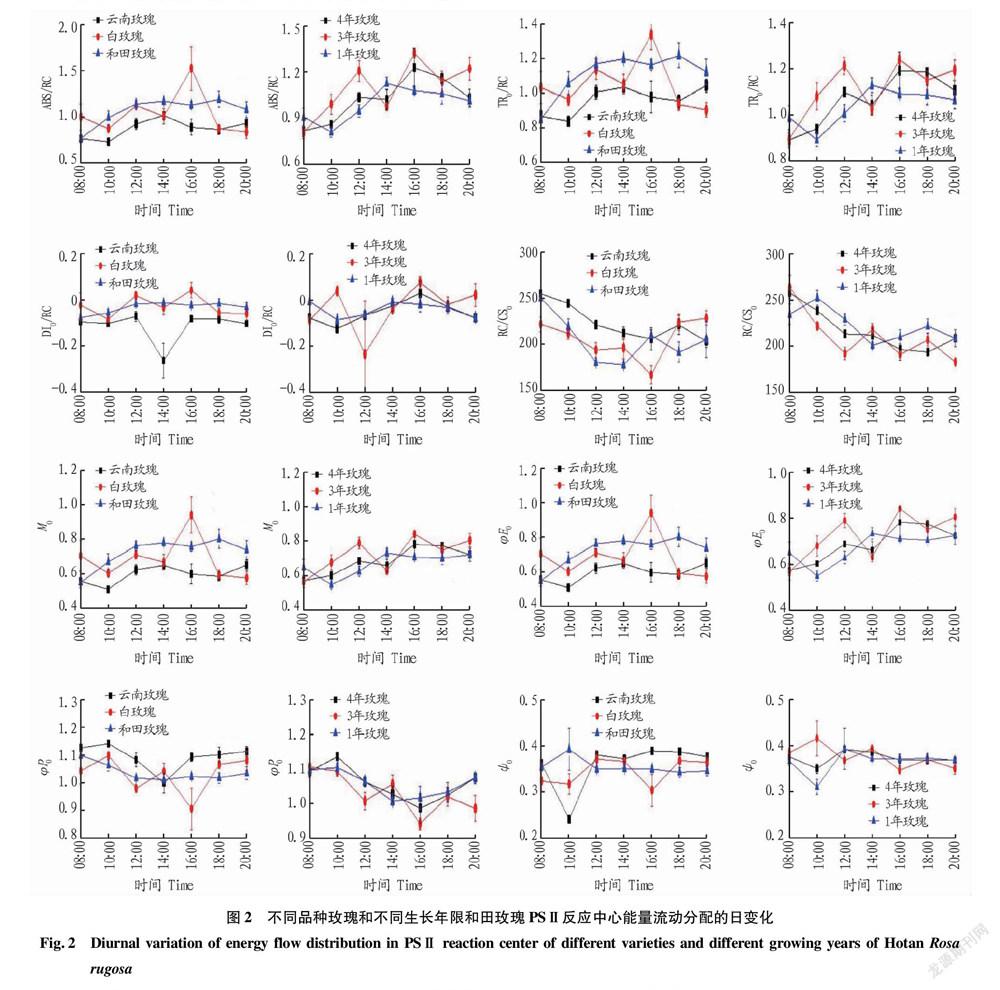
2.2 不同品种玫瑰和不同生长年限和田玫瑰PSⅡ反应中心能量流动分配
从图2可以看出,在不同玫瑰品种中,云南玫瑰与和田玫瑰的单位反应中心吸收的能量(ABS/RC)日变化较小,白玫瑰的日变化较大,并在16:00达到最大,在20:00时恢复到08:00的初始测量值。3个品种玫瑰的单位反应中心捕获的能量TRo/RC和ABS/RC的日变化相同。白玫瑰和和田玫瑰的单位反应中心耗散的能量DIo/RC日变化较小,云南玫瑰的DIo/RC日变化较大,在14:00降至最小。云南玫瑰和白玫瑰的单位面积反应中心的数量RC/CSo在16:00之前呈下降趋势,后逐渐增加,和田玫瑰RC/CSo在14:00时降至最低,后波动增加。云南玫瑰与和田玫瑰的荧光诱导曲线初始斜率Mo日变化较小,白玫瑰的Mo日变化较大,在16:00达到最大。3个品种的玫瑰电子传递的量子产额φEo日变化和Mo的变化趋势一致。云南玫瑰与和田玫瑰的原初反应最大光化学效率(φPo)日变化先下降后增加,在14:00达到最低,白玫瑰的φPo日变化趋势与φEo的日变化趋势相反,在16:00时降至最低。在12:00之前,3个不同品种的玫瑰捕获激子电子传递的效率(ψo)变化较大,但和田玫瑰与其他品种的玫瑰变化趋势相反,在12:00之后云南玫瑰与和田玫瑰的变化较平稳,白玫瑰波动较大,在16:00降至最低。
在不同種植年限的和田玫瑰中,3年和田玫瑰和其他年限的ABS/RC日变化趋势不一致,3年和田玫瑰的日变化波动较大,在08:00最小。不同种植年限的和田玫瑰TRo/RC和ABS/RC的日变化相同。同时,3年和田玫瑰的DIo/RC日变化比其他种植年限的和田玫瑰的日变化波动大,在12:00时降至最低,而其他种植年限的和田玫瑰的日变化较小。不同种植年限的RC/CSo日变化都呈下降趋势,但3年和田玫瑰的日变化波动较大。不同种植年限的和田玫瑰Mo和φEo日变化一致,
但1年和田玫瑰Mo和φEo日变化波动较大。同时3年和田玫瑰φPo的日变化比其他种植年限的和田玫瑰的波动大。在12:00之前,不同种植年限的和田玫瑰ψo变化波动较大,在10:00时3年和田玫瑰ψo达到最大,4年和1年和田玫瑰的ψo降至最小,在12:00之后ψo变化较平稳。
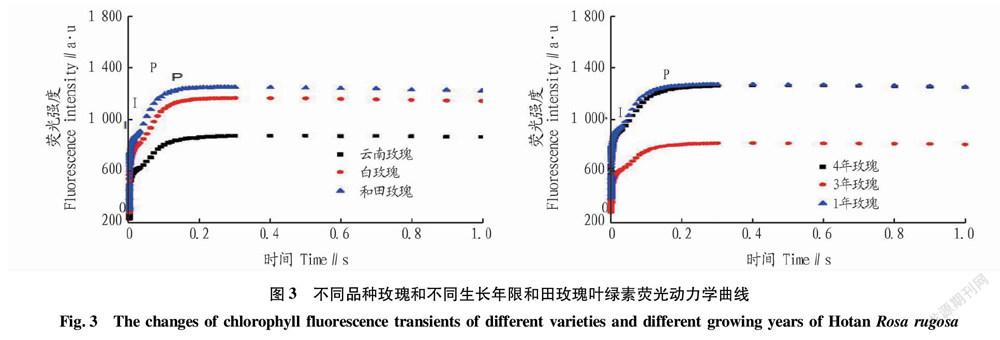
2.3 不同品种玫瑰和不同生长年限和田玫瑰叶绿素荧光动力学曲线
快速叶绿素荧光诱导动力学曲线以生物膜流动为基础,通过氧化还原反应和PSⅡ中电子的传递来反映PSⅡ的供体侧、受体侧及PSⅡ反应中心对荧光的响应[11-12]。从图3可以看出,不同品种玫瑰的测定曲线形状一致。在O点,各品种的荧光值一致,但在I点和P点的荧光值表现为和田玫瑰>白玫瑰>云南玫瑰,云南玫瑰在I点到P点的荧光值均明显小于其他品种的玫瑰。在不同种植年限的和田玫瑰中,测定曲线形状一致。在O点,各种植年限的荧光值均一致。在I点和P点,3年和田玫瑰的荧光值明显小于其他种植年限的和田玫瑰,而4年和田玫瑰和1年和田玫瑰的测定曲线基本重合,各点的荧光值大小一致。
3 讨论
和田地区土壤类型为固定风沙土和轻盐化棕漠土,全年降水稀少,光照充足,热量丰富[13]。玫瑰为阳性植物,喜阳光充足,耐寒、耐旱,喜排水良好、疏松肥沃的壤土或轻壤土[14]。植物的光合作用不仅受到植物本身的影响,还受到外界环境因素的影响[15]。叶绿素荧光技术通过光照强度对PSⅡ结构和功能的影响来反映植物的光合能力[5-6],进而反映出不同品种玫瑰的适应性。
研究表明,在相同环境中不同植物叶绿素荧光特性不同[16],相同植物在不同光照强度下产生的叶绿素荧光特性也不同[17]。Fo是固定荧光或初始荧光产量,表示没有参加PSⅡ光化学反应部分的光能辐射,不同品种和种植年限的玫瑰在16:00时Fo达到最大,说明在16:00时光照辐射最强,植物以热的形式和荧光的形式散失能量,对光合结构造成了破坏[3],而云南玫瑰在14:00时Fo达到最大,说明云南玫瑰对该环境的光照辐射适应性较差,不同种植年限的和田玫瑰Fo日变化较小,说明该环境的光照辐射对和田玫瑰影响较小。与Fo相反,高温和高辐射造成最大荧光Fm的下降,但和田玫瑰在高温和高辐射(16:00)的情况下升高。说明植物在强辐射和高温的情况下,会通过将能量转为热量散失来保护植物的光合系统。
Fv/Fm和Fv/Fo可以反映外界环境对PSⅡ的影响[18-19],该试验中白玫瑰在16:00时Fv/Fm和Fv/Fo最低,说明白玫瑰在16:00时受到的光抑制最强,云南玫瑰和和田玫瑰在14:00时Fv/Fm和Fv/Fo最低,说明在14:00时受到的光抑制最强。不同种植年限的和田玫瑰都在16:00时受到的光抑制最强,且3年生和田玫瑰的Fv/Fm和Fv/Fo始终小于其他种植年限,说明3年生和田玫瑰比其他种植年限的和田玫瑰更易受到光抑制[20]。随着光辐射和温度的下降,不同品种的玫瑰和不同种植年限的和田玫瑰Fv/Fm和Fv/Fo都逐渐恢复到初始测量值(08:00),说明该环境造成的光抑制是可恢复的,强辐射和高温对PSⅡ反映中心的光合器官造成的损伤具有可逆性,强光和高温造成的光抑制是暂时的,这与对核桃树和一些旱生植物研究结果一致[21-22]。
ABS/RC、RC/CSo、TRo/RC、DIo/RC和Mo的变化可以反映PSⅡ中单位反应中心光能的转换和通过初级醌受体QA的电子传递情况[23]。在不同品种的玫瑰中,白玫瑰ABS/RC、RC/CSo、TRo/RC、DIo/RC和Mo的日变化幅度最大,ABS/RC、TRo/RC、DIo/RC和Mo在16:00时明显增加达到最大,说明白玫瑰PSⅡ结构更易受到高温和高辐射的影响,单位面积的反应中心数目减少,电子传递能力减弱,能量大多以热量的形式散失,减少高温和高辐射对PSⅡ系统反应中心造成的伤害[24]。不同种植年限的和田玫瑰ABS/RC、RC/CSo、TRo/RC、DIo/RC和Mo的日变化幅度较小,其中3年生和田玫瑰的变化幅度最大。说明和田玫瑰受该地高温和高辐射影响较小,在不同种植年限中,3年生的和田玫瑰更易受到外界光照和温度条件的影响。φEo、φPo和ψo荧光参数和PSⅡ中的能量分配比率有关[22]。在不同玫瑰品种中,白玫瑰日变化波动最大,说明光照强度对白玫瑰在光合过程中能量分配的影响最大,和田玫瑰φEo、φPo和ψo的日变化波动最小,说明在电子传递的量子比率和热耗散的量子比率方面的分配较稳定,和田玫瑰在该光照环境下PSⅡ结构的能量传递较稳定,适应性更强。在不同种植年限的和田玫瑰中,3年生和田玫瑰φEo、φPo和ψo的日变化波动最大,且3年生和田玫瑰ψo的变化趋势和其他种植年限的日变化趋势相反。说明3年生和田玫瑰在光照强度变化时,PSⅡ的能量分配比率最不稳定,对外界光照强度的变化最敏感。
当绿色植物暴露在可见光下时,含叶绿素的组织会发出强度不断改变的红色荧光,荧光强度随时间的变化不同,这种不同变化强度形成的曲线称为叶绿素荧光诱导动力学曲线[25]。在不同玫瑰品种中,云南玫瑰的荧光强度明显低于和田玫瑰和白玫瑰,说明云南玫瑰的荧光产量最低,接受光量子的能量最差,因此光合碳代谢速率最低[12]。在不同种植年限的和田玫瑰中,1年生和4年生和田玫瑰的叶绿素荧光动力学曲线一致,3年生和田玫瑰的荧光强度在I点和P点都明显小于其他年限种植的和田玫瑰,说明3年生和田玫瑰的荧光产量最低,接受光量子、电子从QA向QB的传递量最低[26]。
4 结论
该试验结果表明,和田玫瑰比云南玫瑰和白玫瑰更适应和田地区的光照强度和热量水平,其中3年生和田玫瑰对外界光热环境变化更为敏感,PSⅡ结构更不稳定,因此易受到光照强度和热量变化的影响。
参考文献
[1] 陈蓓雷.新疆三种独尾草属植物光合特性的研究[D].石河子:石河子大学,2008.
[2] GENTY B,BRIANTAIS J M,BAKER N R.The relationship between the quantum yield of photosynthetic electron transport and quenching of chlorophyll fluorescence [J].Biochimica et biophysica acta,1989,990(1):87-92.
[3] SCHREIBER U,BERRY J A.Heat-induced changes of chlorophyll fluorescence in intact leaves correlated with damage of the photosynthetic apparatus [J].Planta,1977,136(3):233-238.
[4] 赵长明,王根轩.干旱胁迫对沙冬青叶片防御光破坏机制的影响[J].植物学报,2002,44(11):1309-1313.
[5] BAKER N R.A possible role for photosystem II in environmental perturbations of photosynthesis [J].Physiologia plantarum,1991,81(4):563-570.
[6] 宋春雨,刘晓冰,金彩霞.高温胁迫下光合器官受损及其适应机理[J].农业系统科学与综合研究,2002,18(4):252-256.
[7] 岳泽伟,李成道,李磊,等.骆驼刺叶形态和荧光参数对光照的响应[J].干旱区研究,2020,37(3):722-728.
[8] SAYED O H.Chlorophyll fluorescence as a tool in cereal crop research [J].Photosynthetica,2003,41(3):321-330.
[9] 张璐,季巧遇,吕红.玫瑰花概述及研究进展[J].江西中医药,2012,43(1):64-66.
[10] 孙永民.和田玫瑰种植产业发展现状分析[J].新疆农业科技,2014(3):36-37.
[11] MAXWELL K,JOHNSON G N.Chlorophyll fluorescence-A practical guide [J].Journal of experimental botany,2000,51:659-668.
[12] KRAUSE G H,WEIS E.Chlorophyll fluorescence and photosynthesis:The basics [J].Annual review of plant physiology & plant molecular biology,1991,42(1):313-349.
[13] 玉苏甫·阿布都拉,马宏武,买买提·阿布都拉,等.和田河流域气候变化特征分析[J].气象,2006,32(4):97-100.
[14] 张海云,孟宪水,李凤英.玫瑰、月季与蔷薇的区别[J].花木盆景(花卉园艺),2006(6):22-23.
[15] SOFO A,DICHIO B,MONTANARO G,et al.Photosynthetic performance and light response of two olive cultivars under different water and light regimes [J].Photosynthetica,2009,47(4):602-608.
[16] 李西文,陈士林.遮荫下高原濒危药用植物川贝母(Fritillaria cirrhosa)光合作用和叶绿素荧光特征[J].生态学报,2008,28(7):3438-3446.
[17] 敖金成,苏文华,张光飞,等.不同光强下对马耳蕨叶绿素荧光参数的日变化[J].南京林业大学学报(自然科学版),2011,35(1):135-138.
[18] 李磊,李向义,林丽莎,等.两种生境条件下6种牧草叶绿素含量及荧光参数的比较[J].植物生态学报,2011,35(6):672-680.
[19] 张静,张元明.冻融过程对生物结皮中齿肋赤藓叶绿素荧光特性的影响[J].中国沙漠,2011,31(6):1479-1487.
[20] 姚春娟,郭圣茂,陈兰兰,等.草决明叶绿素荧光特性的秋季日变化[J].农业与技术,2015,35(20):27-28.
[21] 周玉霞,巨天珍,王引弟,等.3种旱生植物的叶绿素荧光参数日变化研究[J].干旱区资源与环境,2019,33(5):164-170.
[22] 贾浩,郝建博,曹洪波,等.遮荫对‘保佳红’桃树叶片快速叶绿素荧光诱导动力学曲线的影响[J].西北植物学报,2015,35(9):1861-1867.
[23] 高玉,高志奎,张晓慧,等.通过快速荧光动力学曲线探测白黄瓜光系统Ⅱ的热激胁迫效应[J].生态学报,2009,29(6):3335-3341.
[24] 杨建伟,赵丹,孙桂芳,等.干旱胁迫对小紫珠光合生理的影响[J].西北植物学报,2018,38(4):733-740.
[25] 李鵬民,高辉远,STRASSER R J.快速叶绿素荧光诱导动力学分析在光合作用研究中的应用[J].植物生理与分子生物学学报,2005,31(6):559-566.
[26] STRASSER B J,STRASSER R J.Measuring fast fluorescence transients to address environmental questions:The JIP-Test [M]/MATHIS P.Photosynthesis:From light to biosphere.Dordrecht:Kluwer Academic Publishers,1995:977-980.
