环状RNA CCDC109B对非小细胞肺癌细胞增殖和迁移的影响▲
2022-02-13张叶李霞
张 叶 李 霞
(辽宁省肿瘤医院放疗科,辽宁省沈阳市 110042)
肺癌是呼吸系统最常见也是预后最差的恶性肿瘤,2020年肺癌死亡病例数在所有癌症中位居首位[1]。肺癌根据病理学分型可分为小细胞肺癌和非小细胞肺癌(non-small cell lung cancer,NSCLC)两大类,其中NSCLC占比超过85%[2]。NSCLC发病早期的临床表现具有多样性,故其早期诊断率不高,很多患者在就诊时已处于肿瘤晚期,预后不佳[3]。NSCLC的快速生长和远处转移是治疗的难点[4]。因此,寻找与NSCLC发生和发展密切相关的新型分子生物学标志物并明确其在NSCLC中的作用,具有十分重要的意义。
环状RNA(circular RNA,circRNA)是目前研究的热点,由于其特殊的闭合环状结构和超高的稳定性,circRNA在NSCLC发生和发展过程中发挥了重要的调控作用[5]。例如,circFGFR1是一种circRNA,circFGFR1在NSCLC组织和细胞系中表达增高,circFGFR1可通过吸附miR-381-3p的方式促进C-X-C趋化因子受体4诱导NSCLC细胞迁移、侵袭、增殖和免疫逃逸[6]。本研究通过GEO2R在线软件分析GEO数据库中NSCLC相关数据集GSE158695以筛选差异表达的circRNA,并选取其中倍数变化(fold change,FC)最为明显的circRNA,即circCCDC109B(circBase ID:hsa_circ_0070659;探针ID:ASCRP004014)进行初步研究,探讨其对NSCLC细胞增殖和迁移的影响。
1 材料与方法
1.1 材料 人正常支气管上皮细胞株16HBE、人NSCLC细胞株A549和H1299均购自中科院上海细胞库。气道上皮细胞基础培养基(美国ATCC公司,批号:CAT NO.YB-H010),DMEM及胎牛血清(Gibco公司,批号:CAT NO.11966-025、CAT NO.16140-089),TRIzol试剂盒及LipofectamineTM3000试剂盒(Invitrogen公司,批号:CAT NO.15596-026、CAT NO.L3000-008),GoscriptTM反转录试剂盒及GoTaq®qPCR试剂盒(美国Promega公司,批号:CAT NO.A5003、CAT NO.A6102)。引物由生工生物工程(上海)股份有限公司设计并合成;特异性circCCDC109B小干扰RNA sicirc-1和sicirc-2,以及阴性对照小干扰RNA siNC均由广州市锐博生物科技有限公司设计并合成;6-羟基荧光素琥珀酰亚胺酯标记的特异性circCCDC109B寡聚核苷酸探针由上海吉玛制药技术有限公司设计并合成。
1.2 实验方法
1.2.1 GEO2R在线软件分析GEO数据库中NSCLC相关数据集:以circRNA和NSCLC为关键词,从GEO数据库(https://www.ncbi.nlm.nih.gov/geo/)中搜索NSCLC相关数据集文件,选定数据集GSE158695(https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc= GSE158695)作为分析对象。按照GEO2R在线软件的说明分别设定癌旁组织组(n=3)和NSCLC组(n=3)并进行在线分析,下载差异表达的circRNA的表达文件,再以校正P值<0.01且|log2FC|≥1.5为筛选标准,筛选差异表达的circRNA。
1.2.2 细胞培养:将人正常支气管上皮细胞株16HBE培养于气道上皮细胞基础培养基,将人NSCLC细胞株A549和H1299培养于DMEM,并置于含有5% CO2的37 ℃恒温培养箱中培养,当细胞生长至融合率为70%~80%时,以0.25%胰蛋白酶消化,并按1∶3比例进行传代。以上两种培养基均添加10%胎牛血清、100 μg/mL青霉素和0.1 mg/mL链霉素。
1.2.3 细胞分组及转染:取对数生长期的A549和H1299细胞,弃去培养基,PBS清洗3次(3 min/次)后加入0.25%胰蛋白酶消化3 min,用DMEM终止消化后,按2×105个细胞/孔的密度将细胞接种于6孔板,并随机分为阴性对照小干扰RNA转染组(siNC组)、1# circCCDC109B小干扰RNA转染组(sicirc-1组)和2# circCCDC109B小干扰RNA转染组(sicirc-2组),转染6 h后,弃去转染试剂,更换为完全培养基继续培养。次日细胞贴壁生长至融合率为50%时,按照LipofectamineTM3000试剂盒说明书将sicirc-1、sicirc-2或siNC转染至A549和H1299细胞内。转染48 h后进行后续的实验。sicirc-1序列为5′-GCCATCTTCACAGCAGGTTTT-3′,sicirc-2序列为5′-ACAGCAGGTTTTGCGTGTGAA-3′,siNC序列为5′-UUCUCCGAACGUGUCACGUTT-3′。
1.2.4 RNase R酶处理及实时荧光定量PCR检测circCCDC109B的表达水平[7]:取人NSCLC细胞株A549和H1299细胞、人正常支气管上皮细胞株16HBE细胞,以及1.2.3各组转染48 h后的细胞,按照TRIzol试剂盒说明书提取总RNA,在提取的总RNA中加入RNase R酶(3 U/1 000 ng),37 ℃孵育10 min以消化线性RNA。按照GoscriptTM反转录试剂盒说明书将RNA反转录合成cDNA,反应条件为70 ℃变性5 min,25 ℃退火5 min,42 ℃延伸60 min,70 ℃灭活15 min,4 ℃冷却。按照GoTaq®qPCR试剂盒说明书进行实时定量PCR。反应体系包括上游引物0.5 μL、下游引物0.5 μL、cDNA 1 μL、RNase-free水8 μL,总体积为10 μL。circCCDC109B上游引物序列为5′-GTTGGTTCATTCCTTCAGGACC-3′,下游引物序列为5′-AGGTGGCACCACGGTACTAT-3′。PCR反应条件:95 ℃(30 s)预变性;94 ℃(5 s)变性;95℃(15 s)→60 ℃(34 s)退火、延伸,40个循环;95 ℃(15 s)→60 ℃(1 min)→95 ℃(15 s)。以β-actin为内参(上游引物序列为5′-CTTCTACAATGAGCTGCGTG-3′,下游引物序列为5′-TCATGAGGTAGTCAGTCAGG-3′),采用2-ΔΔCt法计算circCCDC109B的相对表达水平。实验重复3次。
1.2.5 免疫荧光原位杂交检测circCCDC109B的差异表达[8]:收集2019年3月至2019年4月辽宁省肿瘤医院收治的3例行肿瘤切除术的NSCLC患者的肿瘤组织及对应的癌旁组织标本,常规清洗、脱水、石蜡包埋固定,制成厚度为5 μm的切片;常规70%、85%和100%乙醇梯度脱水,20 μg/mL蛋白酶K消化5 min、PBS清洗3次(3 min/次);预杂交液37 ℃孵育1 h后加入含有6-羟基荧光素琥珀酰亚胺酯标记的circCCDC109B寡聚核苷酸探针的杂交液37 ℃孵育过夜;次日,弃去杂交液,依次行2×柠檬酸钠缓冲液(saline sodium citrate buffer,SSC)37 ℃洗10 min,1×SSC 37 ℃洗5 min,0.5×SSC室温洗10 min;滴加DAPI染液复染,避光孵育8 min,用PBS冲洗3 min后滴加抗荧光淬灭封片剂封片,置于荧光显微镜下观察并拍照。实验重复3次。
1.2.6 克隆形成实验检测A549和H1299细胞增殖能力[9]:取1.2.3各组转染48 h后的细胞,采用0.25%胰蛋白酶消化3 min后接种于6孔板中(接种密度为1×103个细胞/孔),并置于37 ℃、5% CO2细胞培养箱中培养1周。1周后用PBS清洗2次(3 min/次),采用4%多聚甲醛固定15 min,再用0.5%结晶紫染色15 min,置于显微镜下观察拍照,并随机选取3个视野计算克隆形成数目(以包含50个以上细胞为1个克隆)。实验重复3次。
1.2.7 Transwell实验检测A549和H1299细胞迁移能力[10]:取1.2.3各组转染48 h后的细胞,采用0.25%胰蛋白酶消化3 min后,调整细胞计数为1.5×104个并接种于Transwell小室上室内,加入100 μL含10% 胎牛血清的DMEM;Transwell小室下室内加入500 μL含20%胎牛血清的DMEM,37 ℃、5% CO2孵育48 h。取出Transwell小室,棉签擦去Transwell小室内部细胞,用PBS冲洗3 min,4%多聚甲醛固定15 min,0.5%结晶紫染色15 min,置于倒置显微镜下观察Transwell小室下层细胞并随机选取3个视野进行计数。实验重复3次。
1.3 统计学分析 采用SPSS 19.0软件进行统计学分析。计量资料以(x±s)表示,多组间比较采用方差分析,进一步两两比较采用LSD-t检验。以P<0.05为差异具有统计学意义。
2 结 果
2.1 在数据集GSE158695中差异表达的circRNA NSCLC相关数据集GSE158695中差异表达的circRNAs见图1。相较于癌旁组织,在NSCLC癌组织中差异表达的circRNA共有55个,其中表达上调的circRNA有51个,表达下调的circRNA有4个;其中又以circCCDC109B(circBase ID:hsa_circ_0070659,探针ID:ASCRP004014)的上调倍数最明显(log2FC=4.25),见表1。
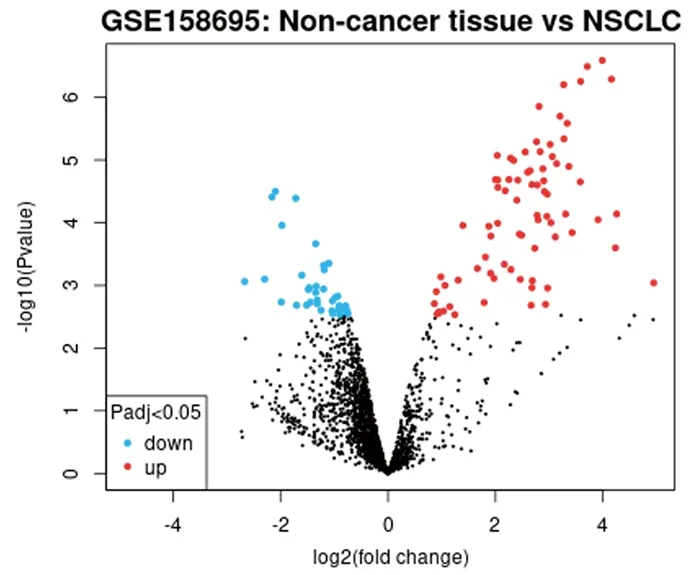
图1 数据集GSE158695中差异表达的circRNA
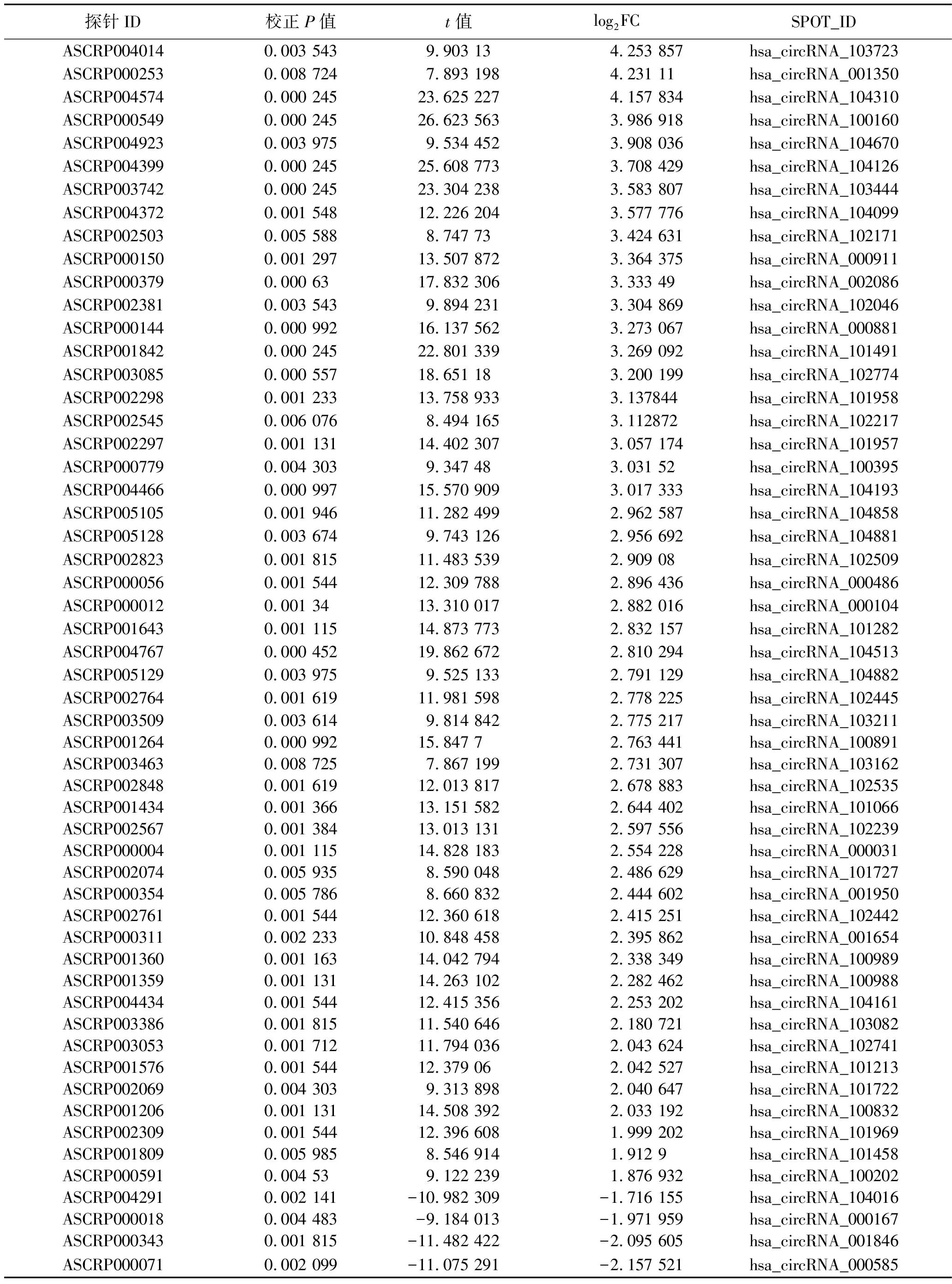
表1 NSCLC中差异表达的circRNA
2.2 circCCDC109B在NSCLC组织及细胞系中的表达情况 免疫荧光原位杂交染色结果显示,circCCDC109B在NSCLC癌组织中的表达水平高于癌旁组织,见图2A。实时荧光定量PCR结果显示,circCCDC109B在NSCLC细胞系A549和H1299中的表达水平均高于人支气管上皮细胞系16HBE(P<0.05),见表2。与其母基因线粒体钙单向转运体显性负亚基β(mitochondrial calcium uniporter dominant negative subunit beta,CCDC109B)比较,circCCDC109B由CCDC109B前体RNA的2号和3号外显子环化形成,见图2B。
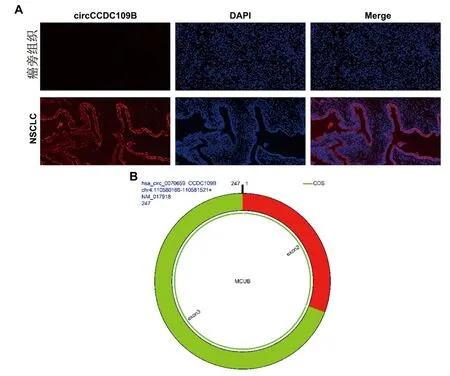
图2 circCCDC109B在NSCLC组织中的表达情况及其环形结构
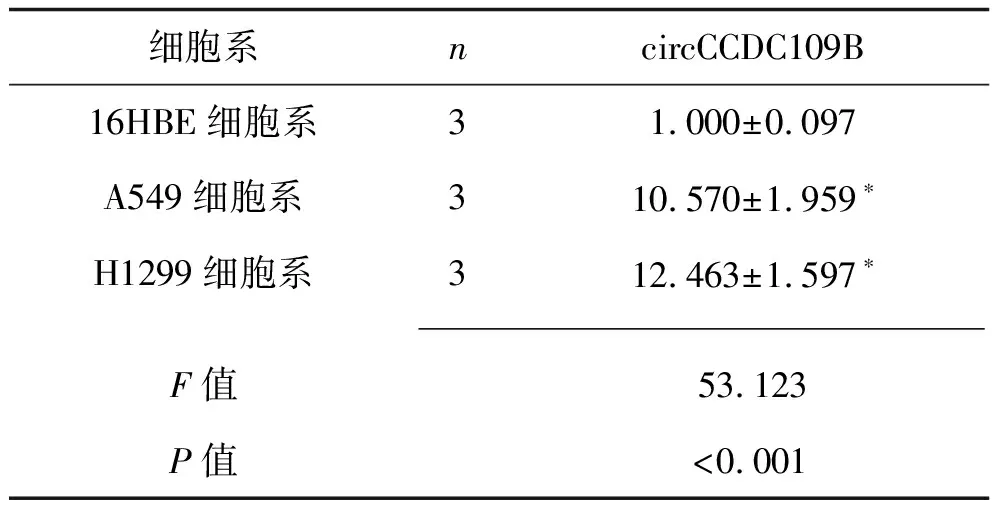
表2 NSCLC细胞系和人支气管上皮细胞系中circCCDC109B相对表达水平的比较(x±s)
2.3 下调circCCDC109B表达对A549细胞和H1299细胞增殖、迁移的影响 相比于siNC组,sicirc-1组和sicirc-2组A549细胞和H1299细胞内的circCCDC109B表达水平降低(P<0.05),见表3,提示转染成功。克隆形成实验结果显示,相比于siNC组,sicirc-1组和sicirc-2组A549细胞和H1299细胞的克隆形成数减少(P<0.05),见表3。Transwell迁移实验结果显示,相比于siNC组,sicirc-1组和sicirc-2组A549细胞和H1299细胞的迁移能力降低(P<0.05),见表3和图3。
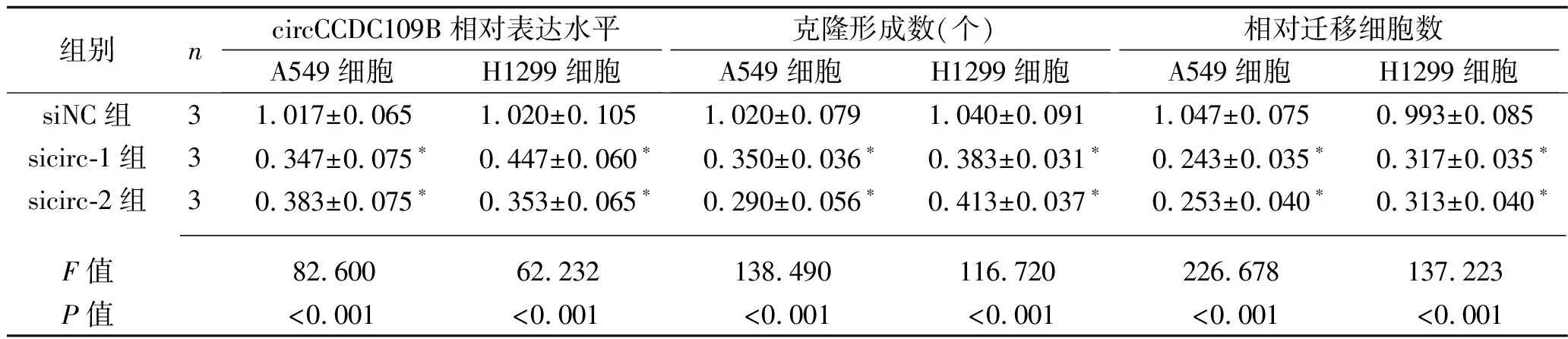
表3 3组A549和H1299细胞circCCDC109B相对表达水平、克隆形成数和迁移能力的比较(x±s)
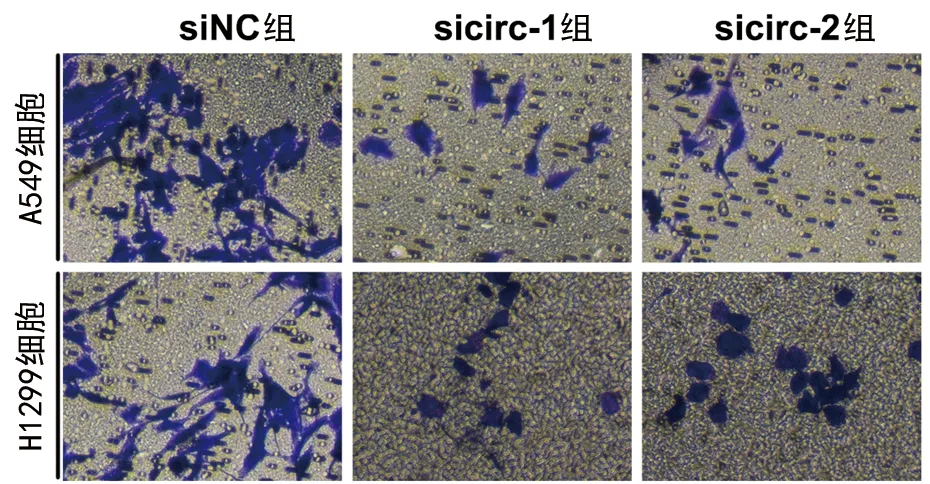
图3 下调circCCDC109B表达对A549细胞和H1299细胞迁移的影响
3 讨 论
随着高通量测序技术的不断进步,越来越多的非编码RNA种类被发现,如高度保守性的微小RNA、转录超保守的circRNA及在物种间缺少保守性的长链非编码RNA等[11-13]。这类非编码RNA缺少转录功能或者具有非常有限的蛋白质编码能力[14]。与线性的信使RNA和长链非编码RNA不同,circRNA缺乏线性的多聚腺苷酸尾巴而呈现一种闭合环状结构[15]。随着RNA测序技术的快速发展,越来越多的新的circRNA被发现,它们在多种疾病中的表达和功能也受到了越来越多的关注[16-17]。
circRNA在多种肿瘤性疾病中表达,且通过调控细胞周期、细胞增殖和凋亡、细胞侵袭和迁移、细胞耐药等参与肿瘤发生和发展[18-23]。circCCDC109B位于人染色体4q25正义链上,是由CCDC109B前体RNA的2号和3号外显子环化形成,其基因组长度为1 355 bp,剪切后的长度为237 bp,位于基因组的chr4:110580167-110581521。目前关于circCCDC109B的研究鲜见报告。本研究通过GEO2R在线软件对circCCDC109B进行分析,发现相比于癌旁组织,circCCDC109B在NSCLC组织中的表达水平明显增高(P<0.05)。进一步行免疫荧光原位杂交染色和实时荧光定量PCR实验,结果显示,circCCDC109B在NSCLC组织和细胞系中的表达水平均上调(均P<0.05),提示circCCDC109B可能参与NSCLC的发生。
研究显示,多个circRNA均参与NSCLC的增殖和侵袭转移。如Zhang等[24]发现,circSATB2在NSCLC组织和细胞系中表达增加,且circSATB2可通过外泌体转运的方式自分泌到周围的细胞并吸附miR-326,促进肌动蛋白交联蛋白同源体1的表达,从而促进NSCLC细胞的增殖、侵袭和转移。本研究采用转染circCCDC109B特异性小干扰RNA的方法构建circCCDC109B低表达的细胞模型,并通过功能缺失性细胞增殖实验(克隆形成实验)和细胞迁移实验(Transwell实验)观察下调circCCDC109B表达对NSCLC细胞系A549和H1299增殖和迁移能力的影响。结果显示,相比于siNC组,sicirc-1组和sicirc-2组A549细胞和H1299细胞的克隆形成数减少、迁移能力降低(P<0.05),说明下调circCCDC109B的表达可抑制A549细胞和H1299细胞系的增殖和迁移能力,这提示circCCDC109B可能作为癌基因参与NSCLC的进展。
综上所述,NSCLC组织和细胞系中circCCDC109B表达上调,下调circCCDC109B的表达可以抑制NSCLC细胞的增殖和迁移。但肿瘤的发生和发展是一个涉及多因素的复杂过程,包括细胞黏附力减弱、细胞外基质降解、细胞迁移、新生血管形成等多个病理学改变,本研究只是初步分析circCCDC109B在NSCLC中的表达及部分生物学功能,其具体作用机制仍需进一步深入探讨。
