紫娟茶中甲基化儿茶素提取工艺优化
2022-02-13李宇倩高创创李明超李晓蕾
李宇倩 高创创 李明超 李晓蕾 郝 倩
(1. 昆明理工大学生命科学与技术学院,云南 昆明 650500; 2. 昆明理工大学分析测试研究中心,云南 昆明 650500)
紫娟茶是一种芽、叶、茎均为紫色的茶树品种,为普洱茶的一个重要变种[1]。紫娟茶具有明显的降压及抗敏作用[2],且含有丰富的化学成分,如儿茶素类[3-4]、花青素类[5]、色素[6]及微量元素[7]等。前期研究[8]表明,紫娟茶中含有甲基化儿茶素类成分。甲基化儿茶素是最早被日本科学家[9]从绿茶品种Benihomare中分离得到,是具有显著抗过敏、消炎、降血压等效果的新型化合物[10]。Sano等[11-12]分别从台湾冻顶乌龙、绿茶Benihomare中先后分离得到EGCG3"Me和EGCG4"Me,且EGCG3"Me在动物血液中的稳定性显著高于未甲基化的EGCG,其口服吸收率约为EGCG的9倍[13],这可能是由于甲基化后的儿茶素脂溶性增加,总体脂溶量和吸收率均高于正常儿茶素,其生物利用度也有很大程度提高[14]。此外,茶树秋冬季鲜叶中的甲基化儿茶素含量高于春夏季,且随叶片成熟度的提高而升高[15]。吕海鹏等[16]研究表明紫娟茶第三叶的EGCG3"Me成分含量最高并达到1.24%。目前关于儿茶素提取工艺优化的研究多以提取时间、提取温度、溶液含水率等为影响因素,通过响应面法对儿茶素提取工艺进行优化[17-18]。但有关甲基化儿茶素的提取工艺研究甚少[13]。
试验前期,从云南产紫娟茶中分离得到的两个甲基化儿茶素EGCG3"Me和ECG3"Me结构如图1所示。试验拟采用HPLC和响应面分析法优化紫娟茶中甲基化儿茶素成分的提取工艺,采用Design-Expert 8.0.6软件对数据进行分析并建立分析模型,明确提取时间、提取温度和料液比3个因素对紫娟茶中甲基化儿茶素(EGCG3"Me和ECG3"Me)提取质量分数的交互影响,以期为该茶树品种开发新功能性饮料及保健食品的发展提供依据。
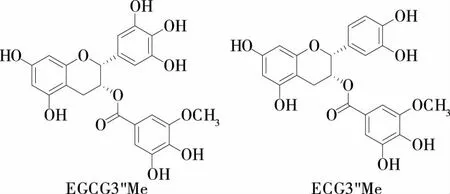
图1 EGCG3"Me和ECG3"Me结构
1 材料与方法
1.1 试验材料、试剂与仪器
紫娟茶:2010年,产地云南邦东;
EGCG3"Me、ECG3"Me标准品:纯度为95%,昆明理工大学云南省高校靶点药物筛选与利用重点实验室自制;
无水甲醇、无水乙醇:分析纯,天津致远化学试剂有限公司;
三氟乙酸:分析纯,重庆川东化学试剂厂;
乙腈:色谱纯,美国BCR试剂公司;
电子天平:CP64C型,奥豪斯仪器(上海)有限公司;
高效液相色谱:U-3000型,戴安(中国)有限公司;
电热恒温水浴锅:SB-1200型,上海爱朗仪器有限公司。
1.2 试验方法
1.2.1 标准样品制备及标准曲线绘制 参照孙业良等[13-14,19-20]的方法。HPLC条件:Welchrom C18色谱分析柱(4.6 mm×250 mm, 5 μm);乙腈(A)—50 mmol/L磷酸(B)为流动相,4%~100%梯度洗脱,洗脱时间60 min,流速1.0 mL/min,柱温30 ℃,波长280 nm。
1.2.2 精密度试验 取混合标准品液6份,按1.2.1的HPLC条件分别进样6次,计算EGCG3"Me和ECG3"Me峰面积的相对标准偏差(RSD)。
1.2.3 重复性试验 选取供试品溶液6份,按1.2.1的HPLC条件连续进样6次,计算EGCG3"Me和ECG3"Me峰面积。
1.2.4 稳定性试验 选取供试品溶液1份,配制后避光冷藏0,2,4,6,8,12 h,按1.2.1的HPLC条件进样,计算EGCG3"Me和ECG3"Me的RSD值。
1.2.5 回收率试验 选取已确定浓度的含有EGCG3"Me的样品6份,各加入0.1 mg EGCG3"Me标品,按样品质量分数测定方法进行处理和测定;取已确定浓度的含有ECG3"Me的样品6份,加入0.1 mg ECG3"Me标准品,按样品质量分数测定方法处理和测定,计算样品的平均加样回收率。
1.2.6 单因素试验
(1) 提取溶剂:准确称取1.00 g紫娟茶样品,浸泡于50 mL溶液中,分别以酸性甲醇(1% TFA)、酸性乙醇(1% TFA)、水、酸性水(1% TFA)、酸性甲醇水(1% TFA)、酸性乙醇水(1% TFA)为提取溶剂, 60 ℃提取60 min,重复提取3次,取上清经微孔滤膜后进行HPLC分析,考察提取溶剂对浸提液中甲基化儿茶素(EGCG3"Me和ECG3"Me)质量分数的影响。
(2) 提取时间:精确称取1.00 g紫娟茶样品,浸泡于50 mL溶液中,以酸性乙醇(1% TFA)为溶剂,60 ℃下分别提取20,40,60,80,100,120 min,重复提取3次,取上清经微孔滤膜后进行HPLC分析,考察提取时间对浸提液中甲基化儿茶素(EGCG3"Me和ECG3"Me)质量分数的影响。
(3) 提取温度:精确称取1.00 g紫娟茶样品,浸泡于50 mL溶液中,以酸性乙醇(1% TFA)为溶剂,提取温度分别为30,40,50,60,70,80 ℃,提取时间为100 min,重复提取3次,取上清液经微孔滤膜过滤后进行HPLC分析,考察提取温度对浸提液中甲基化儿茶素(EGCG3"Me和ECG3"Me)质量分数的影响。
(4) 料液比:精确称取1.00 g紫娟茶样品,以酸性乙醇(1% TFA)为溶剂,料液比分别为(m紫娟茶∶V溶剂)1∶10,1∶20,1∶30,1∶40,1∶50,1∶60 (g/mL),70 ℃提取100 min,重复提取3次,取上清液经微孔滤膜过滤后进行HPLC分析,考察料液比对浸提液中甲基化儿茶素(EGCG3"Me和ECG3"Me)质量分数的影响。
1.2.7 响应面试验优化 参照高晶晶等[21]的方法,根据单因素试验结果确定响应面试验的因素水平取值,采用Box-Behnken设计,以浸提液中甲基化儿茶素(EGCG3"Me和ECG3"Me)质量分数为响应值,优化紫娟茶中甲基化儿茶素提取工艺条件。
2 结果与分析
2.1 紫娟茶中甲基化儿茶素含量HPLC分析方法的建立
2.1.1 标准曲线制作 以不同浓度梯度ECG3"Me和EGCG3"Me两个标品的HPLC峰面积作纵坐标,两个标品浓度 (mg/mL) 为横坐标,计算标准曲线线性回归方程分别为Y=3 204.94X-36.94,Y=2 911.45X-25.65,且两种标品在0~3 mg/mL时,质量浓度与峰面积表现出显著线性关系,其R2分别为0.999 60和0.999 86。
2.1.2 精密度试验 经测定,EGCG3"Me和ECG3"Me峰面积的相对标准偏差(RSD)分别为1.43%,1.59%,均在2%之内,说明试验方法的精密度良好。
2.1.3 重复性试验 经测定,EGCG3"Me和ECG3"Me峰面积的RSD分别为0.49%,1.48%,均在2%之内,说明此方法的重复性良好。
2.1.4 稳定性试验 经测定,EGCG3"Me和ECG3"Me峰面积的RSD值分别为0.48%,1.58%,说明供试品的溶液在12 h内稳定。
2.1.5 回收率试验 通过回收率试验的考察,样品的平均加样回收率分别为94.5%,92.5%,说明该方法有较好的回收率。
2.2 单因素试验
2.2.1 提取溶剂 由图2可知,以酸性乙醇为提取溶剂时,浸提液中EGCG3"Me质量分数达最大值;以酸性甲醇为提取溶剂时,浸提液中ECG3"Me质量分数达最大值。从甲基化儿茶素(EGCG3"Me和ECG3"Me)的提取质量分数来看,酸性乙醇的提取质量分数可达14.755 mg/g,70%酸性甲醇的次之,水溶剂提取的最小。因此试验选取酸性乙醇作为提取溶剂。酸性乙醇中甲基化儿茶素(EGCG3"Me和ECG3"Me)提取质量分数最高,可能是因为甲基化儿茶素比非甲基化儿茶素的脂溶性更强。
2.2.2 提取时间 由图3可知,随着提取时间的延长,EGCG3"Me、ECG3"Me以及甲基化儿茶素(EGCG3"Me和ECG3"Me)质量分数均先变大后减小,且均在100 min时达最大值,此时甲基化儿茶素(EGCG3"Me和ECG3"Me)质量分数为5.663 mg/g。因此选取100 min为最佳提取时间。这可能是甲基化儿茶素起初会随时间的延长,浸出物增加,呈上升趋势,经过一段时间的累积,甲基化儿茶素的浸出量接近饱和,且甲基化儿茶素会随着时间的延长存在部分降解的现象,从而呈下降趋势。
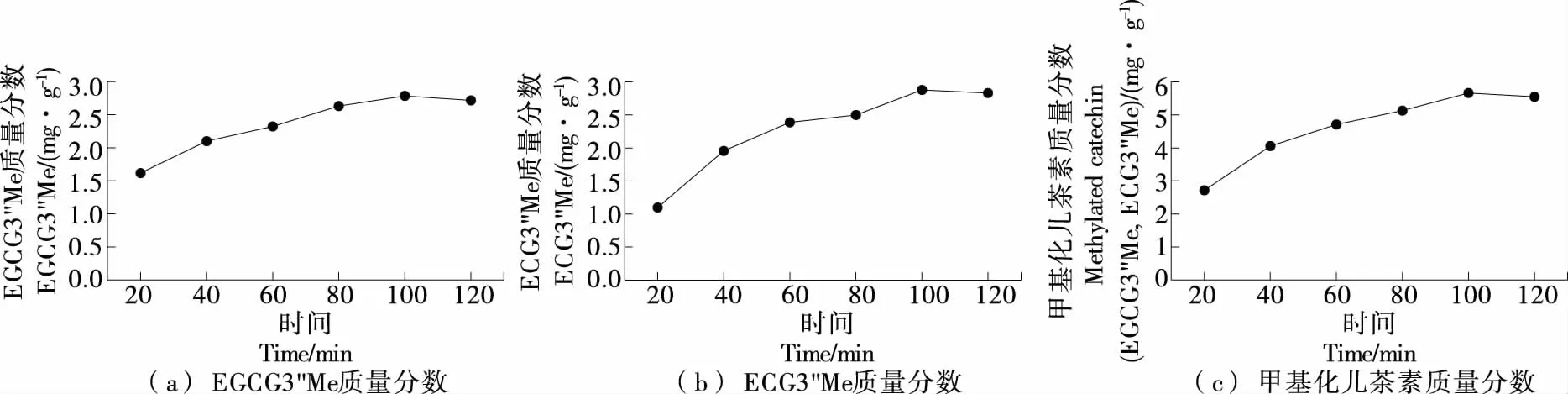
图3 提取时间对甲基化儿茶素质量分数的影响
2.2.3 提取温度 由图4可知,随着提取温度的升高,物质扩散系数增大,浸出量增大,EGCG3"Me、ECG3"Me以及甲基化儿茶素(EGCG3"Me和ECG3"Me)质量分数均增加,当提取温度>60 ℃时,EGCG3"Me、ECG3"Me以及甲基化儿茶素(EGCG3"Me和ECG3"Me)质量分数上升趋势均趋于平缓当提取温度为60 ℃时,甲基化儿茶素(EGCG3"Me和ECG3"Me)质量分数为15.467 mg/g;当提取温度为70 ℃时,甲基化儿茶素(EGCG3"Me和ECG3"Me)质量分数为17.177 mg/g,提取质量分数明显提高;当提取温度为80 ℃时,甲基化儿茶素(EGCG3"Me和ECG3"Me)质量分数为19.605 mg/g,虽然有增长的趋势但较平缓,且乙醇的沸点为78.5 ℃,随着提取温度的升高,乙醇会因沸腾而造成挥发,影响溶剂对紫娟茶的浸提作用。因此,确定最佳的提取温度为70 ℃。
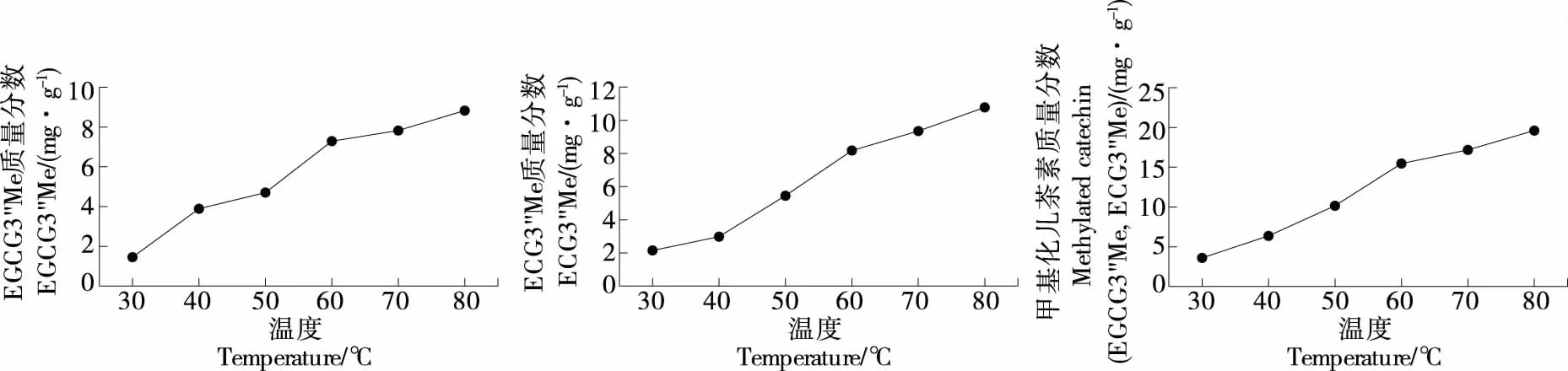
图4 提取温度对甲基化儿茶素质量分数的影响
2.2.4 料液比 由图5可知,随着料液比的增加,EGCG3"Me、ECG3"Me以及甲基化儿茶素(EGCG3"Me和ECG3"Me)质量分数上升,且当料液比(m紫娟茶∶V溶剂)>1∶70 (g/mL)后上升趋势较平稳。但就甲基化儿茶素(EGCG3"Me和ECG3"Me)质量分数来看,当料液比(m紫娟茶∶V溶剂)为1∶10~1∶70 (g/mL),甲基化儿茶素(EGCG3"Me和ECG3"Me)质量分数逐渐升高,当料液比(m紫娟茶∶V溶剂)为1∶70~1∶90 (g/mL)时,甲基化儿茶素质量分数虽有增高但趋于平缓,考虑其经济效益,选择1∶70 (g/mL)作为最优料液比。
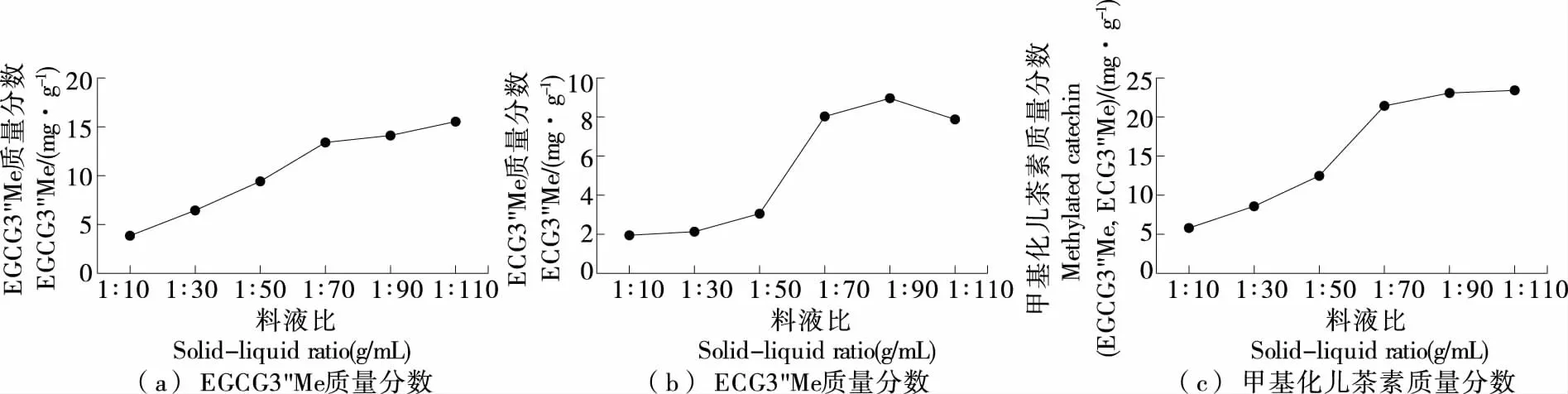
图5 料液比对甲基化儿茶素质量分数的影响
2.3 响应面分析法优化工艺结果
2.3.1 响应面模型构建 基于单因素试验结果,选取提取时间、提取温度和料液比为试验因素,以浸提液中甲基化儿茶素(EGCG3"Me和ECG3"Me)质量分数为响应值,采用Design-Expert 8.0.6软件辅助设计三因素三水平的响应面分析试验。试验因素水平见表1,试验设计及结果见表2。

表1 响应面因素水平
对表2试验数据进行多元回归分析,经拟合得到甲基化儿茶素(EGCG3"Me和ECG3"Me)质量分数的二次多项回归方程为:
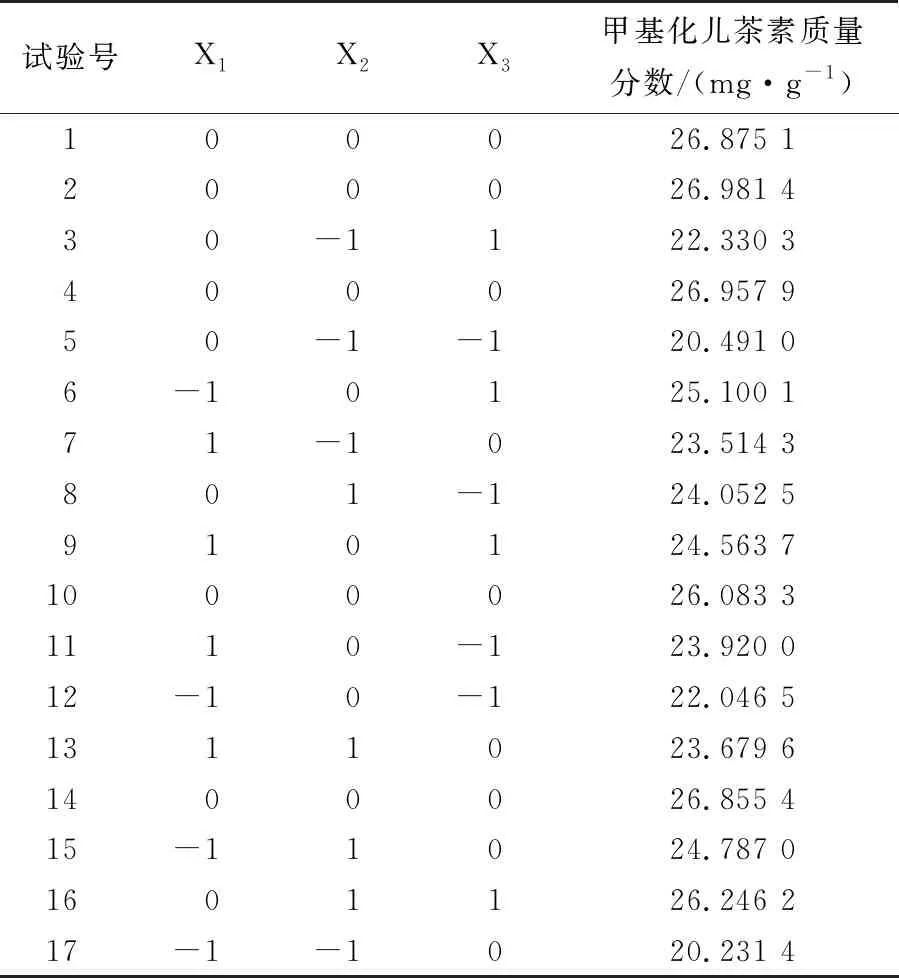
表2 响应面试验设计方案及结果
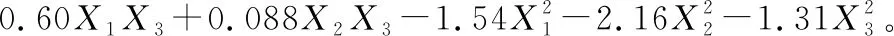
(1)
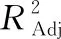

表3 回归方程的方差分析†
2.3.3 响应面曲面分析 由图5可知,提取时间与料液比交互作用的曲面相对较陡,因此提取温度对用酸性乙醇提取甲基化儿茶素(EGCG3"Me和ECG3"Me)质量分数的影响显著性最强;料液比对甲基化儿茶素(EGCG3"Me和ECG3"Me)质量分数的影响次之。在图6(b)和图6(d)中,随提取时间增加儿茶素质量分数呈现先增大后减小的趋势,提取时间在110 min左右出现最大值;在图6(d)和图6(f)中,随着料液比增大儿茶素质量分数先快速增加后趋于平缓;在图6(b)和图6(f)中,随着提取温度升高儿茶素质量分数呈现先增大后减小的趋势,提取温度在75 ℃左右出现最大值。根据响应面优化模型可预测紫娟茶中甲基化儿茶素(EGCG3"Me和ECG3"Me)提取的最优条件为以酸性乙醇为提取溶剂,提取时间100 min、提取温度75 ℃、料液比(m紫娟茶∶V溶剂)1∶74 (g/mL),此时浸提液中甲基化儿茶素(EGCG3"Me和ECG3"Me)质量分数理论值为27.1 mg/g。
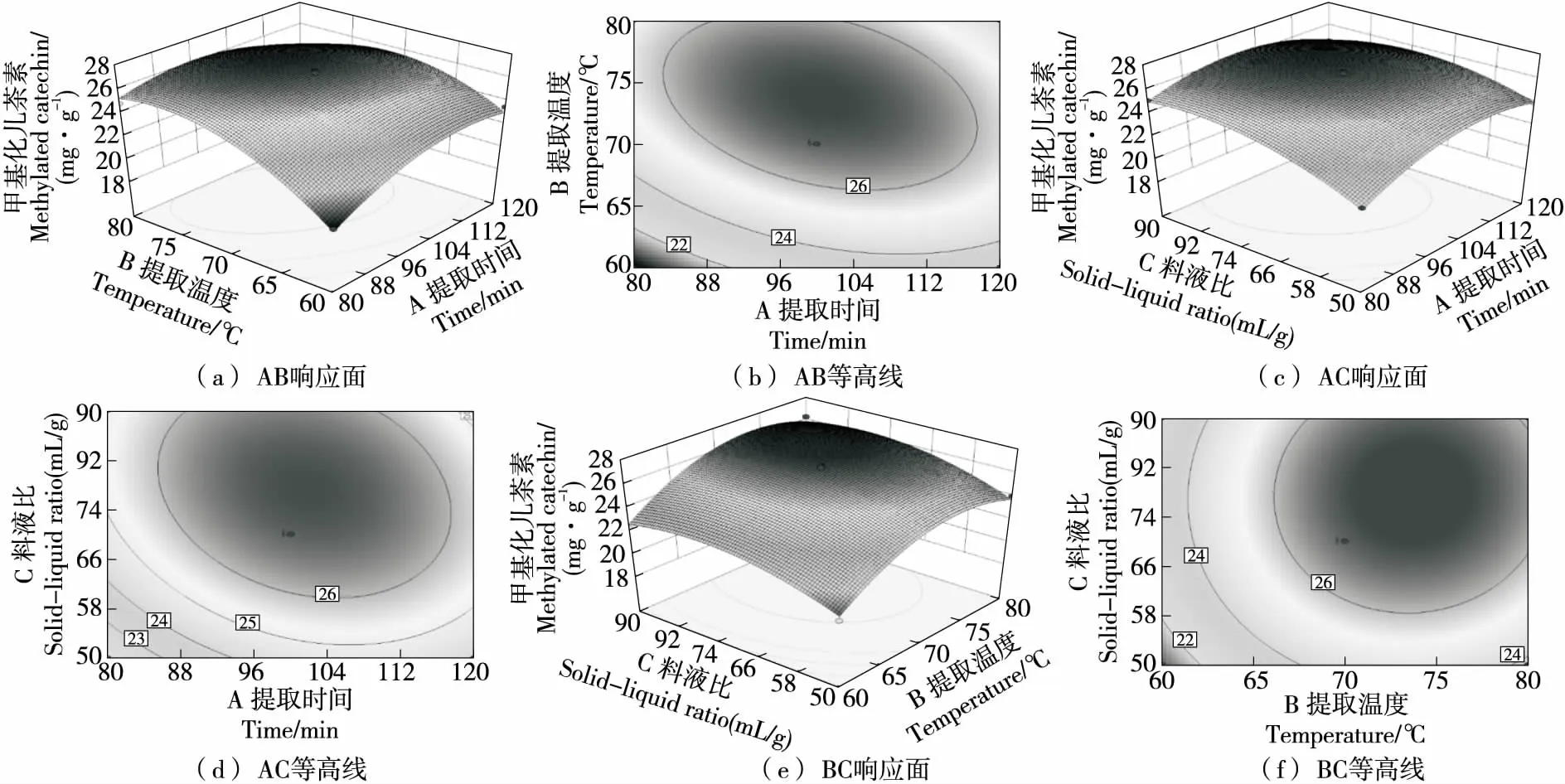
图6 各因素交互作用的等高线和响应面图
2.3.4 验证实验 根据响应面优化所得最优提取条件进行3次平行实验,测定浸提液中EGCG3"Me质量分数平均值为13.4 mg/g,ECG3"Me质量分数平均值为13.3 mg/g,甲基化儿茶素(EGCG3"Me和ECG3"Me)质量分数平均值为26.7 mg/g。甲基化儿茶素(EGCG3"Me和ECG3"Me)质量分数与理论预测值的相对误差为1.48%,说明该回归模型优化的工艺组合是有效的。
3 结论
建立了紫娟茶中甲基化儿茶素含量的HPLC分析方法,并对其提取工艺进行了优化。结果表明,紫娟茶中甲基化儿茶素(EGCG3"Me和ECG3"Me)的最优提取工艺为以酸性乙醇为提取溶剂,提取时间100 min、提取温度75 ℃、料液比(m紫娟茶∶V溶剂)1∶74 (g/mL),此时甲基化儿茶素质量分数为26.7 mg/g,与理论预测值的相对误差为1.48%。后续考虑对甲基化儿茶素的药理作用进行研究,分析不同位点的甲基化对儿茶素的药理作用的影响,并研究不同药理作用形成的原因。
