美味牛肝菌色素大孔树脂纯化工艺及抗氧化活性研究
2022-02-13资璐熙邱蕙婷
郭 磊 资璐熙 崔 琦 周 宇 邱蕙婷 阚 欢
(西南林业大学生命科学学院,云南 昆明 650224)
美味牛肝菌(BoletusedulisBull.:Fr.)是一种可食用的大型真菌,具有较高的食用药用价值[1-2],是人们最喜欢的野生食用菌之一[3],主要分布在中国的云南、贵州、四川、西藏、吉林、辽宁等森林资源丰富的省份[4]。
天然食用色素是从动物、植物、微生物或微生物代谢产物中提取出来的食品添加剂,因其资源丰富、种类繁多、颜色鲜艳且具有良好的着色性能,一直是食品呈色剂研究的热点[5]。另外,天然食用色素含有很多不饱和双键,是较好的单线态氧淬灭剂,对人体的多种疾病具有治疗、预防作用[6]。目前,微生物包括细菌、真菌和藻类,已经被证明是天然色素的一个极好的替代来源,和其他来源色素相比,真菌色素具有性质稳定、来源广泛、不受季节限制、易在培养基中快速生长等优点,是化学合成色素的良好替代品[7-8]。真菌色素作为潜在药物的来源,已经吸引了制药行业的巨大兴趣,以对抗许多威胁生命的疾病,如心血管疾病、阿尔茨海默氏症、人类癌症(肝癌、乳腺癌、肺癌、结肠直肠癌、胃癌、胰腺癌、白血病、造血、肾细胞和其他癌症)、传染病和疟疾等寄生虫病[9]。
目前,关于美味牛肝菌的研究主要集中在营养成分分析及多糖、多酚等化合物的提取与生物活性方面,但是对美味牛肝菌中天然色素的纯化及抗氧化活性研究还未见报道。试验拟以美味牛肝菌色素为研究对象,通过比较7种不同极性大孔树脂的静态吸附与解吸性能筛选出适合纯化美味牛肝菌色素的大孔树脂,在此基础上分析得出动态吸附与解吸条件下大孔树脂的吸附曲线及吸附解吸能力,并对纯化后色素的红外光谱及体外抗氧化活性进行分析,以期为美味牛肝菌综合开发利用及食品添加剂研发提供参考。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
新鲜美味牛肝菌子实体:云南昆明木水花食用菌交易市场;
1,1-二苯基-2-三硝基苯肼(DPPH)、2,2-联氮-双-3-乙基苯并噻唑啉-6-磺酸(TBTS):分析纯,北京酷来搏科技有限公司;
无水乙醇、氢氧化钠、盐酸、硫酸亚铁、水杨酸、抗坏血酸、过硫酸钾及过氧化氢:分析纯;
AB-8、NKA-9、XDA-7、D-101、S-8、X-5、HP-20大孔树脂:天津浩聚树脂科技有限公司。
1.1.2 主要仪器设备
傅里叶红外光谱仪:Nicolet IS50型,赛默飞世尔科技公司;
恒温鼓风干燥箱:DHG-9240A型,上海齐欣科学仪器有限公司;
紫外分光光度计:UV-VIS 300型,美国Thermo Fisher公司;
电子天平:BAS2245型,德国Strtorius集团;
数显电子恒温水浴锅:HH-2型,金坛市丹瑞电器厂;
离心机:5805ZR361607型,德国艾本德股份公司;
多功能粉碎机:JSP-200型,浙江永康金穗机械制造厂。
1.2 方法
1.2.1 美味牛肝菌色素的制备 参考课题组前期的研究成果,经干燥过筛后的美味牛肝菌粉在液料比(V乙醇∶m美味牛肝菌粉)为38∶1 (mL/g)、乙醇体积分数55%、超声时间42 min、超声功率450 W条件下提取色素,提取液减压浓缩后冻干备用[10]。
1.2.2 大孔树脂静态吸附与解吸
(1) 大孔树脂预处理:参照文献[11],将AB-8、NKA-9、XDA-7等7种大孔树脂用无水乙醇浸泡24 h,除去漂浮物及杂质后湿法装柱。装柱后先用去离子水冲洗至中性,直至无乙醇残留。再用体积分数5%的HCl溶液浸泡树脂12 h,以去离子水冲洗至中性,用质量分数2% NaOH溶液浸泡12 h,用去离子水冲洗至中性,滤去水分备用。
(2) 吸附率与解吸率的测定:称取预处理好的7种大孔树脂各1.0 g于100 mL锥形瓶中,加入0.5 mg/mL色素粗提液20 mL,在25 ℃下振荡(110 r/min)吸附24 h后过滤,并记录滤液的体积及其吸光值(297 nm)。然后,将树脂倒回原锥形瓶并加入20 mL乙醇(体积分数70%),同样置于恒温振荡器(25 ℃,110 r/min)中解吸24 h后过滤。分别按式(1)和式(2)计算大孔树脂吸附率和解吸率。
(1)
(2)
式中:
R1——大孔树脂对色素的吸附率,%;
R2——大孔树脂对色素的解吸率,%;
A0、A1、A2——色素提取液、吸附后色素溶液及解吸后色素溶液的吸光值;
V0、V1、V2——色素提取液、吸附后色素溶液及解吸后色素溶液的体积,mL。
1.2.3 动态吸附与解吸
(1) 动态吸附:将20.0 g AB-8填充于树脂层析柱(1.6 cm×50 cm)后,分别采用不同质量浓度色素、不同初始pH及不同上样流速进行吸附工艺研究,具体如下:固定初始pH 5、上样流速1.0 mL/min,研究色素质量浓度(0.5,1.0,1.5,2.0,2.5 mg/mL)对AB-8树脂吸附率的影响;固定色素质量浓度1.5 mg/mL、上样流速1.0 mL/min,研究初始pH(1,2,3,4,5)对AB-8树脂吸附率的影响;固定色素质量浓度1.5 mg/mL、初始pH 2,研究上样流速(1.0,2.0,3.0,4.0,5.0 mL/min)对AB-8树脂吸附率的影响。流出液每5 mL接1管,测定每管流出液的吸光值,直至吸光值接近于0时,吸附试验结束,绘制动态吸附曲线,并根据式(3)计算大孔树脂的吸附率。
(3)
式中:
R1——大孔树脂对色素的吸附率,%;
A0、Ai、V0——上柱前色素溶液、吸附后第i管流出液及上柱前色素溶液的体积,mL。
(2) 动态解吸:选择最佳动态吸附条件吸附美味牛肝菌色素后,选择不同体积分数乙醇(50%,60%,70%,80%,90%)及不同洗脱流速(1.0,1.5,2.0,2.5,3.0 mL/min)对大孔树脂进行解吸工艺研究,同样,选择流出液每5 mL接1管,测定每管流出液的吸光值,直至吸光值接近于0时,解吸试验结束,绘制动态解吸曲线,并根据式(4)计算大孔树脂的解吸率。
(4)
式中:
R2——大孔树脂对色素的解吸率,%;
A0、Ai、Aj——上柱前色素溶液、吸附后第i管流出液及解吸后第j管流出液的吸光值;
V0——上柱前色素溶液的体积,mL。
1.2.4 色素纯化效率测定 参照文献[12]。美味牛肝菌色素提取液经减压蒸馏与冷冻干燥后得到色素粗粉,将粗粉溶解并按最优动态吸附与解吸条件收集美味牛肝菌纯化后色素溶液,并经减压蒸馏和冷冻干燥后得到纯色素精粉。将色素粗粉和精粉分别溶于去离子水配制成1 mg/mL,在297 nm下测定两组溶液的吸光度值,各测定3次,根据式(5)计算美味牛肝菌色素的纯化效率。
(5)
式中:
P——美味牛肝菌色素的纯化效率,%;
A1、A2——纯化前及纯化后色素溶液的吸光值。
1.2.5 红外光谱分析 参照文献[13],取1 mg经大孔树脂纯化、冻干成粉的美味牛肝菌色素与100 mg KBr粉末混匀并压制成片,然后进行红外光谱分析,光谱扫描范围为4 000~400 cm-1。
1.2.6 抗氧化活性测定 将纯化后美味牛肝菌色素冻干粉用蒸馏水配制成质量浓度分别为0.05,0.1,0.2,0.3,0.4,0.5 mg/mL的样品,研究不同样品对不同自由基的清除能力,并以维生素C作为对照,IC50值表示自由基清除率达到50%时色素溶液的浓度。
(1) 清除DPPH·能力:参照田文慧等[14]的方法并略作修改。2 mL样品与2 mL DPPH-无水乙醇混匀后在避光处放置30 min,在517 nm处测定吸光值(A1)。以2 mL 无水乙醇溶液代替DPPH-无水乙醇溶液作为对照组(A2)。以无水乙醇溶液代替色素溶液作为空白组(A0)。以等体积去离子水调零。按式(6)计算DPPH·清除率。
(6)
式中:
Q——清除率,%。
(2) 清除ABTS+·能力:参照Chuyen等[15]的方法略做修改。将7 mmol/L ABTS与2.45 mmol/L过硫酸钾溶液等体积混合后,室温避光放置16 h,即得到ABTS储备液,用无水乙醇将ABTS储备液稀释使其在734 nm下吸光值为0.70±0.02的工作液。取0.3 mL色素溶液与3 mL工作液混匀后在室温下反应6 min,然后迅速在734 nm处测定吸光值(A1);3 mL蒸馏水代替储备液作为对照组测定吸光值(A2)。以蒸馏水代替样品为空白对照并测其吸光值(A0),用去离子水调零。按式(6)计算ABTS+·清除率。
(3) 清除·OH能力:参照Cai等[16]的方法略做修改。在2 mL不同质量浓度色素溶液中先后加入FeSO4·7H2O(3 mmol/L,0.2 mL)、水杨酸—乙醇溶液(6 mmol/L,0.2 mL)和H2O2(4 mmol/L,0.2 mL),混匀后置于室温下静置1 h,然后在510 nm 处测定吸光值(A1)。以蒸馏水代替水杨酸溶液作为对照组测定吸光值(A2)。用蒸馏水代替样品为空白对照并测其吸光值(A0),用离子水调零。按式(6)计算·OH清除率。
1.2.7 数据分析 试验数据采用Microsoft Excel 2010、Origin 2017及SPSS 20.0软件进行统计分析,每次测定重复3次。
2 结果与分析
2.1 静态吸附与解吸
树脂对色素的吸附性能受到很多自身物理性能参数的影响,如极性、含水率、比表面积、孔径大小及粒度等[17]。由图1可知,7种大孔树脂对美味牛肝菌色素的吸附率与解吸率都差异显著(P<0.05),7种树脂对美味牛肝菌色素的静态吸附能力依次为:S-8>D-101>XDA-7>HP-20>AB-8>NKA-9>X-5,S-8的吸附能力远优于其他大孔树脂,吸附率达到(83.23±0.06)%。从解吸效果来看,AB-8大孔树脂的解吸率达到(66.82±0.19)%,远高于其他类型的大孔树脂,可以推测美味牛肝菌色素属于弱极性化合物,且AB-8大孔树脂具有较大的孔径。另外,由于静态吸附率受样液浓度、震荡时间等因素的影响,导致AB-8树脂吸附率略低于解吸率。结果表明,受到极性和平均孔径的影响,7种大孔树脂的吸附与解吸能力存在较大差异,而有着弱极性和大孔径的AB-8树脂是最适合纯化美味牛肝菌色素的大孔树脂。

小写字母不同表示差异显著(P<0.05)
2.2 动态吸附与解吸
2.2.1 上样质量浓度对AB-8大孔树脂吸附效果的影响
图2显示了不同上样质量浓度的动态吸附平衡曲线,质量浓度越高,吸光值越大,之后缓慢上升趋于平衡,达到吸附平衡。这可能是因为刚开始吸附时(1~10管),AB-8大孔树脂表面有较大的表面积,吸附速率较快。随着样液吸附时间的延长,树脂的吸附能力趋于饱和。
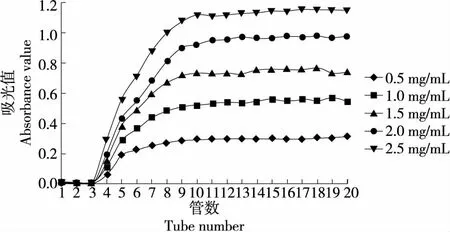
图2 不同上样质量浓度下美味牛肝菌色素的动态吸附曲线
由图3可知,AB-8大孔树脂对美味牛肝菌色素的吸附率随上样流速的增加呈先增大后减少的趋势。当上样质量浓度达到1.5 mg/mL时,AB-8树脂对色素的吸附率达到饱和,树脂的吸附率达到最大,为(46.58±0.04)%。继续增加样液质量浓度,与色素竞争吸附的杂质逐渐增多,会阻碍色素在大孔树脂内部的扩散,导致吸附率降低[18]。因此,美味牛肝菌色素的最佳吸附质量浓度为1.5 mg/mL。
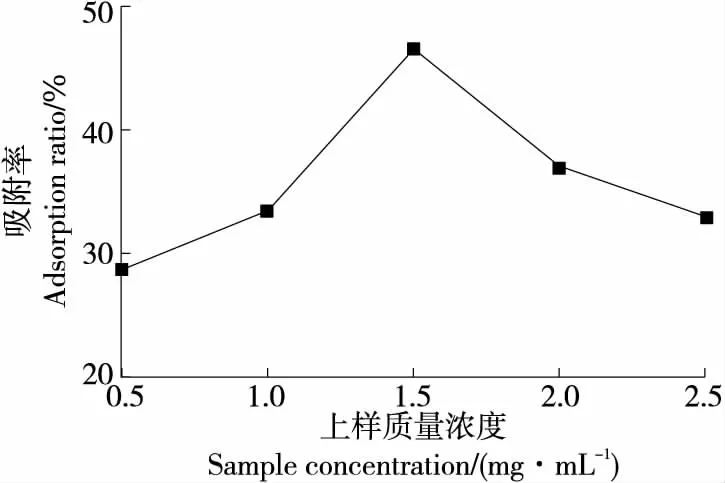
图3 上样质量浓度对AB-8大孔树脂吸附率的影响
2.2.2 pH对AB-8大孔树脂吸附效果的影响 pH能够通过影响样品分子的电离程度来影响色素与大孔树脂之间的亲和力[11]。由图4可知,样液pH在从1升高到5的过程中,流出液吸光值变大,说明树脂吸附率呈下降趋势,可见,弱酸环境会影响树脂对美味牛肝菌色素的吸附。

图4 不同pH下美味牛肝菌色素的动态吸附曲线
美味牛肝菌色素在不同酸碱溶液中的稳定性有着较大的差异,在酸性溶液中相对比较稳定[10]。如图5所示,随着pH值增大,AB-8大孔树脂的吸附率先缓慢上升后快速下降,可能与美味牛肝菌色素的结构变化有关,因为较高pH值会导致美味牛肝菌色素结构发生变化而不易吸附在树脂上。因此,美味牛肝菌色素溶液在pH 2时,AB-8大孔树脂的吸附率最佳。
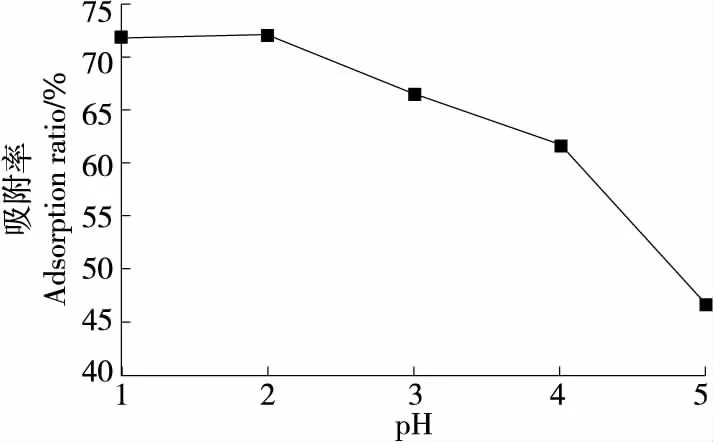
图5 pH对AB-8大孔树脂吸附率的影响
2.2.3 上样流速对AB-8大孔树脂吸附效果的影响 不同上样流速时,美味牛肝菌色素经AB-8大孔树脂的动态吸附曲线见图6。上样流速较小时,AB-8大孔树脂与美味牛肝菌色素能够充分接触,对色素的吸附量较大,使得流出液的吸光值较小。但是,当上样流速过大时,美味牛肝菌色素溶液未与AB-8大孔树脂充分接触便快速流出,致使流出液吸光值增大,吸附效率低下。

图6 不同上样流速下美味牛肝菌色素的动态吸附曲线
图7显示了不同上样流速对AB-8大孔树脂吸附率的影响。随着上样流速的增大,吸附率先缓慢增加后急剧减小,这是因为上样流速越大,美味牛肝菌色素溶液在树脂中停留时间越短,色素未及时被树脂吸附便流出柱体。当流速为3.0 mL/min时,吸附率达到(73.77±0.10)%。因此,选择3.0 mL/min作为美味牛肝菌色素溶液的上样流速。

图7 上样流速对AB-8大孔树脂吸附率的影响
2.2.4 乙醇体积分数对AB-8大孔树脂解吸效果的影响
由图8可知,乙醇体积分数为70%时,解吸曲线不仅峰形窄,对美味牛肝菌色素的富集效果好,而且无拖尾现象。乙醇体积分数过高,虽然会对色素的解吸能力有提高,但也会将非色素成分解吸下来[19],影响色素纯度。
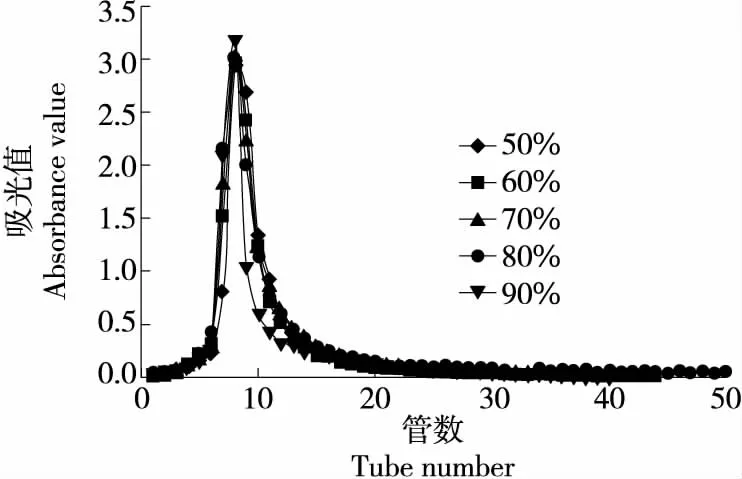
图8 不同体积分数乙醇下美味牛肝菌色素的动态解吸曲线
如图9所示,乙醇体积分数不断增加时,大孔树脂的吸附率先增加后急剧减小。乙醇体积分数为60%时的解吸率略低于50%,可能是由于洗脱液与色素溶液的极性差异和较快的流速造成的。当乙醇体积分数为70%时,解吸率达到最大(73.55±0.37)%,而后解吸率急剧降低,可能是因为低体积分数乙醇无法使得色素物质充分溶出,洗脱不充分,而高体积分数乙醇的极性与色素相差较大,不利于洗脱[20]。因此,选择体积分数70%乙醇较为适宜。

图9 乙醇体积分数对AB-8大孔树脂解吸率的影响
2.2.5 洗脱流速对AB-8大孔树脂解吸效果的影响 由图10可知,随着洗脱的不断进行,流出液中美味牛肝菌色素的质量浓度升高到最大后又迅速降低,此时已收集到大部分色素,当流出液为无色时,说明洗脱已完成。当洗脱流速为2.0 mL/min时,洗脱液的吸光值达到最大。

图10 不同洗脱流速下美味牛肝菌色素的动态解吸曲线
如图11所示,随着洗脱流速的增大,洗脱率逐渐下降,这归因于洗脱流速较快时,乙醇溶液不能与树脂进行充分接触,而流速过低则会延长洗脱过程,均导致洗脱效果降低。因此确定洗脱流速2.0 mL/min较为适宜。

图11 洗脱流速对AB-8大孔树脂解吸率的影响
2.3 红外光谱
由图12可知,3 343 cm-1左右有羟基的很强的伸缩振动,证明有酚羟基或碳上的羟基存在;2 922.11 cm-1处吸收峰极强,可能是—OCH3的伸缩振动,说明分子中存在—OCH3取代[21]。在1 654.14 cm-1处有羰基的伸缩振动,1 557,1 541.81 cm-1处有芳环骨架振动引起较强的吸收峰[22]。1 467.08,1 413.08 cm-1是苯环和杂环碳骨架的振动吸收,是苯环的特征吸收峰,只是峰形较窄,可能是由于苯环上取代较多芳香性下降的缘故[21,23]。1 078 cm-1可能是由于C—O—C不对称伸缩振动或者是C—CH3的弯曲和骨架振动[23-24]。综上所述,美味牛肝菌色素组分主要吸收为羟基、苯环和含氧杂环类物质,可推断为花色苷类物质。

图12 美味牛肝菌色素的红外光谱图
2.4 色素抗氧化能力分析
2.4.1 DPPH·清除能力 由图13可知,美味牛肝菌色素溶液质量浓度为0.05~0.30 mg/mL时,对DPPH·的清除能力急剧增加;当质量浓度超过0.30 mg/mL时,对DPPH·的清除能力呈缓慢增长的趋势;当质量浓度达到0.50 mg/mL时,美味牛肝菌色素及维生素C清除DPPH· 能力分别达到了(91.64±0.08)%,(96.88±0.08)%。相同质量浓度条件下,美味牛肝菌色素对DPPH·的清除能力低于维生素C。美味牛肝菌色素和维生素C清除DPPH·的IC50值分别为(0.081±0.001),(0.017±0.003) mg/mL。
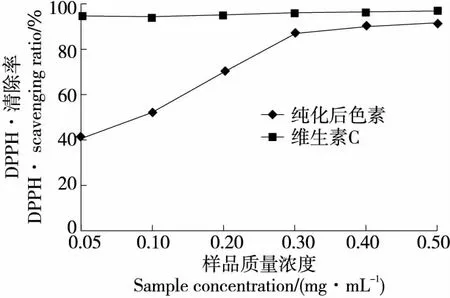
图13 美味牛肝菌色素对DPPH·的清除能力
2.4.2 ABTS+·清除能力 由图14可知,美味牛肝菌色素对ABTS+·清除能力在质量浓度为0.05~0.10 mg/mL范围内呈良好的量效关系,且同质量浓度条件下色素对ABTS+·清除能力明显低于维生素C。之后,随着质量浓度的增加,色素对ABTS+·清除能力增长缓慢,且与维生素C的相当。当质量浓度达到0.5 mg/mL时,美味牛肝菌色素及维生素C清除ABTS+·能力分别达到了(99.77±0.16)%,(99.89±0.15)%。美味牛肝菌色素和维生素C清除ABTS+·的IC50值分别为(0.017±0.011),(0.007±0.006) mg/mL,二者相当。

图14 美味牛肝菌色素对ABTS+·的清除能力
2.4.3 ·OH清除能力 由图15可知,样品质量浓度从0.05 mg/mL增加到0.50 mg/mL时,美味牛肝菌色素对·OH的清除能力也随之增加。当质量浓度为0.10~0.50 mg/mL时,美味牛肝菌色素对·OH的清除能力高于同浓度下的维生素C,并随着质量浓度的增加,两者清除率的差距也越来越大。当质量浓度为0.50 mg/mL时,美味牛肝菌色素对·OH的清除率为(93.04±0.73)%,而此时维生素C的清除率仅有(69.36±1.84)%。美味牛肝菌色素清除·OH的IC50值为(0.119±0.001) mg/mL,高于维生素C的IC50(0.168±0.004) mg/mL。

图15 美味牛肝菌色素对·OH的清除能力
3 结论
通过7种大孔树脂静态吸附—解吸试验,确定了AB-8 大孔树脂是适合分离纯化美味牛肝菌色素的树脂,纯化后美味牛肝菌色素的纯化效率是269%,可见,美味牛肝菌色素经过AB-8树脂纯化后确实提高了含量。体外抗氧化性试验结果得出纯化后的美味牛肝菌色素清除DPPH·、ABTS+·及·OH能力较强,特别是相同质量浓度下清除·OH能力超过维生素C。综上所述,经过AB-8树脂纯化后的美味牛肝菌色素具有良好的体外抗氧化活性。然而,试验仅对美味牛肝菌色素的富集及体外抗氧化活性进行了初步研究,尚未分析纯化后色素的化学成分及其体内抗氧化活性,因此,后续研究应着重放在化学成分分析及体内抗氧化活性方面。
