金纳米颗粒在宫颈癌的成像及治疗中的应用研究进展
2022-02-13张琳雪叶洋朱丽君努尔尼沙阿力甫
张琳雪,叶洋,朱丽君,努尔尼沙·阿力甫
1 前言
宫颈癌在世界范围内的致死率很高,是危害女性生命的主要疾病之一[1-4]。鉴于其高风险性,生物医学研究人员一直在研究更准确的诊断技术和更有效的治疗方案来预防和治疗宫颈癌。传统的宫颈癌治疗手段有根治性手术、放疗和化疗[5]。但以上所涉及的方式在杀伤宫颈癌细胞的同时也对周围正常组织以及机体免疫、造血功能造成损害。随着医疗技术的迅猛发展,光致治疗(photo-induced therapy),如光热治疗(photothermal therapy,PTT)和光动力治疗(photodynamic therapy,PDT),逐渐成为治疗宫颈癌相对有效的方法。PTT是在激光照射的基础上,利用具有较高光热转换效率的材料,将其注射入人体内部,利用靶向性识别技术聚集在肿瘤组织附近,将光能转化为热能来杀死癌细胞的一种治疗方法[6-7]。PDT是通过结合光、氧和光敏剂(photosensitizer,PS)产生高细胞毒性的活性氧,导致癌细胞死亡[8-9]。金纳米颗粒(Au NPs)作为靶向消融宫颈癌细胞的重要纳米材料,逐渐成为宫颈癌治疗方法的研究热点[10-12]。
在众多金属纳米颗粒中,Au NPs凭借其独特的消光特性(包括吸收光和散射光)、稳定的化学性质、良好的生物相容性和表面易与生物分子结合等优势[13-14],利用药物分子,靶向配体和成像探针的不同化学物质对Au NPs表面进行修饰,使其在宫颈癌诊断与治疗方面展现了潜在的应用价值,如PTT、生物传感以及分子影像等方面。1927年,Au NPs首次被用于医学应用中[15],为Au NPs在医学中的发展带来了新的机遇,基于Au NPs可与不同的生物活性分子相互作用,将Au NPs用于宫颈癌等妇科疾病的治疗和诊断[16-18]。Au NPs面临的重大挑战之一是Au NPs如何到达目标组织或器官[19]。为克服以上缺点,将Au NPs进行表面修饰,增加其在血液循环中的停留时间[20]。修饰后的Au NPs可作为光热剂和放疗剂杀死癌细胞,减少对周围正常组织的损害并提高治疗效率。也可作为细胞成像的光学探针和生物标记物,筛查早期宫颈癌,从而显著提高患者的存活率。本文分析讨论了近几年Au NPs在宫颈癌诊断与光致治疗方面的研究现状。
2 金纳米颗粒在宫颈癌诊断及治疗方面的研究进展
2.1 光致治疗
提高宫颈癌的治疗效率是目前肿瘤研究领域亟待解决的问题。光致治疗是消融宫颈癌细胞并且保留正常宫颈组织的有效措施之一,在临床肿瘤治疗中具有强大的潜力[21-22]。由光诱导的光疗,无毒的光疗剂可以在光照射下选择性杀死宫颈癌细胞,对正常组织损害小。光疗的“选择性”有两个方面:① 精心设计的光疗剂可通过被动或主动选择性地靶向宫颈癌细胞。② 可在空间上控制光照,仅照射宫颈病变区域而不会损害正常组织。相比于传统化学疗法,光疗法提供的这种双重选择性可以显著提高宫颈癌治愈率。表1总结了近年来不同种类的化学物质对Au NPs表面修饰,并结合光致治疗诊断和治疗宫颈癌。
2.1.1 光动力治疗 PDT能够用于治疗多种疾病,包括宫颈癌[28-29]。PDT的三个主要组成部分是PS、光和单重态氧(singlet oxygen,1O2)[30-32]。在合适波长的光源下,PS被激发并将其能量传递给邻近的氧,产生1O2或其他类型的活性氧(reactive oxygen species,ROS)[33-36]。生成的ROS诱导细胞的凋亡从而杀死肿瘤细胞。通常利用2′,7′-二氯荧光素二乙酸酯(DCFH-DA)来评估样品在细胞内所产生ROS的量,DCFH-DA与ROS会反应生成2,7-二氯荧光素(DCF),DCF发出绿色荧光,能通过观察绿色荧光的含量来确定产生ROS的含量,从而确定药物能够提高PDT疗法效果。与此同时,延长药物在血液中的循环和药物在肿瘤内的特异性积累PDT的关键。因此,需要选择合适的PS来治疗宫颈癌,修饰后Au NPs能够作为治疗宫颈癌的光敏剂。
Yu JS等[37]利用PDT疗法治疗宫颈癌,将亚甲蓝(methylene blue,MB)、PS、转铁蛋白(transferrin,Tf)和Au NPs结合,得到稳定性高的Au@polymer/MB-Tf纳米复合物。Au@polymer/MB-Tf纳米复合物能够在660 nm激光的照射下产生ROS,使其诱导癌细胞凋亡。如图1(见封3)所示,利用激光照射游离MB、Au@polymer/MB-Tf NPs和Au@polymer/MB NPs,与游离MB相比,Au@polymer/MB-Tf NPs和Au@polymer/MB NPs中DCF有较强的绿色荧光。这表明含有MB的Au@polymer成功提高了PDT效率。在转铁蛋白的辅助下,Au@polymer/MB-Tf NPs的ROS含量最高,表明PDT疗效进一步增强。Au@polymer/MB-Tf NPs能显著提高PDT效率,证实Au@polymer/MB-Tf NPs是治疗宫颈癌的一种高效药物。
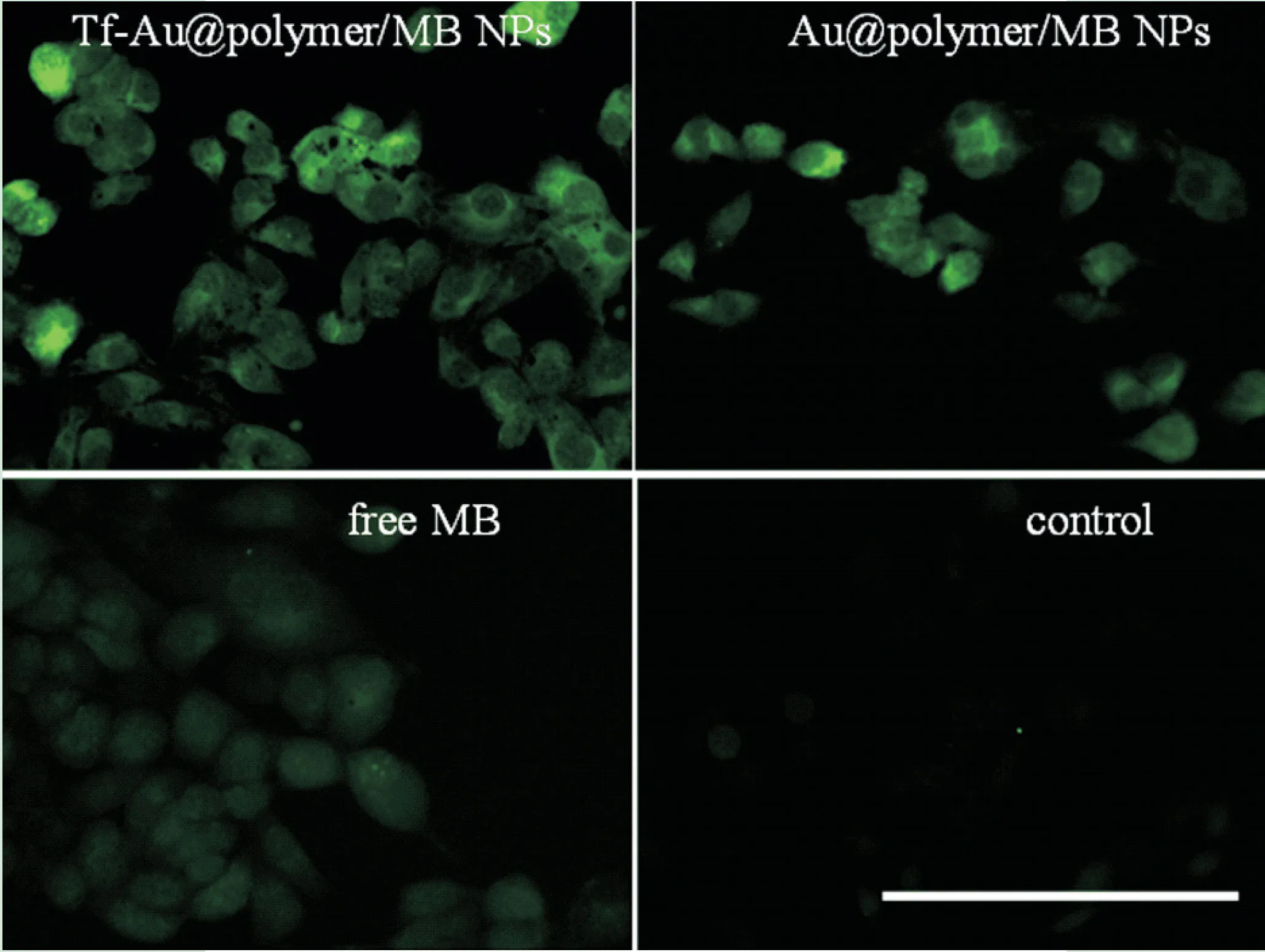
图1 660mm激光照射4min后,HeLa细胞中DCF(绿色)与纯MB、Au@polymer/MB Nps和Au@polymer-TfNPs孵育后的荧光图像(比例尺:100um)
Hossein Eshghi等[17]利用PDT进行宫颈癌治疗,选用了金纳米颗粒偶联原卟啉IX(PpIX-GNP)光敏剂,评估了PpIX-GNP偶联物光子诱导毒性的影响。结果表明,PpIX-GNP偶联物被HeLa细胞吸收。PDT治疗癌症,证明了ALA -AuNPs作为治疗宫颈癌药物的潜在应用价值。
2.1.2 光热治疗 PTT是利用光热转导剂(photothermal agents,PTA)的光热效应,从光中收集能量并将能量转化为热,从而提高周围环境的温度,对肿瘤进行局部治疗而不损伤周围健康组织的一种治疗方式[38]。PTT最大的问题是光的穿透深度有限,PTA不在激光照射范围内,可能导致肿瘤在照射范围之外的不完全消融。为解决上述问题,研究人员采取了多种方法,如采用适当的激光剂量[39],提高PTA的光热转换效率[40],寻找在近红外窗口具有吸收特性的PTA[41]。近红外光(700~900 nm)比可见光更有效地穿透皮肤和血液等生物组织,因为这些组织在较长波长下可散射和吸收较少的光,能深入地穿透健康组织,到达嵌入在肿瘤内的PTA中。
在各种纳米材料中,Au NPs作为研究最为广泛的PTA的候选者之一,在合成、吸收、表面修饰等方面占据极大的优势,更重要的是Au NPs能够吸引特定波长的光(主要是近红外光)[42]。此外,Au NPs的大小和形状是PTT中的重要因素,对于各种形态的Au NPs有很多研究,如棒状Au NPs[43]、星星状Au NPs[44]、树枝状Au NPs[45]、链状Au NPs[46]等,其局域表面等离子体共振(local surface plasmon resonance,LSPR)波长从可见到近红外区域不等。将Au NPs与其他材料相结合进行PTT,用近红外激光照射,修饰后的Au NPs会升温快,达到具有非线性效应的阈值温度,破坏细胞并致使癌细胞选择性损伤。Au NPs已成为治疗宫颈癌领域中的光热治疗剂。
Zhang C等[47]利用Ce6与金纳米棒(AuNR)结合制备Ce6-PEG-AuNR 纳米材料,并研究了Ce6-PEG-AuNR的光热效应。通过静脉注射Ce6-PEG-AuNR进入小鼠体内,并对肿瘤(HeLa)区域进行近红外照射。肿瘤区域的温度变化如下页图2(a)所示,照射后PBS组的温度变化不大,而Ce6-PEG-AuNR处理后的小鼠肿瘤热信号在激光照射下越来越高,说明Ce6-PEG-AuNR具有良好的光热转换能力。PBS和Ce6-PEG-AuNR处理组的温度都随着照射时间的增加而升高,见下页图2(b)。可以看出,PBS组肿瘤区域的平均温度仅略有改善,照射后最高温度达到34℃。而Ce6- PEG-AuNR组肿瘤区域的温度在激光照射后达到后达到55℃,表明Ce6- PEG-AuNR可作为一种有前途的PTT药物治疗肿瘤。

表1 光致治疗在宫颈癌的应用(不同化学物质对Au NPs表面修饰)[22-27]
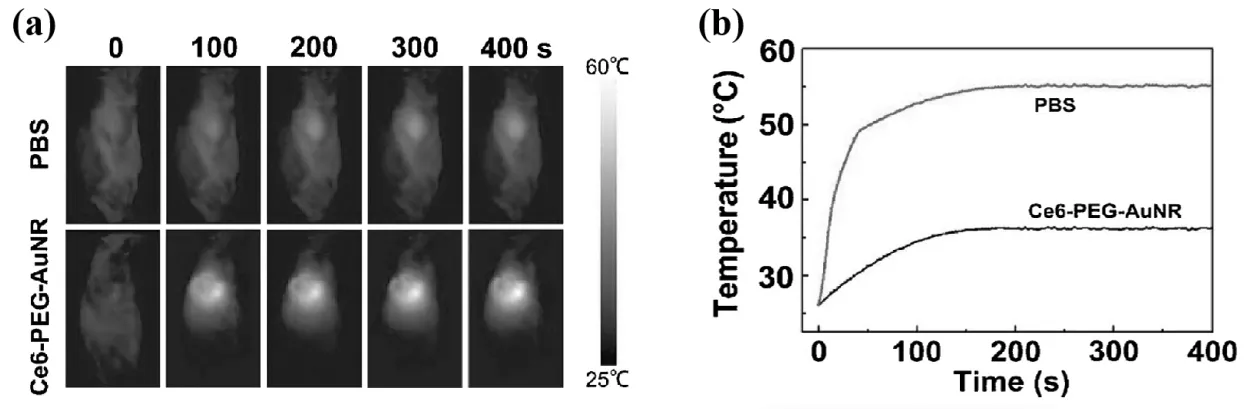
图2 808 nm激光照射(1 W/cm2) 400 s(a)小鼠肿瘤体内PBS或Ce6-PEG-AuNR的红外热成像图,(b)PBS和Ce6-PEG-AuNR温度变化趋势图 [47]
2.2 联合治疗
PTT联合其他疗法显示出更好的治疗效果。在许多情况下,联合治疗的治疗结果并不是单个治疗效果的简单相加,而是一种协同效应[48-50]。PTT可直接杀死癌细胞或通过提高药物传递效率、刺激药物释放、诱导肿瘤特异性抗原释放或影响其他生物学相关反应来增强其他治疗手段,改善治疗结果。
Wang S等[51]研究开发了一种基于聚多巴胺(polydopamine,PDA)修饰GNR的多功能纳米平台GNR-PDA。GNR-PDA具有独特的分子吸附性能、稳定的化学特性和高的生物相容性,使其成为理想的药物释放候选者。MB和阿霉素(doxorubicin,DOX)通过静电叠加相互作用直接吸附在GNR-PDA上,分别形成GNR-PDA-MB和GNR-PDA-DOX纳米复合材料。在近红外激光照射下,GNR-PDA-MB可以高效地产生ROS,而GNR-PDA-DOX在近红外激光照射下表现出光增强的药物释放。通过使用GNR-PDA-MB(PDT/PTT)和GNR-PDA-DOX(Chemo/PTT)进行双模光介导治疗,对于宫颈癌细胞显示出高效的杀伤效率,能够显著抑制肿瘤生长,比任何单模治疗策略都明显,如图3所示。
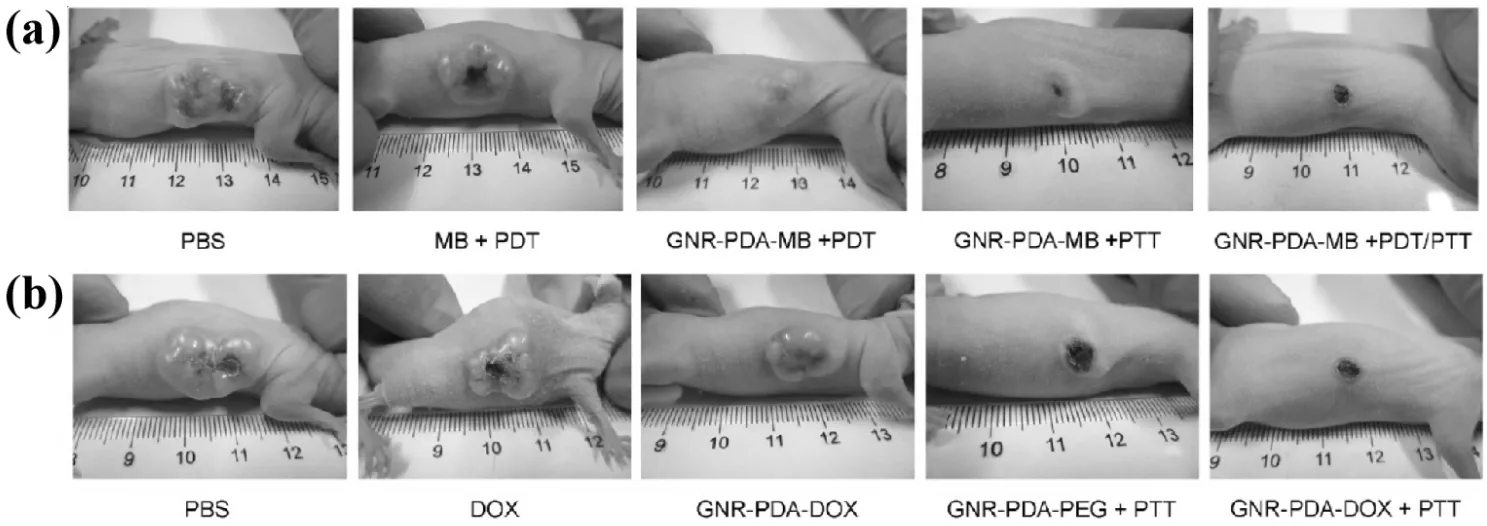
图3 利用不同药物(PBS,MB,DOX,GNR-PDA)以及不同治疗模式(PDT,PTT,PDT/PTT)对小鼠治疗14天后的效果对比图(对照组PBS)[51]
Zhang C等[47]设计出一种金纳米棒-光敏剂偶联物——Ce6-金纳米棒(Ce6-PEG-AuNR),通过PTT/PDT联合应用来精确定位宫颈癌细胞并进一步杀死癌细胞。此外,在肿瘤治疗中,PTT/PDT联合治疗比单纯PTT或PDT更有效。
3 结语
综上所述,由于Au NPs易制备、具有在可见光至近红外光波段内连续可调的表面等离子共振等特性,使其在光学成像及多模式联合治疗方面对宫颈癌的诊断和治疗有着广阔的应用前景。同时,Au NPs的设计为开发新型药物材料提供了思路和研究方向。尽管如此,未来仍有许多挑战需要去解决。
现阶段,Au NPs在临床应用中的第一个挑战是其在活体内的代谢。此外, Au NPs毒性主要来自Au NPs的合成及其表面修饰。涉及到表面活性剂的毒性、Au NPs表面配体在血液中的稳定性、表面修饰剂与血管的相互作用等问题。第二个挑战是基于Au NPs的宫颈癌治疗的标准化。阻碍Au NPs在临床应用的主要障碍之一是对于纳米颗粒治疗宫颈癌的标准不统一。例如,对于Au NPs和激光功率的剂量,高功率激光强度会损伤健康组织,引发毒性作用,引起癌症复发和转移。由于条件的巨大差异,很难比较不同类型Au NPs的性能。因此,统一标准的Au NPs、激光强度、癌症类型等将为临床应用提供条件。
未来的工作需要从临床试验中获得更多的数据,更详细地了解人类Au NPs的药代动力学和长期毒性,从而为今后治疗更多类型的癌症打开大门。
