表达长效生长激素的C HO细胞培养工艺的优化及放大
2022-02-12梁久佳刘玉林刘涵俞露张凯宁刘景会李利
梁久佳,刘玉林,刘涵,俞露,张凯宁,2,刘景会,李利
1.长春生物制品研究所细胞因子室,吉林长春130012;
2.长春理工大学生命科学学院,吉林长春130022
许多治疗性多肽和蛋白质均具有较短的血浆半衰期,从几分钟到几小时不等,导致必须频繁地进行给药。生长激素相对分子质量约为22 000,经静脉和皮下注射后的半衰期分别为0.36和3.4 h[1]。蛋白酶的降解和肾脏过滤的快速清除是导致半衰期缩短的主要原因。将生长激素与IgGFc段相结合可通过Fc段与其受体(neonatal Fc receptor,FcRn)结合减少蛋白酶的降解[2],又因为结合Fc段后相对分子质量的显著增加可有效减少肾脏的过滤作用[3],而且在加入Fc片段后会引入糖基化位点,从而增加负电荷,进一步使肾脏清除速度变慢[4],从而可延长生长激素的半衰期。
哺乳动物细胞由于具有蛋白质折叠、组装和翻译后修饰的能力,已成为临床应用的重组蛋白生产的主要系统。因此,当蛋白质在哺乳动物细胞中表达时,其质量和生物学活性要优于其他宿主,如细菌、植物和酵母[5]。CHO细胞由于具有单细胞悬浮生长的能力,目前在重组蛋白产品的大规模生产领域占主导地位[6]。CHO细胞的规模化培养是在生物反应器中进行的,其中温度、pH、溶氧、通气速率、搅拌桨转速是生物反应器的基本控制参数。先利用实验设计(Design of Experiment,DOE)在小规模反应器获取相对较优的培养条件,再利用相关的经验公式放大,可在很大程度上实现足够的氧气供应和细胞生长[7]。在不同体积的生物反应器中,细胞往往很难处于同样微环境当中[8],通过对培养过程的代谢产物分析,可更好地实现工艺一致性[9]。本研究旨在优化表达重组人长效生长激素(recombinant human growth hormone Fc fusion protein,rhGH-Fc)的CHO细胞的培养工艺,使代谢副产物可以控制在合理区间内,以提高表达量,并实现14 L到40 L的培养工艺放大。
1 材料与方法
1.1细胞株 表达rhGH-Fc的CHO细胞株由北京比洋生物技术有限公司构建,细胞库由长春生物制品研究所有限责任公司细胞因子室建立并保存。
1.2主要试剂及仪器 HycloneActipro基础培养基、Hyclone cell boost 7a和Hyclone cell boost 7b补料培养基均购自美国GE公司;抗细胞结团剂购自美国Thermo Fisher公司;NaHCO3购自上海阿拉丁生化科技股份有限公司;Na2HPO4和NaH2PO4购自湖南九典制药股份有限公司;葡萄糖、精氨酸和盐酸购自国药集团化学试剂有限公司;台盼蓝购自碧云天生物技术有限公司;Applikonez-control 7 L生物反应器购自荷兰Applikon公司;NewBrunSwick310 14 L生物反应器和NewBrunSwick510 40 L生物反应器购自德国Eppendorf公司;Mettler Toledo YSI 2950生化分析仪购自美国Xylem公司;Osmomat o30渗透压仪购自德国Gonotec公司;ISF1-XC型CO2摇床购自瑞士Khner公司;CO2培养箱购自德国IRM公司;Count star细胞计数仪购自上海睿钰生物科技有限公司;超微量分光光度计购自德国Implen公司;PerkinElmer Flexar型高效液相色谱仪购自美国Perkin-Elmer公司。
1.3N e w B r u n S w ic k31014L生物反应器的工艺优化
1.3.1细胞复苏 提前在Actipro培养基中加入0.5%(v/v)抗细胞结团剂,取20 mL培养基于75 cm2方瓶中,置37℃,5%CO2孵箱中孵育30 min备用。从液氮罐中取出1支工作细胞,于37℃水浴锅中迅速融化,将细胞悬液加入预先孵育的培养基中,混匀后置37℃,5%CO2孵箱中培养24 h。
1.3.2细胞种子液的制备 提前在Actipro培养基中加入0.5%(v/v)抗细胞结团剂,取40 mL培养基于125 mL摇瓶中,置37℃,5%CO2摇床中孵育30 min备用。将方瓶中培养24 h的细胞液转移至50 mL离心管中,800×g离心10 min,弃上清,取6 mL孵育好的培养基重悬细胞沉淀,全部转移至125 mL摇瓶中,混匀后置37℃,5%CO2摇床中培养24 h。
提前在Actipro培养基中加入0.5%(v/v)抗细胞结团剂,取120 mL培养基于500 mL摇瓶中,置37℃,5%CO2摇床中孵育30 min备用。将摇瓶中培养24 h的细胞液全部转移至500 mL摇瓶中。此后每天取样,用细胞计数仪计数,待细胞密度达2×106个/mL时,同样方法分至2个摇瓶中。待4个摇瓶中细胞密度达2×106个/mL时,接种至生物反应器中继续培养。
1.3.3NewBrunSwick310生物反应器培养 生物反应器灭菌后,待罐体温度降至40℃以下,向罐体中泵入50%(v/v)最大工作体积Actipro培养基,通气设置为0.02 vvm。待溶氧电极极化完毕后,进行溶氧参数校正。溶氧参数校正完毕后,设置反应器操作参数:转速、温度、pH、溶氧、通气速率,见表1。待参数稳定后,接种细胞开始培养,第3天后开始取样、计数、测定生化代谢参数以及渗透压。第3天后开始每天补加总培养体积3%的cell boost 7a和总培养体积0.3%的cell boost 7b,当葡萄糖浓度低于2 g/L时,需补加240 g/L的葡萄糖溶液至培养液葡萄糖终浓度为4 g/L。当细胞数达(1.2~1.5)×107个/mL时进行降温培养,7~8 d后离心收获上清液。

表1 14 L生物反应器各批次培养条件Tab.1 Culture condition for various batches in 14 L bioreactor
1.4N e w B r u n S w ic k31014L生物反应器到N e w B r u n-S w ic k510 40 L生物反应器工艺放大 NewBrunSwick-510 40 L生物反应器细胞培养流程与NewBrunSwick 310 14 L生物反应器一致,区别仅在于NewBrun-Swick510 40 L的种子培养过程在7 L Applikon生物反应器中进行,接种时采用快接头对接的方式接种。NewBrunSwick510 40 L生物反应器的培养条件见表2。

表2 40 L生物反应器各批次培养条件Tab.2 Culture condition for various batches in 40 L bioreactor
1.5代谢过程参数的测定
1.5.1细胞数 每天取样后,取45μL培养液与0.2%台盼蓝溶液混合,取20μL,使用细胞计数仪测定细胞数。
1.5.2渗透压 每天取样后,取1mL培养液,2 500×g离心5 min,收集上清液,取50μL,使用冰点渗透压仪测定渗透压。
1.5.3葡萄糖、乳酸、铵离子、钾离子 每天取样后,取1 mL培养液,1 500×g离心5 min,收集上清液,取200μL,使用生化分析仪进行测定。按下式计算比耗糖速率。
比耗糖速率[g/(109cell·d)]=(前一天葡萄糖量+补料中葡萄糖量-当前葡萄糖量)/cells
1.5.4表达量 将收获后的培养液800×g离心10 min,收集上清液,继续4 500×g离心20 min,收集上清液,经0.45μm滤膜过滤澄清后,采用HPLC法测定rhGH-Fc表达量(1.076×积分峰面积/5 026 100.83)。色谱条件:色谱柱为Aglient Bio-Monolith Protein A Columns;流动相A为20 mmol/L磷酸盐缓冲液(pH 7.4);流动相B为甘氨酸盐酸缓冲液(pH 2.8);上样量100μL;流速1.0 mL/min;检测波长280 nm。
2 结果
2.1N e w B r u n S w ic k31014L生物反应器工艺优化结果
2.1.1代谢过程产物 开始培养时细胞数呈指数生长趋势,降温后仍可增长2 d,降温后第3天细胞数达到整个培养周期峰值,此后开始下降见图1A;培养开始时乳酸逐渐累积,第5天开始消耗,降温3 d后乳酸又从消耗转变为累积,见图1B;降温前渗透压基本稳定在320 mOsm/kg左右,降温后开始逐渐增加,见图1C;铵离子和钾离子在培养开始后逐渐增加,见图1D、1E;细胞培养第7天后降温,降温开始后比耗糖速率先降低,降温第3天后开始升高,降温第5天后趋于稳定,降温后比耗糖速率见图1F。
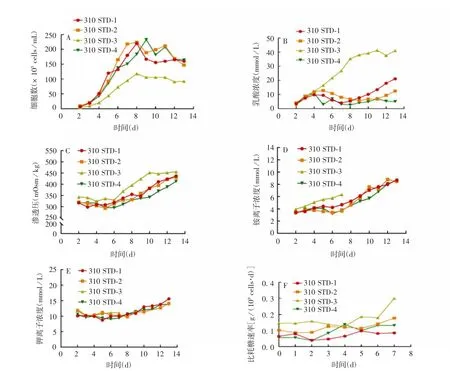
图1 310各批次代谢过程产物检测结果Fig.1 Metabolic process products of 310 STD-1 lot,310 STD-2 lot,310 STD-3 lot and 310 STD-4 lot
2.1.2蛋白表达量 STD-1、STD-2、STD-3、STD-4批蛋白表达量分别为0.59、0.76、0.31、0.90 g/L。细胞培养降温后蛋白表达量逐日升高,见图2(以STD-4批为例)。

图2 310 STD-4批每日蛋白表达量Fig.2 Expression levels of protein of 310 STD-4 lot on various days
2.2N e w B r u n S w ic k 510 40 L生物反应器工艺放大结果
2.2.1代谢过程产物 510各批次代谢产物趋势无明显差异,且与310各批次代谢产物趋势一致,见图3。

图3 510各批次代谢过程产物检测结果Fig.3 Metabolic process products of 510 STD-1 lot,510 STD-2 lot and 510 STD-3 lot
2.2.2蛋白表达量 510 STD-1、STD-2、STD-3批耗糖曲线变化趋势一致,蛋白表达量分别0.94、1.01、0.97 g/L,与310培养时无明显差异。
3 讨论
由于细胞在整个培养周期的生命活动是动态变化的,前期培养时细胞数目少,对氧的需求量小,较小的通气速率即可满足其生长所需,此时培养基中的碳源也不须补充,对搅拌速率的要求也较低,因此本实验前期采用小通气速率、低搅拌速度。而后期进行蛋白表达时,对营养物质以及氧的需求较高,因此后期需提高氧的传递,本实验采用后期增加转速及通气速率的方式来增加氧传递。培养时需对整个培养周期进行代谢过程产物的检测,以防止培养时产生代谢失衡。常见的代谢产物包括乳酸、铵离子、钾离子、钠离子,而葡萄糖与谷氨酰胺通常作为能源物质也需监测。其中较重要的代谢产物为乳酸与铵离子,乳酸的产生与多种因素有关,乳酸的异常变化提示培养过程的代谢异常[10]。本实验检测了乳酸、铵离子、钾离子的代谢情况。乳酸的变化为在开始培养时逐渐累积,而后由于搅拌桨转速的升高与通气速率的提升会由累积转变为消耗,降温3 d后会再次升高。本实验中310 STD-3批培养由于后续通气速率过低,导致pH降至最低控制限,从而与碱液添加造成恶性闭环,引起代谢失衡。而铵离子的浓度直接影响细胞状态,而且高浓度的铵离子会影响蛋白的修饰水平[11],铵离子的代谢为从培养开始时到培养结束一直累积,后期随着铵离子浓度的升高,细胞状态会快速降低,当铵离子浓度达10 mmol/L左右即需进行收获。本实验中所有批次收获时铵离子浓度均未达到10 mmol/L。良好的培养条件可使代谢产物维持在较好的范围内,从而使细胞状态更佳,表达时间更长,获得更高的表达量。
在小型反应器进行DOE后,细胞在生物反应器中的许多控制参数已确定,如温度、pH、溶解氧,而培养基、补糖策略也无需再做调整。在反应器已选型结束的情况下,在不同体积反应器中的培养可调整的参数只有搅拌桨转速与通气速率。在反应器规模扩大的考量下,小体积生物反应器的转速不宜过低,由于培养规模的扩大,转速过低无法保证大体积反应器的混匀效果,而且搅拌速率的增加可提高气泡在培养液中的停留时间[12]。本实验在优化310培养条件时,旨在提高搅拌桨转速,以期为后续实验放大奠定良好的基础。关于搅拌速率的放大,主要依赖于维持单位体积搅拌功率(P/V)一致的方法放大[13-14]。由于哺乳动物细胞无细胞壁,不耐剪切,叶尖速度最高不能超过1.0 m/s。本实验在放大时考虑到由于小体积生物反应器的电极及取样管路均深入至培养液中,可在一定程度上增加氧的传递,因此,在后续放大时略增加一些转速,但最终叶尖速度仍在安全范围内,而增加的转速也未对细胞产生明显损伤。通气速率与CO2的去除、泡沫的产生密切相关,过低的通气速率会导致培养中CO2的快速积累,使得pH降低与碱液添加形成恶性闭环,最终导致整体渗透压的快速升高、细胞代谢失衡[15-16]。在培养周期中,通过通气速率的增加,气泡可带走培养液中溶解的CO2。但过多的气泡会在培养液表面停留从而产生泡沫,气泡在上升至气液交界处会产生射泡现象,使附着在气泡表面的细胞受到较大剪切力,从而导致细胞死亡。本实验中采用的通气孔直径约为1 mm,较通气直径小(小于45μm)所产生的气泡对细胞的伤害小,但由于气泡本身体积增大,相较微泡通气在液体中的停留时间短,分布范围窄,氧传递系数低,因此较微泡通气所需的通气量大大提高。但大气泡可更好地带走溶液中溶解的CO2,在培养过程中可通过增加通气速率来使pH维持在最低控制限内,从而减少碱液添加。本实验中310 STD-4通过增加通气速率替代了碱液的流加,从而使得渗透压得到了较好的控制。后续放大至40 L生物反应器也可通过通气速率来减少甚至替代碱液流加。在培养液中添加保护剂,如非离子表面活性剂Pluronic家族,可减轻细胞所受到的来自于搅拌和通气所带来的机械破损。通气策略的改变可使得细胞在培养过程中碱液的添加量降低,从而降低整个培养过程中的渗透压,使细胞维持良好的状态。放大过程中通气策略和搅拌转速的平衡可依据氧传递系数(KLa)进行,KLa可通过厂家提供的技术文件获得,也可自行测量[17]。本实验在310 STD-4的基础上进行放大,以后期KLa为基本参照,对公式计算后的搅拌速率及通气速率进行调整,以维持后期KLa基本一致,从而获得40 L生物反应器的培养工艺。
综上所述,本实验建立了表达rhGH-Fc的CHO细胞培养的规模化扩大方法,为后续进一步扩大生产奠定了基础。
