严重急性呼吸综合征冠状病毒2核衣壳蛋白的制备及其初步应用
2022-02-12李光任仲胡道奇刘汨李克强张玉玲周松辉方晓兰李卫平滕淑静
李光,任仲,胡道奇,刘汨,李克强,张玉玲,周松辉,方晓兰,李卫平,滕淑静
1.岳阳职业技术学院,湖南 岳阳414000;2.湖南康润药业股份有限公司,湖南 岳阳414000;
3.免疫诊断试剂湖南省工程研究中心,湖南岳阳414000
严重急性呼吸综合征冠状病毒2(severeacuterespiratory syndromecoronavirus2,SARS-CoV-2)引起的新型冠状病毒肺炎(Corona Virus Disease 2019,COVID-19)疫情在世界范围内持续蔓延,严重影响人类的卫生健康。SARS-CoV-2属于冠状病毒科β冠状病毒属,基因组主要编码4种结构蛋白:刺突蛋白(spike protein,S蛋白)、核衣壳蛋白(nucleocapsid protein,N蛋白)、包膜蛋白(envelope protein)、膜蛋白(membrane protein)。其中N蛋白由413个氨基酸残基组成,结合于病毒基因组RNA上形成核衣壳,N蛋白具有较强的免疫原性,可诱导机体产生高水平的免疫反应,恢复期患者血清中含有大量的N蛋白抗体。针对N蛋白的IgM和IgG抗体是SARS-CoV-2感染的重要检测靶标。
SARS-CoV-2的N蛋白是一个紧密的、交织的二聚体,通过与RNA及关键宿主细胞蛋白的相互作用在体内形成或调节生物分子凝聚体,可能利用这种活性来调节病毒的生命周期和宿主细胞对病毒感染的反应[1-2]。免疫印迹试验结果显示,COVID-19感染患者血清中存在抗N蛋白的IgA、IgM和IgG抗体,证明了N蛋白在宿主免疫和诊断中的重要性[3]。用荧光素酶免疫沉淀分析系统(luciferase immuno precipitation system,LIPS)定量检测100例SARS-CoV-2感染患者血浆或血清中N蛋白和S蛋白抗体,结果显示,抗SARS-CoV-2的N蛋白抗体比S蛋白抗体对早期感染更敏感[4]。基于重组N蛋白和重组S蛋白的ELISA用于抗体(IgM和/或IgG)检测,阳性样本检出率分别为80.4%和82.2%,抗N蛋白的IgM和IgG阳性率随发病后天数的增加而升高,但在发病35 d后IgM阳性率下降[5]。将N蛋白用于稀土掺杂纳米颗粒横向流动免疫分析,实现了快速灵敏检测IgG抗体[6]。新型冠状病毒的S蛋白能够诱导中和抗体,因此,很多研究者以抗S蛋白抗体作为检测目标[7]。但也有研究显示,由于N蛋白在活跃感染期间的大量表达,证明其更具免疫原性[8]。
相比真核表达系统,原核表达系统具有高效、廉价的优势,用大肠埃希菌表达N蛋白是最佳选择。重组蛋白在原核表达系统内往往形成诱导包涵体,可收获大量的重组N蛋白,利于进一步的纯化及应用。N蛋白具有高的PI值(10.07),能够通过与RNA和宿主蛋白相互结合形成生物分子凝聚体[8],增加了纯化的难度。通过复性,使包涵体蛋白恢复天然状态,与杂质分离,具有了生物活性,才可用于检测或诊断[9]。本研究利用大肠埃希菌大量表达SARS-CoV-2重组N蛋白,并经两步阳离子交换层析纯化后,利用其制备免疫胶体金检测试剂。
1 材料与方法
1.1质粒及菌株 含N蛋白基因的重组质粒pET-28a、感受态大肠埃希菌BL21(DE3)由苏州泓迅生物科技股份有限公司提供。
1.2主要试剂及仪器 琼脂粉、氨苄青霉素(Ampicillin)、BCA蛋白定量试剂盒、质粒小提试剂盒购自生工生物工程(上海)股份有限公司;蛋白胨、酵母粉购自英国OXDID公司;HRP标记的羊抗兔抗体、鼠抗人IgM(2 mg/mL)、鼠抗人IgG(2 mg/mL)、羊抗鸡IgY及酪蛋白购自北京索莱宝科技有限公司;胶体金由湖南康润药业股份有限公司实验室合成并提供;兔抗SARS-CoV-2 N蛋白单抗由义翘神州公司惠赠;IPTG、Ni-NTA琼脂糖树脂、G25葡聚糖凝胶、SP FF阳离子琼脂糖树脂购自美国GE公司;CM Focurose 6HP阳离子琼脂糖树脂购自日本东曹化工公司;Biological LP层析仪为美国Bio-Rad公司产品。
1.3重组N蛋白的表达 将重组质粒转化感受态大肠埃希菌BL21(DE3),于琼脂平板上挑取单个菌落,接种至3 mL LB液体培养基(含50μg/mL氨苄青霉素),37℃,200 r/min振荡培养过夜;将菌液接种至500 mL LB液体培养基(含50μg/mL卡那霉素,在自诱导培养基中另外加入0.2%乳糖、0.05%葡萄糖、0.5%甘油、0.05 mol/L tris)中,37℃,250 r/min振荡培养至A600为0.8~1.2(约5 h)时,分别加入IPTG使其终浓度为0、1 mmol/L,37℃诱导表达过夜;4 500×g离心30 min,收集菌体,沉淀重悬于50 mL裂解液(PB+1%triton X100)中,冰上超声破碎(600 W超声3 s,间歇7 s,总工作时间30 min),4℃,30 000×g离心30 min,弃上清,沉淀用终浓度6 mol/L尿素溶液溶解,再次离心,收集上清,即为溶解的包涵体蛋白。
1.4重组N蛋白的纯化
1.4.1Ni柱亲和层析纯化工艺 用含尿素平衡缓冲液(50 mmol/L PB,100 mmol/L NaCl,pH 9.0,6 mol/L尿素)平衡Ni-NTA亲和柱;将6 mol/L尿素溶解的包涵体蛋白用上述平衡缓冲液稀释1倍上样,5 mL/min;上样完成后,继续用含尿素平衡缓冲液冲洗,直至280 nm紫外吸收峰回基线附近;分别用50、100、150、250、500 mmol/L咪唑缓冲液洗脱,分步收集样品。
1.4.2SP强阳离子交换层析纯化工艺 用含尿素平衡缓冲液(50 mmol/L PB,pH 9.0)+6 mol/L尿素平衡SP阳离子交换柱;将8 mol/L尿素溶解的包涵体蛋白用上述平衡缓冲液稀释2倍后上样,流速5 mL/min;上样完成后,继续用含尿素平衡缓冲液冲洗,直至280 nm紫外吸收峰回基线附近;用不含尿素平衡缓冲液(50 mmol/L PB,pH 9.0)缓慢置换含尿素平衡缓冲液,1 mL/min,使缓冲液中尿素含量逐步下降至0%,总时间800 min,使目的蛋白复性;分别用0.35 mol/L NaCl,50 mmol/L PB缓冲液洗除杂蛋白,0.45 mol/L NaCl,50 mmol/L PB缓冲液洗脱目的蛋白,收集样品,进行12%SDS-PAGE分析。1.4.3CM弱阳离子交换层析纯化工艺 将SP强阳离子交换层析洗脱的目的蛋白用50 mmol/L PB缓冲液(pH 9.0)稀释5倍,上CM柱,流速5 mL/min;上样完成后,继续用该缓冲液冲洗3倍柱体积;分别用缓冲液(50 mmol/L PB,0.25 mol/L NaCl,pH 9.0)洗除杂蛋白,缓冲液(50 mmol/L PB,0.3 mol/L NaCl,pH 9.0)洗脱目的蛋白,收集样品,进行12%SDS-PAGE分析。
1.5蛋白脱盐 用缓冲液(20 mmol/L tris,50 mmol/L甘氨酸,pH 8.0)平衡G25葡聚糖凝胶柱;取20 mL纯化后的重组N蛋白上柱,1 mL/min;用上述缓冲液冲洗,收集蛋白峰,加入终浓度为0.1%的SDS,-20℃保存。
1.6重组N蛋白鉴定 将纯化的重组N蛋白进行12%SDS-PAGE分离,300 mA恒流电转60 min;5%脱脂牛奶室温封闭1 h;加入兔抗SARS-CoV-2 N蛋白单抗(1∶2 000稀释),4℃孵育过夜;TBST洗膜3次,加入HRP标记的羊抗兔抗体(1∶10 000稀释),室温孵育1 h;加入TMB溶液显色。
1.7胶体金免疫检测试剂制备及性能测试 将胶体金标记的SARS-CoV-2 N蛋白与胶体金标记的鸡IgY按比例(5∶1)混合,以5μL/cm的速度喷制样品垫,在37℃干燥过夜。用鼠抗人IgM(2 mg/mL)、鼠抗人IgG(2 mg/mL)和羊抗鸡IgY(1 mg/mL)在硝酸纤维素膜上以1μL/cm的速度划线,分别标记为M、G和C线,在45℃干燥过夜。贴板、切条、装卡即得胶体金检测试剂。
试剂盒性能测试:28例经核酸检测确诊阳性的COVID-19患者灭活血清样本和70例非相关疾病患者灭活血清样本(由美国dAbImmunotech,lnc.公司提供),分别取10μL,滴入样本垫中,快速加入100μL PBS稀释液,15 min后通过IgM和/或IgG线及对照线的显色定性试验结果进行判定,红色为阳性。
2 结果
2.1N蛋白的表达 表达的重组N蛋白相对分子质量约为49 000,大小与理论值(48 850)相符,诱导后N蛋白以包涵体形式表达,表达量约占包涵体总蛋白的30%,见图1。
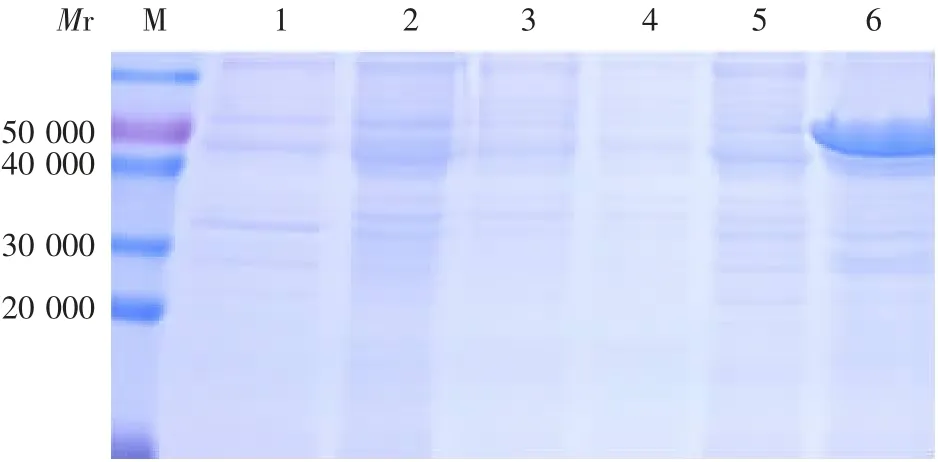
图1 表达的重组N蛋白的SDS-PAGE分析Fig.1 SDS-PAGEprofile of expressed recombinant Nprotein
2.2蛋白纯化
2.2.1Ni柱亲和层析纯化 用50、100、150、250和500 mmol/L咪唑缓冲液分离N蛋白与其他蛋白,虽然蛋白纯度有一定提高,但整体纯化效果不佳,收率低,不适用于重组N蛋白纯化,见图2。

图2 Ni-NTA亲和层析纯化的重组N蛋白的SDS-PAGE分析Fig.2 SDS-PAGE profile of recombinant N protein purified by Ni-NTA chromatography
2.2.2SP强阳离子交换层析纯化 大部分杂蛋白位于穿透峰中,重组N蛋白获得较好分离,见图3,图中2个箭头分别指示尿素浓度从6 mol/L逐步下降为0 mol/L的时间,共约850 min,下降速度约7 mmol/min。

图3 重组N蛋白的SP强阳离子交换层析图Fig.3 SPstrong cation exchange chromatogram of recombinant N protein
2.2.3CM弱阳离子交换层析纯化 有较多的杂蛋白得到分离,该纯化工艺进一步提高了N蛋白的纯度,见图4。

图4 重组N蛋白的CM弱阳离子交换层析图Fig.4 CM weak cation exchange chromatogram of recombinant N protein
2.3纯化产物的鉴定 SP强阳离子交换层析和CM弱阳离子交换层析两步纯化后的N蛋白经12%SDS-PAGE分析,纯度在90%以上,比Ni柱亲和层析纯化效率高。Western blot分析显示,该蛋白在相对分子质量49 000处可见特异性反应条带。见图5。重组N蛋白溶液在4℃保存1个月无明显降解(数据省略)。

图5 纯化的重组N蛋白的SDS-PAGE(A)及Western blot(B)分析Fig.5 SDS-PAGE(A)and Western blot(B)profiles of purified recombinant N protein
2.4胶体金免疫试剂性能 70例非相关疾病患者灭活血清样本的IgM和IgG抗体均为阴性,28例COVID-19患者灭活血清样本中19例显示IgM阳性,21例显示IgG阳性,表明该试剂可初步用于检测血清中的相应抗体。
3 讨论
SARS-CoV-2的N蛋白可用于血清学检测,也可作为免疫原制备单克隆抗体。N蛋白能以包涵体和可溶性蛋白的形式在大肠埃希菌中表达,但可溶性N蛋白表达的效率不高。为了实现N蛋白的稳定高产,包涵体是一种合适的表达形式,但包涵体在形成过程中包裹了大量的宿主蛋白和核酸,且包涵体蛋白是以一种无序的形式紧密折叠,无法提供正确的B细胞表位,降低了检测灵敏度及特异性。本研究设计了以阳离子交换色谱为主的纯化工艺,通过两步离子交换层析,蛋白质在层析柱上复性,使用非常柔和的复性条件,实现了包涵体蛋白的正确重折叠,保留了蛋白的天然活性。
包涵体中N蛋白以无序纠缠状态存在,密度较高,强碱性的N蛋白往往与酸性蛋白和核酸紧密结合。在高浓度尿素溶液中,重组N蛋白以一级结构形式存在,肽链得到充分舒展并与其他带阴离子的杂质因不同的电荷状态在阳离子树脂上获得分离。如果快速降低缓冲液中的尿素浓度,N蛋白会再次形成不溶性包涵体。而在SP强阳离子交换柱中缓慢降低尿素浓度的条件下,N蛋白缓慢实现了正确的重折叠,从而恢复了正确的二级结构,成为可溶性的活性蛋白,一步实现了重组N蛋白的纯化及复性。SP柱洗脱液仍有一定量的杂蛋白与重组N蛋白同时存在,为了分离这部分蛋白,使用颗粒更加精细、分辨率更高的CM弱阴离子树脂,利用两者携带电荷的差异分离杂蛋白,最终N蛋白电泳纯度大于90%,制备的胶体金免疫检测试剂也可初步用于检测血清中相应抗体。
大肠埃希菌表达的重组蛋白约80%会形成包涵体,目前工业生产的生物制药中也有30%仍然使用大肠埃希菌表达系统[9],利用包涵体实现重组蛋白的稳产高产具有重要意义,但没有一种通用的方法能够同时满足所有蛋白的复性,研究者们也使用了多种多样的手段和方法来实现包涵体的复性[10-15]。本研究采用两步阳离子交换层析、柱上复性的方法纯化N蛋白,效率高、操作简单、易于实现大规模生产,对于其他包涵体蛋白的纯化也具有借鉴价值。
